- 2021-05-13 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学知识检漏表
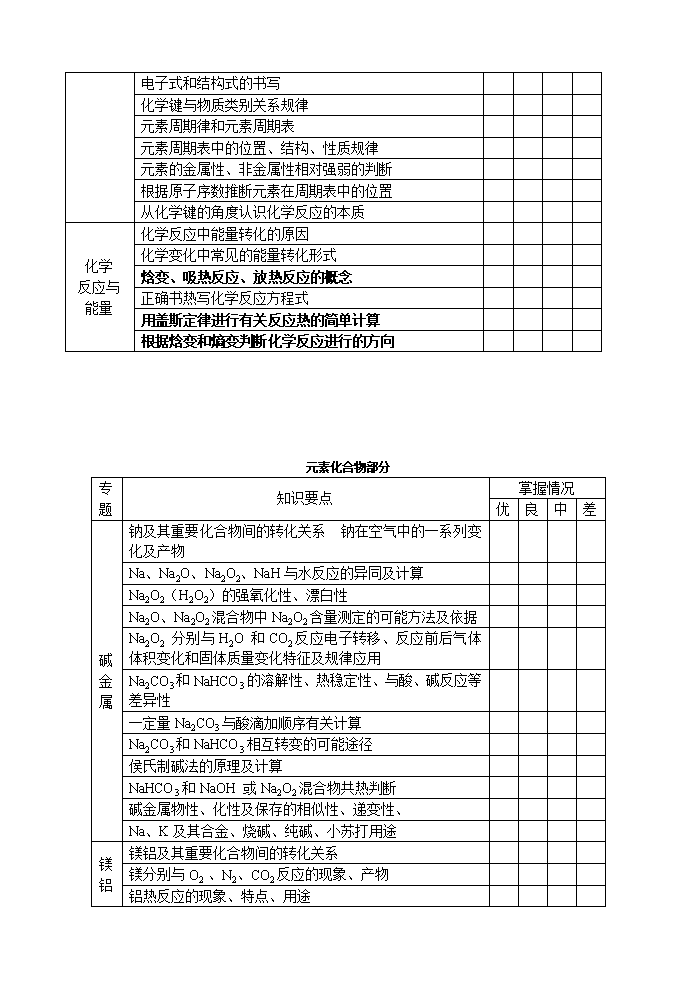
专题 知识要点 掌握情况 优 良 中 差 物质 的量 有关物质的量的基本概念 以物质的量为中心的各物理量间的相互关系 阿伏加德罗定律及其推论 物质的量浓度 物质的量浓度溶液的配制及其误差分析 溶液浓度的计算和换算 有关NA选择题 分散系 分散系的分类和分散质粒子直径大小的关系 胶体的性质,胶体与溶液的鉴别方法,胶体的其应用 氢氧化铁胶体的制备 固体物质溶解度的相关计算 溶液浓度的表示方法—溶质质量分数和物质的量浓度的相互关系 氧化还原反应 氧化还原反应的判断与四个基本反应的关系 氧化剂、还原剂、氧化产物、还原产物及其相互关系 氧化还原反应电子转移的表示方法 氧化性、还原性强弱的判断方法 常见的氧化剂和还原剂归纳和应用 氧化还原反应的配平 应用守恒法进行氧化还原反应的计算 水溶液中的离子平衡 电解质与非电解质,强电解质与弱电解质的判断 书写离子方程式、离子方程式正误判断 离子大量共存问题的判断 酸碱性强弱的比较和判断 影响弱电解质电离平衡的因素 水的电离平衡及其影响因素 溶液的pH及其酸碱性 酸碱溶液稀释pH的变化 关于溶液pH的计算 盐类水解的概念及其实质 盐类水解的规律和类型 影响盐类水解的因素 盐类水解的应用 溶液中离子浓度大小比较的规律 电荷守恒和物料(元素守恒)规律 难溶电解质的溶解平衡及其影响因素 沉淀的生成、溶解和转化 中和滴定的概念及其原理 中和滴定的仪器及其试剂 中和滴定过程中溶液pH的变化曲线 高考化学知识自我反馈表 基本理论知识 专题 知识要点 掌握情况 优 良 中 差 电化学 原电池及其工作原理 常见电池的类型及其电极反应书写规律 燃料电池及其电极反应书写规律 金属的腐蚀及其防护 原电池原理的应用 电解原理的及其应用 电解电极反应的书写及点解前后溶液pH变化 与电化学有关的计算——电子得失守恒 化学 平衡 化学速率的概念及其表示方法 化学反应速率大小的比较 影响化学反应速率的因素 压强对气体反应体系速率的影响 化学反应速率的图像曲线 有关化学反应速率的计算 化学平衡状态的涵义 化学平衡状态标志的判断 等效平衡原理及其规律 化学平衡常数的含义 有关化学平衡常数和转化率的计算——三段式的方法 化学平衡的图像和曲线 改变反应物用量对转化率(α)的影响 影响化学平衡的因素 用图像表示外界条件对反应速率和化学平衡的影响 分析化学平衡的方法与技巧 (一边倒的极限法和画容器分析的模型法) 物质 结构 元素、核素、同位素的含义 核电荷数、质子数、中子数、核外电子数之间的关系 元素的原子半径、离子半径大小比较的规律 电子式和结构式的书写 化学键与物质类别关系规律 元素周期律和元素周期表 元素周期表中的位置、结构、性质规律 元素的金属性、非金属性相对强弱的判断 根据原子序数推断元素在周期表中的位置 从化学键的角度认识化学反应的本质 化学 反应与能量 化学反应中能量转化的原因 化学变化中常见的能量转化形式 焓变、吸热反应、放热反应的概念 正确书热写化学反应方程式 用盖斯定律进行有关反应热的简单计算 根据焓变和熵变判断化学反应进行的方向 元素化合物部分 专题 知识要点 掌握情况 优 良 中 差 碱金属 钠及其重要化合物间的转化关系 钠在空气中的一系列变化及产物 Na、Na2O、Na2O2、NaH与水反应的异同及计算 Na2O2(H2O2)的强氧化性、漂白性 Na2O、Na2O2混合物中Na2O2含量测定的可能方法及依据 Na2O2 分别与H2O 和CO2反应电子转移、反应前后气体体积变化和固体质量变化特征及规律应用 Na2CO3和NaHCO3的溶解性、热稳定性、与酸、碱反应等差异性 一定量Na2CO3与酸滴加顺序有关计算 Na2CO3和NaHCO3相互转变的可能途径 侯氏制碱法的原理及计算 NaHCO3和NaOH 或Na2O2混合物共热判断 碱金属物性、化性及保存的相似性、递变性、 Na、K及其合金、烧碱、纯碱、小苏打用途 镁铝 镁铝及其重要化合物间的转化关系 镁分别与O2 、N2、CO2反应的现象、产物 铝热反应的现象、特点、用途 铝与NaOH 溶液反应的电子转移表示方法 关于铝与酸、碱反应放出H2的定量分析 氢氧化铝的两种电离方式及两性问题 有关明矾的净水原理 铝盐与强弱碱、偏铝酸盐与强弱酸反应程度 有关“铝三角”及氢氧化铝沉淀图像分析及计算问题 海水或“卤水”中MgCl2的提纯问题 铝土矿中Al2O3的提纯问题 铝盐、镁盐的溶液加热的最终产物问题 铁铜 合金的概念、性质、用途 铁铜及其重要化合物间的转化关系 Fe与氧化性酸特点及规律 Fe3+、Fe2+、Fe的相互转化(铁三角) 铁、铜与Fe3+、Cu2+ 、Fe2+反应后固、液成分的判断 铁的常见三种氧化物的性质、制备比较 Fe(OH)3、Fe(OH)2的性质比较 Fe(OH)2制备的有效措施 Fe2+和Fe3+的检验 有关铁、铜与硝酸反应图像分析及计算问题 专题 知识要点 掌握情况 优 良 中 差 卤族 元素 氯及其重要化合物间的转化关系 氯水的成分及实验事实 HClO/ClO-的性质 常见漂白剂种类、原理、范围及效果 氯气的实验室制法(装置、原理、除杂、验满、收集、尾气处理等) Cl2与Fe2+、Br-、I-反应的顺序及产物的判断 卤素单质及在不同溶剂中呈现的颜色 溴水褪色方法(有机、无机) 卤素单质性质的递变性、相似性、特殊性 X2与H2O反应的特点 HX酸性、还原性、不稳定性的变化规律 淀粉-KI、淀粉-I2的颜色变化 卤化银的颜色、溶解性、感光性及用途 氧族 元素 硫及其重要化合物间的转化关系 O3的重要性质、用途 能实现S2-→S转化的试剂及反应 SO2气体的两种重要的实验室制法 (装置、原理、除杂、验满、收集、尾气处理等) SO2、H2SO3、SO32-的重要性质 SO2参与反应的颜色变化及特点 浓硫酸的四大重要性质 SO42-、SO32-的鉴定、鉴别 Cu、Fe、Zn与一定量浓H2SO4反应产物分析 氮族 元素 氮及其重要化合物间的转化关系 N2的分子结构与反应特点 氮的主要氧化物性质比较及吸收 NO、NO2与O2、H2O反应计算 NO、NO2的实验室制法 (装置、原理、除杂、收集、尾气处理等) 氨的分子结构、性质及用途(氢键、配位键、还原性等) 氨气的制法(装置、原理、除杂、验满、收集、尾气处理等) 铵盐的性质、检验 浓硝酸的重要性质及保存 碳族 元素 碳、硅及其重要化合物间的转化关系 C、CO的重要性质(还原性、可燃性) Si 、SiO2 、Na2SiO3的重要化性、用途 H4SiO4、H2SiO3的性质(难溶性、不稳定性、弱酸性) 重要的硅酸盐产品 新型无机非金属材料的特点及用途 有机化学部分 专题 知识要点 掌握情况 优 良 中 差 有机物组成、分类、命名 判断物质是否属于有机物 常见有机物的分类方法与标准 能根据官能团的不同判别有机物的类型 各类有机物的结构特征、组成通式 常见有机物的系统命名方法 研究有机化合物的一般步骤和方法(有机化学P17——21) 根据质谱图确定有机物的相对分子质量,元素分析法确定有机物的元素组成及分子式 根据红外光谱和核磁共振氢普确定有机物的结构简式 有机物的结构 同系物、同系列、同分异构体概念及判断 烯烃的顺反异构及手性碳的判断 能根据给定要求寻找相应同分异构体或确定同分异构体的数目 常见烃基的结构(甲基、乙基、丙基、丁基、戊基、苯基) 分析有机物分子中原子的共线共面问题 烃 甲烷的及烷烃的结构、物性、化性、用途 乙烯及烯烃的结构、物性、化性、制法、用途 乙炔及炔烃的结构、物性、化性、制法、用途 1,3——丁二烯等二烯烃的结构、化性 苯及其同系物结构、物性、化性、用途 石油、煤的加工方法和综合利用 天然气、液化石油气和汽油的主要成分及其应用 烃的衍生 物 溴乙烷、二溴乙烷及卤代烃的物性、化性、用途 乙醇、乙二醇、丙三醇及醇类的结构物性化性用途 苯酚及酚类的结构、物性、化性、用途 乙醛、甲醛及醛类的结构、物性、化性、用途 甲酸、乙酸及饱和一元羧酸结构、物性、化性、用途 丙烯酸、乙二酸的结构、化性 乙酸乙酯及酯类的结构、物性、化性、制法、用途 糖、 油脂、 蛋白质 油脂及高级脂肪酸的结构、物性、化性、制法、用途 常见高级脂肪酸(硬脂酸、软脂酸、油酸和亚油酸) 糖类的结构、物性、化性、用途 常见氨基酸的结构、化性、用途 蛋白质的结构及重要性质(有机化学P88) 有机反应类型 取代反应(类别、条件) 加成反应(类别、条件) 消去反应(类别、条件) 聚合反应(类别、条件) 氧化反应、还原反应(判断依据、类别、条件) 其他反应(类别、条件) 有机合成 根据所给信息完成简单的有机合成 有机框图推断题 逆合成分析法(有机化学P64—67) 重要官能团的常见引入和脱去的方法 溴在有机物反应的使用 酸性高锰酸钾在有机化学中的应用 专题 知识要点 掌握情况 优 良 中 差 高分子化合物 形成高分子化合物的反应:加聚和缩聚 单体、链节和聚合度 由高分子化合物结构和单体结构的相互推导 乙烯型分子加聚,二元酸和二元醇缩聚,羟基酸的缩聚,酚醛树脂形成的化学方程式 三大合成材料(有机化学P104—110) 化学实验部分 专题 知识要点 掌握情况 优 良 中 差 化学实验常用仪器的主要用途和使用方法 容器与反应器(加热与不能加热) (试管、坩埚、蒸发皿、烧杯、烧瓶、锥形瓶、集气瓶、试剂瓶、启普发生器、滴瓶) 热源仪器(酒精灯、酒精喷灯、煤气灯) 测量器(量筒、容量瓶、滴定管) 计量器(托盘天平、温度计) 漏斗(普通漏斗、长颈漏斗、分液漏斗) 干燥仪器(洗气瓶、干燥管、干燥器) 支撑器(铁架台、铁夹、铁圈、三角架、试管夹、滴定管夹) 取物质仪器(药匙、镊子、坩埚钳、胶头滴管) 其他(玻璃棒、橡胶塞、弹簧夹、毛玻璃片、表面皿、铂丝、蓝色玻璃片) 常 见 试 剂 的存放 可与空气或水蒸气作用(锂、钠、钾、白磷、过氧化钠、电石、氢氧化钠、浓硫酸) 易挥发(溴、浓盐酸、浓氨水) 见光受热易分解(浓硝酸、硝酸银、溴化银、碘化银) 强腐蚀性(氢氧化钠、氢氟酸) 化学实验的基本操作 玻璃仪器的洗涤 药品的称量 试剂的取用(固、液、气) 试剂的溶解(固、液、气) 物质的加热(仪器、药品<固、液、气>) 试纸的使用(pH试纸、石蕊试纸、淀粉碘化钾试纸) 密封性检验(检查装置气密性、容器的口及玻璃活塞是否漏液) 焰色反应(操作步骤、操作方法、观察火焰的附加措施、适应对象) 闻气体的气味(规范操作) 实验室制 取 气 体 典型反应类型(根据反应物的状态和反应条件划分共六种) 典型反应装置(对应上述典型反应类型共六套) 收集方法(排液法、排气法、软气袋收集法) 气体的净化方法(干燥、除杂) 专题 知识要点 掌握情况 优 良 中 差 实验室制 取 气 体 常见气体的制取 (O2、NH3、Cl2、NO、CH2=CH2、CH≡CH、H2、CO2、SO2、NO2) 物质的检 验 常见气体的检验 (O2、H2、CO2、H2O、CO、Cl2、HCl、SO2、NO、NO2、NH3、CH4、C2H4、C2H2) 常见阳离子检验 (H+、Na+、K+、Ca2+、NH4+、Fe3+、Fe2+、Mg2+ 、Al3+、Cu2+、Ag+、Ba2+) 常见阴离子检验 (OH-、Cl-、Br-、I-、SO42-、SO32-、CO32-、HCO3-、NO3-、SiO32-) 常见有机物的重要特征 (碳碳双键、碳碳叁键、苯、甲苯、乙醇、苯酚、乙醛、葡萄糖、淀粉、蛋白质、溴乙烷) 物质的分离与提 纯 物质分离与提纯常用的基本方法 (过滤法、结晶法、蒸馏<分馏>法、萃取法、分液法、渗析法、洗气法、加热分解法、加酸转化法、加碱转化法、加沉淀剂转化法、氧化还原法、加热升华法) 定 量 实 验(实验原理、实验步骤、误差分析) 配制溶质质量分数一定的溶液 配制一定物质的量浓度的溶液 酸碱中和滴定 中和热测定 化学探究实验方案的设计 设计实验方案的基本思路 (实验目的→实验原理→选择仪器和药品→设计实验装置→设计操作步骤和观察重点、分析实验中注意事项→写出实验报告) 设计化学实验方案的基本要求 (科学性、安全性、可行性、简约性) 化学实验方案的评价 (科学性评价、安全性评价、可行性评价、简约性评价) 专题 知识要点 掌握情况 优 良 中 差 原子结构与性质 多电子原子中核外电子分层排布遵循的原理 能用电子排布式表示常见元素(1~36号)原子核外电子的排布 同一周期、同一主族中元素电离能和电负性的变化规律 分子结构与性质 共价键的主要类型σ键和π键 能用键能、键长、键角等数据说明简单分子的某些性质 极性键和非极性键 极性分子和非极性分子及其性质的差异 能根据杂化轨道理论 价层电子对互斥模型判断简单分子或离子的空间构型 “等电子原理”的含义及其应用 简单配合物的成键情况 晶体结构与性质 NaCl型和CsCl型离子晶体的结构特征 能根据离子化合物的结构特征和晶格能解释离子化合物的物理性质 原子晶体的特征 金刚石、二氧化硅等原子晶体的结构与性质的关系 金属键的含义,能用金属键的自由电子理论解释金属的一些物理性质 金属晶体的基本堆积方式,了解常见金属晶体的晶胞结构 分子间作用力的含义,了解化学键和分子间作用力的区别 分子晶体的含义,了解分子间作用力的大小对物质某些物理性质的影响 氢键的存在对物质性质的影响 分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别 选考内容 一、注重选择题 14道选择题经常涉及到的知识点 STS内容 能量问题(热化学方程式) 周期律和周期表 实验基本操作综合 设计化学实验方案 从有机物的结构推断物质性质 电化学 化学平衡与化学反应速率 溶液中离子浓度大小的比较 化学用语 离子方程式的正误判断 阿伏加德罗常数 氧化还原反应 溶液中离子是否共存的判断 二、影响全局的化学学科思想 1.守恒思想 2.平衡思想 3.物质的量为核心 4.结构 性质 用途 制备 保存等 三、易失误失分的情况: (1)审题不够仔细; (2)语言表达不够清楚,切忌说话不完整; (3)书写不够规范查看更多