- 2021-05-13 发布 |
- 37.5 KB |
- 27页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
天津高考理综真题试题卷含答案
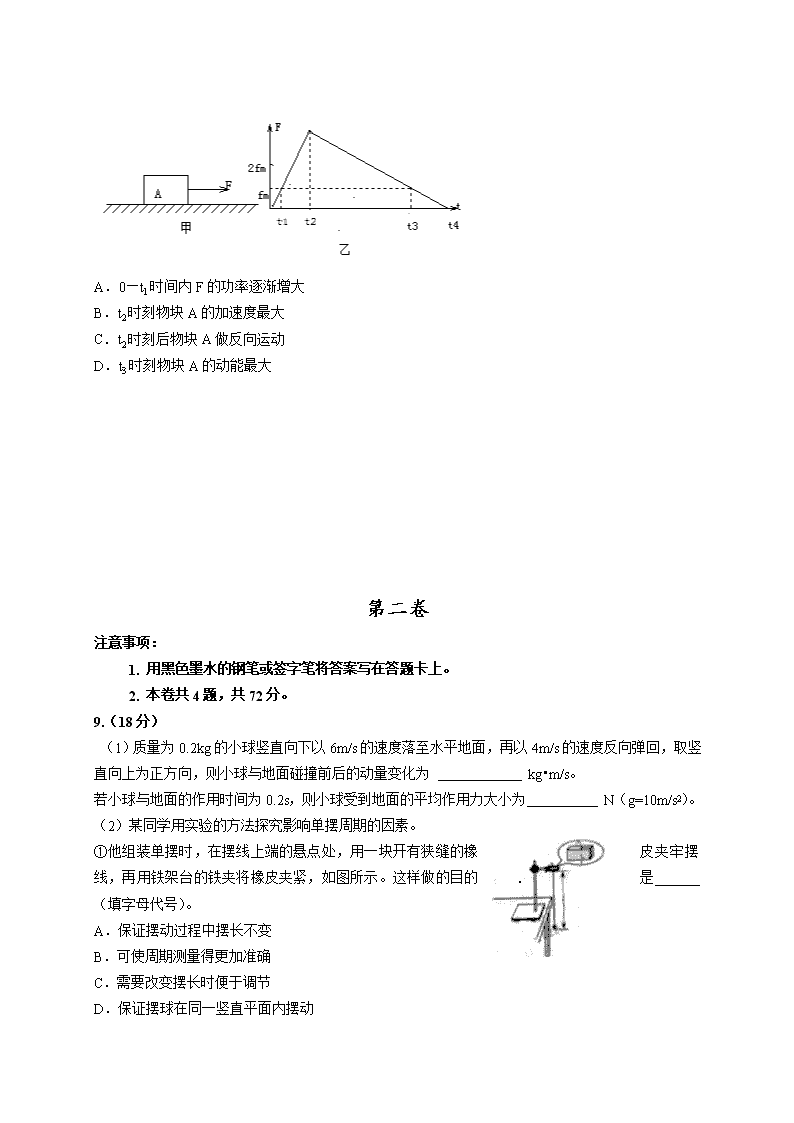
高中物理 2012年普通高等学校招生全国统一考试(天津卷) 理科综合 物理部分 第Ⅰ卷 一,单项选择题(每小题6分,共30分。每小题给出的四个选项中,只有一个选项是正确的) 1. 下列说法正确的是 A. 采用物理或化学方法可以有效地改变放射性元素的半衰期 B. 由波尔理论知道氢原子从激发态跃迁到基态时会放出光子 C. 从高空对地面进行遥感摄影是利用紫外线良好的穿透能力 D. 原子核所含核子单独存在时的总质量小于该原子核的质量 2. 如图所示,金属棒MN两端由等长的轻质细线水平悬挂,处于竖直向上的匀强磁场中,棒中通以由M向N的电流,平衡时两悬线与竖直方向夹角均为,如果仅改变下列某一个条件,θ角的相应变化情况是 A. 棒中的电流变大,θ角变大 B. 两悬线等长变短,θ角变小 C . 金属棒质量变大,θ角变大 D. 磁感应强度变大,θ角变小 3. 一人造地球卫星绕地球做匀速圆周运动,假如该卫星变轨后做匀速圆周运动,动能减小为原来的1/4,不考虑卫星质量的变化,则变轨前后卫星的 A.向心加速度大小之比为4:1 B.角速度大小之比为2:1 C.周期之比为1:8 D.轨道半径之比为1:2 4.通过一理想变压器,经同一线路输送相同电功率P,原线圈的电压U保持不变,输电线路的总电阻为R。当副线圈与原线圈的匝数比为K时,线路损耗的电功率为P1,若将副线圈与原线圈的匝数比提高到Nk,线路损耗胡电功率为P2, 则P1和P2/P1分别为 A.PR/kU,1/n B(P/kU)2R, 1/n C. PR/kU, 1/n2 D (P/kU)2R,1/n2 5. 两个固定胡等量异号点电荷所产生电场等势面如图中虚线所示,一带负电的粒子以某一速度从图中A点沿图示方向进入电场在纸面内飞行,最后离开电场,粒子只受静电力作用,则粒子在电场中 A.做直线运动,电势能先变小后变大 B.做直线运动,电势能先变大后变小 C.做曲线运动,电势能先变小后变大 D.做曲线运动,电势能先变大后变小 二、不定项选择题(每小题6分,共18分。每小题给出的4个选项中,都有多个选项是正确的,全部选对的得6分,选对但不全的得3分,有选错或不答的得0分) 6、半圆形玻璃砖横截面如图,AB为直径,O点为圆心。在该截面内有a 、b 两束单色 可见光从空气垂直于AB摄入玻璃砖, 两入射点到O的距离相等。两束光在半圆边界上反射和折射的情况如图所示:则a、b两束光, A在同种均匀介质中传播,a光的传播速度较大 B以相同的入射角从空气斜射入水中,b光的折射角大 C若a光照射某金属表面能发生光电效应,b光也一定能 D分别通过同一双缝干涉装置,a光的相邻亮条纹间距大 7. 沿X轴正向传播的一列简谐横波在t=0时刻的波形如图所示,M为介质中的一个质点,该波的传播速度为40m/s,则t=(1/40)s 时 A. 质点M对平衡位置的位移一定为负值 B. 质点M的速度方向与对平衡位置的位移方向相同 C. 质点M的加速度方向与速度方向一定相同 D. 质点M的加速度与对平衡位置的位移方向相反 8. 如图甲所示,静止在水平地面的物块A,受到水平向右的拉力F的作用,F与时间t的关系如图乙所示,设物块与地面的静摩擦力最大值fm与滑动摩擦力大小相等,则 A.0—t1时间内F的功率逐渐增大 B.t2时刻物块A的加速度最大 C.t2时刻后物块A做反向运动 D.t3时刻物块A的动能最大 第二卷 注意事项: 1. 用黑色墨水的钢笔或签字笔将答案写在答题卡上。 2. 本卷共4题,共72分。 9.(18分) (1)质量为0.2kg的小球竖直向下以6m/s的速度落至水平地面,再以4m/s的速度反向弹回,取竖直向上为正方向,则小球与地面碰撞前后的动量变化为 kg•m/s。 若小球与地面的作用时间为0.2s,则小球受到地面的平均作用力大小为 N(g=10m/s2)。 (2)某同学用实验的方法探究影响单摆周期的因素。 ①他组装单摆时,在摆线上端的悬点处,用一块开有狭缝的橡皮夹牢摆线,再用铁架台的铁夹将橡皮夹紧,如图所示。这样做的目的是 (填字母代号)。 A.保证摆动过程中摆长不变 B.可使周期测量得更加准确 C.需要改变摆长时便于调节 D.保证摆球在同一竖直平面内摆动 ②他组装好单摆后在摆球自然悬垂的情况下,用毫米刻度尺从悬点量到摆球的最低端的长度L=0.9990m,再用游标卡尺测量摆球直径,结果如图所示,则摆球的直径为 mm,单摆摆长为 m。 ③下列摆动图像真实地描述了对摆长约为1m的单摆进行周期测量的四种操作过程,图中横坐标原点表示计时开始,A、B、C均为30次全振动图像,已知sin5°=0.087,sin15°=0.026, 这四种操作过程合乎实验要求且误差最小的是 (填字母代号) (3)某同学在进行扩大电流表量程的实验时,需要知道电流表的满偏电流和内阻。他设计了一个用标准电流表G1来校对待测电流表G2的满偏电流和测定G2内阻的电路,如图所示。已知G1的量程略大于G2的量程,图中R1为滑动变阻器。R2为电阻箱。该同学顺利完成了这个实验。 ①实验过程包含以下步骤,其合理的顺序依次为__________________ A. 合上开关S2 A. 分别将R1和R2的阻值调至最大 B. 记下R2的最终读数 C. 反复调节R1和R2的阻值,使G1的示数仍为I1,使G2的指针偏转到满刻度的一半,此时R2的最终读数为r D. 合上开关S1 E. 调节R1使G2的指针偏转到满刻度,此时G1的示数为I1,记下此时G1的示数 ②仅从实验设计原理上看,用上述方法得到的G2内阻的测量值与其真实值相比_______(填偏大、偏小或相等) ③若要将G2的量程扩大为I,并结合前述实验过程中测量得结果,写出须在G2上并联的分流电阻RS的表达式,RS= 10、如图所示,水平地面上固定有高为h的平台,台面上固定有光滑坡道,坡道顶端局台面高也为h,坡道底端与台面相切。小球A从坡道顶端由静止开始滑下,到达水平光滑的台面后与静止在台面上的小球B发生碰撞,并粘连在一起,共同沿台面滑行并从台面边缘飞出,落地点与飞出点的水平距离恰好为台高的一半。两球均可视为质点,忽略空气阻力,重力加速度为g。求 (1)小球A刚滑至水平台面的速度VA (2)A、B两球的质量之比ma:mb 11.(18分)如图所示,一对光滑的平行金属导轨固定在同一水平面内,导轨间距L=0.5m,左端接有阻值R=0.3Ω的电阻,一质量m=0.1kg,电阻r=0.1Ω的金属棒MN放置在导轨上,整个装置置于竖直向上的均强磁场中,磁场的磁感应强度B=0.4T。棒在水平向右的外力作用下,由静止开始a=2m/s2的加速度做均加速运动,当棒的位移x=9m时撤去外力,棒继续运动一段距离后 停下来,已知撤去外力前后回路中产生的焦耳热比Q1:Q2=2:1.导轨足够长且电阻不计,棒在运动过程中始终与导轨垂直且两端与导轨保持良好接触。求 (1)棒在匀加速运动过程中,通过电阻R的电荷量q; (2)撤去外力后回路中产生的焦耳热Q2; (3)外力做的功Wf。 12.(20分)对铀235的进一步研究在核能的开发和利用中具有重要的意义。如图所示,质量为m、电荷量为q的铀235离子,从容器A下方的小孔S1不断飘入加速电场,其初速度可视为零,然后经过小孔S2垂直与磁场方向进入磁感应强度为B的均强磁场中,做半径为R的均速圆周运动,离子行进半个圆周后离开磁场并被收集,离开磁场时离子束的等效电流I。不考虑离子重力及离子间的相互作用。 (1)求加速电场的电压U; (2)求出在离子被收集的过程中任意间t内收集到离子的质量M; (3)实际上加速电压的大小在U±ΔU范围内微小变化。若容器A中有电荷量相同的铀235和铀238两种离子,如前述情况它们经电场加速后进入磁场中发生分离,为使这两种离子在磁场中运动的轨迹不发生交叠,应小于多少?(结果用百分数表示,保留两位有效数字) 2012年普通高等学校招生全国统一考试(天津卷) 理科综合 生物部分 理科综合共300分,考试用时150分钟 生物试卷分为第Ⅰ卷(选择题)和第Ⅱ卷两部分,第Ⅰ卷1至2页,第Ⅱ卷3至5页,共80分。 答卷前,考生务必将自己的姓名、准考号填写在答题卡上,并在规定位置粘贴考试用条形码。答卷时,考试务必将答案涂写在答题卡上,答在试卷上的无效。考试结束后,将本试卷和答题卡一并交回。 祝各位考生考试顺利! 第Ⅰ卷 注意事项: 1. 每题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。 2. 本卷共6题,每题6分,共36分。在每题给出的四个选项中,只有一项是最符合题目要求的。 1、 下列有关于细胞的叙述,错误的是 A. 自体干细胞移植通常不会引起免疫排斥反应 B. 胚胎干细胞在体外培养能增值但不能被诱导分化 C. 组织的细胞更新包括细胞凋亡和干细胞增殖分化等过程 D. 造血干细胞具有分化出多种血细胞的能力,可用于治疗白血病 2、 芥酸会降低菜籽油的品质。油菜有两对独立遗传的等位基因(H和h,G和g)控制菜籽的芥酸含量,下图是获得低芥酸油菜新品种(HHGG)的技术路线。已知油菜单个花药由花药壁(2n)及大量花粉(n)等组分组成,这些组分的细胞都具有全能性。 据图分析,下列叙述错误的是 A. ①、②两过程均需要植物激素来诱导细胞脱分化 B. 与④过程相比,③过程可能会产生二倍体再生植株 C. 图中三种途径中,利用花粉培养筛选低芥酸植株(HHGG)的效率最高 D. F1减数分裂时,H基因所在的染色体会与G基因所在的染色体发生联会 3、 动物被运输过程中,体内皮质醇激素的变化能调节 其对刺激的适应能力。右图为皮质醇分泌的调节示 意图。据图分析,下列叙述错误的是 A. 运输刺激使下丘脑分泌激素增加的结构基础是反射弧 B. 图中M促进皮质醇分泌的过程属于神经-体液调节 C. 皮质醇作用的靶细胞还包括下丘脑细胞核垂体细胞 D. 动物被运输过程中,体内皮质醇含量先升高后逐渐恢复 1、 下列实验操作能达到预期结果的是 A. 在“观察根尖分生组织细胞的有丝分裂”试验中,统计 每一时期细胞数占计数细胞总数的比例,能比较细胞周期 各时期的时间长短 B. 在“探究细胞大小与物质运输的关系”实验中,计算紫红色区域的体积与整个琼脂块的体积之比,能反映NaOH进入琼脂块的速度 C. 在“探究培养液中醇母菌种群数量变化”实验中,培养期内共三次取样测定密度。即可准确绘制醇母菌种群增长曲线 D. 在“探究a-萘乙酸促进插条生根的最适浓度”实验中,用高浓度组的a-萘乙酸溶液浸泡插条基部一天后,观察生根情况以确定最适浓度 5.设置不同CO2浓度,分组光照培养蓝藻,测定净光合速率和呼吸速率(光合速率=净光合速率+呼吸速率),结果见右图。据图判断,下列叙述正确的是 A.与d3浓度相比,d1浓度下单位时间内蓝藻细胞光反应生成的[H]多 B.与d2浓度相比,d3浓度下单位时间内蓝藻细胞呼吸过程产生的ATP多 C.若d1、d2、d3浓度下蓝藻种群的K值分别为K1、K2、K3,则K1>K2>K3 D.密闭光照培养蓝藻,测定种群密度及代谢产物即可判断其是否为碱性厌氧生物 6.果蝇的红眼基因(R)对白眼基因(r)为显性,位于X染色体上;长翅基因(B)对残翅基因(b)为显性,位于常染色体上。现有一只红眼长翅果蝇与一只白眼长翅果蝇交配,F1代的雄果蝇中约有1/8为白眼残翅。下列叙述错误的是 A.亲本雌果蝇的基因型是BbXRXr B.亲本产生的配子中含Xr的配子占1/2 C.F1代出现长翅雄果蝇的概率为3/6 D.白眼残翅雌果蝇能形成bbXrXr类型的次级卵母细胞 2012年普通高等学校招生全国统一考试(天津卷) 理科综合 生物部分 第II卷 注意事项: 1.用黑色墨水的钢笔或签字笔将答案写在答题卡上。 2.本卷共3题,共44分。 7.(13分)生物分子间特异性结合的性质广泛用于生命科学研究。以下实例为体外处理“蛋白质-DNA复合体”获得DNA片段信息的过程图。 据图回答: (1)过程①酶作用的部位是 键,此过程只发生在非结合区DNA,过程②酶作用的部位是 键 (2)①、②两过程利用了酶的 特性。 (3)若将得到的DNA片段用于构建重组质粒,需要将过程③的测序结果与 酶的识别序列进行比对,以确定选用何种酶。 (4)如果复合体中的蛋白质为RNA聚合酶,则其识别、结合的DNA序列区为基因的 。 (5)以下研究利用了生物分子间特异性结合性质的有 (多选)。 A.分离得到的核糖体,用蛋白酶酶解后提取rRNA B.用无水乙醇处理菠菜叶片,提取叶绿体基粒膜上的光和色素 C.通过分子杂交手段,用荧光物质标记的目的基因进行染色体基因定位 D.将抑制成熟基因导入番茄,其mRNA与催化成熟酶基因的mRNA互补结合,终止后者翻译,延迟果实成熟 8.(20分)黄曲霉毒素B1(AFB1)存在于被黄曲霉菌污染的饲料中,它可以通过食物链进入动物体内并蓄积,引起癌变。某些微生物能表达AFB1解毒酶,将该酶添加在饲料中可以降解AFB1,消除其毒性。 回答下列问题: (1)AFB1属于 类致癌因子。 (2)AFB1能结合在DNA的G上,使该位点受损伤变为G·在DNA复制中,G·会与A配对。现有受损伤部位的序列为,经两次复制后,该序列突变为 。 (3)下图为采用基因工程技术生产AFB1解毒酶的流程图。 据图回答问题: ①在甲、乙条件下培养含AFB1解毒酶基因的菌株,经测定,甲菌液细胞密度小、细胞含解毒酶:乙菌液细胞膜密度大、细胞不含解毒酶。过程I应选择 菌液的细胞提取总RNA,理由是 。 ②过程II中,与引物结合的模板是 。 ③检测酵母过程菌是否合成了AFB1解毒酶。应采用 方法。 (4)选取不含AFB1的饲料和某种实验动物为材料,探究该AFB1解毒酶在饲料中的解毒效果。实验设计及测定结果见下表。 据表回答问题: ①本实验的两个自变量分别为 。 ②本实验中,反映出AFB1 解毒酶解毒效果的对照组是 。 ③经测定,某污染饲料中AFB1含量为100μg/kg,则每千克饲料应添加 克 解毒酶,解毒效果最好,同时节约了成本。 (5)采用蛋白质工程进一步改造该酶的基本途径是:从提高酶的活性出发,设计预期的蛋白质结构,推测应有的氨基酸序列,找到相对应的 序列 9.(11分)夏初。在某河口多地点采集并测定水样,结果表明,各采样点无机氮浓度相近,而无机磷浓度差异较大。按无机磷浓度由低到高的顺序,绘制各采样点对应的浮游植物和浮游动物的密度曲线,结果如下图。 据图回答: (1)磷元素进入浮游植物细胞后,以 分子的形式成为细胞膜支架的成分;在细胞内,磷元素通过参与 反应(写反应式),保持细胞内ATP含量的相对稳定。 (2)分析发现,P1、P2采样点浮游植物种类差别非常明显,从进化角度分析,这是 的结果。 (3)无机磷浓度高于P1的采样点,浮游动物的密度反而比P1采样点低,下列有关其原因分析,不可能的是 (单选)。 A.可被浮游动物取食的浮游植物种类较少 B.水体溶解氧较高 C.浮游动物的捕食者数量较多 D.水体有害物质浓度较高 (4)请用箭头补充完成该河口生物群落中氮元素的流向图。、 绝密★启用前 2012年普通高等学校招生全国统一考试(天津卷) 理科综合 化学部分 理科综合共300分,考试用时150分钟。 化学试卷分为第Ⅰ卷(选择题)和第Ⅱ卷两部分,第Ⅰ卷1至2页,第Ⅱ卷3至6页,共100分。 答卷前,考生务必将自己的姓名、准考号填写在答题卡上,并在规定位置粘贴考试用条形码。答卷时,考生务必将答案涂写在答题卡上,答在试卷上的无效。考试结束后,将本试卷和答题卡一并交回。 祝各位考生考试顺利! 第Ⅰ卷 注惹事项: 1.每题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。 2.本卷共6题,每题6分,共36分。在每题给出的四个选项中,只有一项是最符合题目要求的。 以下数据可供解题时参考:相对原子质量:H 1 O 16 S 32 Cu 64 1.根据下列物质的化学性质,判断其应用错误的是 ( ) A.酒精能使蛋白质变性,可用于杀菌消毒 B.CaO能与SO2反应,可作工业废气的脱硫剂 C.明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 D.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 2.下列单质或化合物性质的描述正确的是 ( ) A.NaHSO4水溶液显中性 B.SiO2与酸、碱均不反应 C.NO2溶于水时发生氧化还原反应 D.Fe在足量Cl2中燃烧生成FeCl2和FeCl3 3.下列叙述正确的是 ( ) A.乙酸与丙二酸互为同系物 B.不同元素的原子构成的分子只含极性共价键 C.U和U是中子数不同质子数相同的同种核素 D.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 4.完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是 ( ) A B C D 实 验 用CCl4提取 溴水中的Br2 除去乙醇中的苯酚 从KI和I2的固体 混合物中回收I2 配制100 mL 0.1000 mol·L-1 K2Cr2O7溶液 装 置 或 仪 器 5.下列电解质溶液的有关叙述正确的是 ( ) A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 C.含l mol KOH的溶液与l mol CO2完全反应后,溶液中c(K+)=c(HCO) D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) 6.已知2SO2 (g) + O2 (g) 2SO3 (g);ΔH = -197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是 ( ) A.容器内压强P:P甲=P丙 > 2P乙 B.SO3的质量m:m甲=m丙 > 2m乙 C.c(SO2)与c(O2)之比k:k甲=k丙 > k乙D.反应放出或吸收热量的数值Q:Q甲=G丙 > 2Q乙 绝密★启用前 2012年普通高等学校招生全国统一考试(天津卷) 理科综合 化学部分 第Ⅱ卷 注意事项: 1.用黑色墨水的钢笔或签字笔将答案写在答题卡上。 2.本卷共4题,共64分。 7.(14分)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。 请回答下列问题: ⑴ Y在元素周期表中的位置为________________。 ⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。 ⑶ Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。 ⑷ X2M的燃烧热ΔH = -a kJ·mol-1 ,写出X2M燃烧反应的热化学方程式: ________________________________________________________________________。 ⑸ ZX的电子式为___________;ZX与水反应放出气体的化学方程式为___________________________。 ⑹ 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为: 2Z + FeG2 Fe + 2ZG 放电时,电池的正极反应式为__________________________: 充电时,______________(写物质名称)电极接电源的负极; 该电池的电解质为___________________。 8.(18分)萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成a-萜品醇G的路线之一如下: 已知:RCOOC2H5 请回答下列问题: ⑴ A所含官能团的名称是________________。 ⑵ A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式: ______________________________________________________________________。 ⑶ B的分子式为_________;写出同时满足下列条件的B的链状同分异构体的结构简式:_____________。 ① 核磁共振氢谱有2个吸收峰 ② 能发生银镜反应 (4) B → C、E → F的反应类型分别为_____________、_____________。 ⑸ C → D的化学方程式为________________________________________________________。 ⑹ 试剂Y的结构简式为______________________。 ⑺ 通过常温下的反应,区别E、F和G的试剂是______________和_____________。 ⑻ G与H2O催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物H,写出H的结构简式:________________________。 9.(18分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: 请回答下列问题: ⑴ 第①步Cu与酸反应的离子方程式为___________________________________________; 得到滤渣1的主要成分为___________________。 ⑵ 第②步加H2O2的作用是_____________________,使用H2O2的优点是___________________________;调溶液pH的目的是使________________________________________生成沉淀。 ⑶ 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________________________________________。 ⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案: 上述三种方案中,_________________方案不可行,原因是_____________________________: 从原子利用率角度考虑,___________方案更合理。 ⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol LL-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+ 写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ; 下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。 a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡 c.未除净可与EDTA反应的干扰离子 10.(14分)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s) + 3H2 (g) W (s) + 3H2O (g) 请回答下列问题: ⑴ 上述反应的化学平衡常数表达式为___________________________。 ⑵ 某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____________________;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应(填“吸热”或“放热”)。 ⑶ 上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示: 温度 25℃ ~ 550℃ ~ 600℃ ~ 700℃ 主要成份 WO3 W2O5 WO2 W 第一阶段反应的化学方程式为___________________________;580℃时,固体物质的主要成分为________;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 ____________________________________。 ⑷ 已知:温度过高时,WO2 (s)转变为WO2 (g); WO2 (s) + 2H2 (g) W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1 WO2 (g) + 2H2 W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1 则WO2 (s) WO2 (g) 的ΔH = ______________________。 ⑸ 钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) WI4 (g)。下列说法正确的有________________。 a.灯管内的I2可循环使用 b.WI4在灯丝上分解,产生的W又沉积在灯丝上 c.WI4在灯管壁上分解,使灯管的寿命延长 d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢 绝密★启用前 2012年普通高等学校招生全国统一考试(天津卷) 理科综合 化学部分参考答案 Ⅰ卷共6题,每题6分,共36分。 1·C 2.C 3.D 4.A 5.D 6.B Ⅱ卷共4题,共64分。 7.(14分) ⑴ 第二周期第ⅥA族 ⑵ HClO4 H2S ⑶ Cl2、O3、ClO2(任写两种,其他合理答案均可) ⑷ H2S (g) + O2 (g)= SO2 (g) + H2O (l);ΔH = -a kJ·mol-1 ⑸ Na+[]- NaH + H2O = NaOH + H2↑ ⑹ Fe2+ + 2e- = 一Fe 钠 β-Al2O3 8.(18分) ⑴ 羰基、羧基 ⑵ n + (n-1)H2O ⑶ C8H14O3 ⑷ 取代反应 酯化反应(或取代反应) ⑸ + 2NaOH + NaBr + 2H2O ⑹ CH3MgX(X=Cl、Br、I) ⑺ NaHCO3溶液 Na (其他合理答案均可) ⑻ 9.(18分) ⑴ Cu + 4H+ + 2NOCu2+ + 2NO2↑+ 2H2O 或3Cu + 8H+ + 2NO3Cu2+ + 2NO↑+ 4H2O Au、Pt ⑵ 将Fe2+氧化为Fe3+ 不引入杂质,对环境无污染 Fe3+、Al3+ ⑶ 加热脱水 ⑷ 甲 所得产品中含有较多Fe2(SO4)3杂质 乙 ⑸ × 100% c 10.(14分) ⑴ K = ⑵ 60% 吸热 ⑶ 2WO3 + H2 W2O5 + H2O W2O5、WO2 1:1:4 ⑷ +203.9 kJ·mol-1 ⑸ a、b 查看更多