- 2021-05-13 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学平衡练习题难
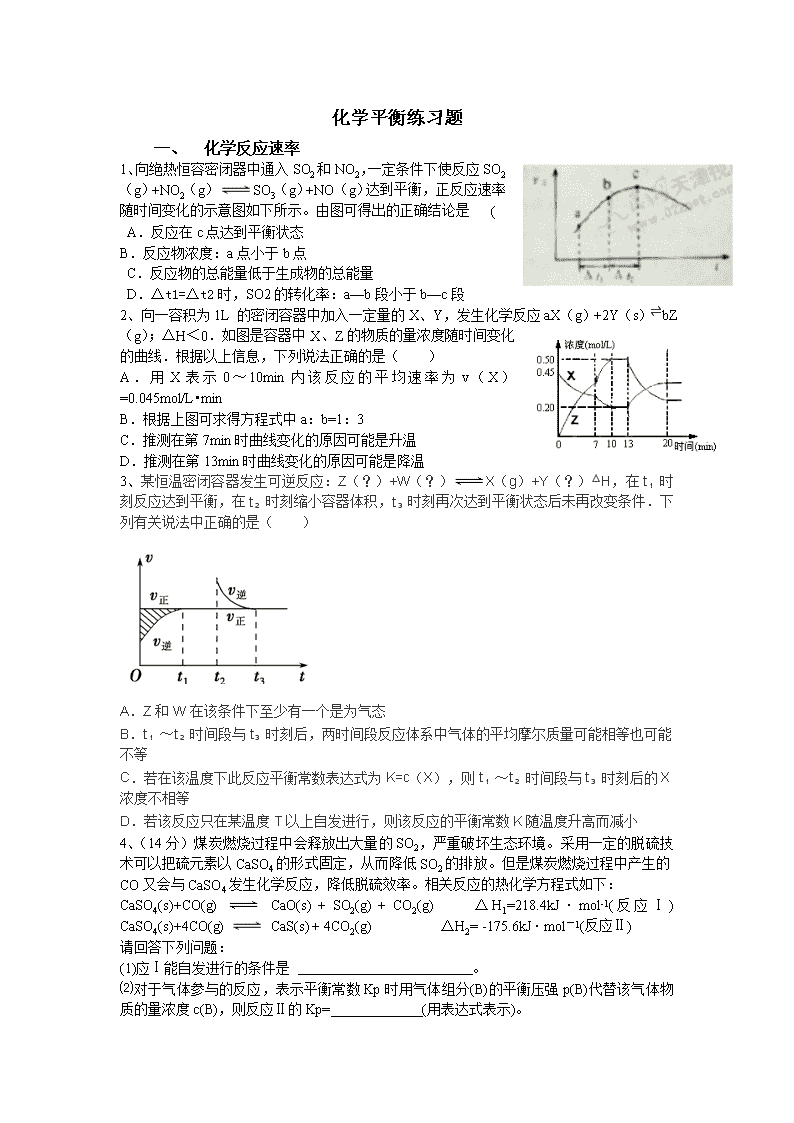
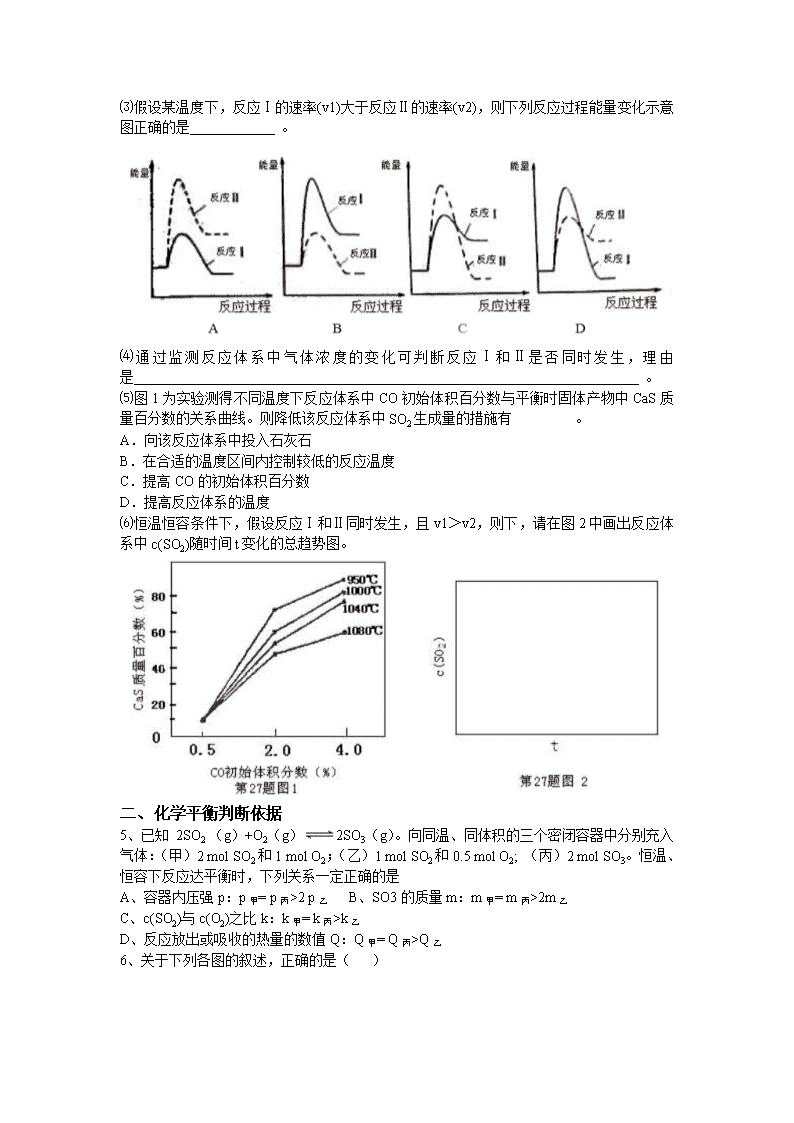
化学平衡练习题 一、 化学反应速率 1、向绝热恒容密闭器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是 ( ) A.反应在c点达到平衡状态 B.反应物浓度:a点小于b点 C.反应物的总能量低于生成物的总能量 D.△t1=△t2时,SO2的转化率:a—b段小于b—c段 2、向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)⇌bZ(g);△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息,下列说法正确的是( ) A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/L•min B.根据上图可求得方程式中a:b=1:3 C.推测在第7min时曲线变化的原因可能是升温 D.推测在第13min时曲线变化的原因可能是降温 3、某恒温密闭容器发生可逆反应:Z(?)+W(?)X(g)+Y(?)△H,在t 1 时刻反应达到平衡,在t 2 时刻缩小容器体积,t 3 时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( ) A.Z和W在该条件下至少有一个是为气态 B.t 1 ~t 2 时间段与t 3 时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等 C.若在该温度下此反应平衡常数表达式为K=c(X),则t 1 ~t 2 时间段与t 3 时刻后的X浓度不相等 D.若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小 4、(14分)煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下: CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ) CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ) 请回答下列问题: (1)应Ⅰ能自发进行的条件是 。 ⑵对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp= (用表达式表示)。 ⑶假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。 ⑷通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是 。 ⑸图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有 。 A.向该反应体系中投入石灰石 B.在合适的温度区间内控制较低的反应温度 C.提高CO的初始体积百分数 D.提高反应体系的温度 ⑹恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,则下,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。 一、 化学平衡判断依据 5、已知 2SO2 (g)+O2(g)2SO3(g)。向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2; (丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是 A、容器内压强p:p甲= p丙>2 p乙 B、SO3的质量m:m甲= m丙>2m乙 C、c(SO2)与c(O2)之比k:k甲= k丙>k乙 D、反应放出或吸收的热量的数值Q:Q甲= Q丙>Q乙 6、关于下列各图的叙述,正确的是( ) A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kj•mol-1 B.乙表示恒温恒容条件下发生的可逆反应2NO2⇔N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液 一、 化学平衡移动 7、在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2 下X的物质 的量浓度c(X)随时间t变化的曲线如题7图所示,下列叙述正确的是( ) A.该反应进行到M点放出的热量大于进行到W点放出的热量 B.T2下,在0~t1时间内,υ(Y)=mol/(L·min) C.M点的正反应速率υ正大于N点的逆反应速率υ逆 D.M点时再加入一定量的X,平衡后X的转化率减小 8、一定条件下,通过下列反应可以制备特种陶瓷的原料MgO: MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( ) 选项 x y A 温度 容器内混合气体的密度 B CO的物质的量 CO2与CO的物质的量之比 C SO2的浓度 平衡常数K D MgSO4的质量(忽略体积) CO的转化率 A.A B.B C.C D.D 9、反应aM(g)+bN(g) cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是 ( ) A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加 B.同压同z时,升高温度,平衡时Q的体积分数增加 C.同温同z时,增加压强,平衡时Q的体积分数增加 D.同温同压时,增加z,平衡时Q的体积分数增加 10、(14分)合成氨是人类科学技术上的一项重大突破,其反应原理为: N2(g)+3H2(g)2NH3(g) ∆H=—92.4kJ•mol‾1 一种工业合成氨的简易流程图如下: (1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。 (2)步骤II中制氯气原理如下: 对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是 。 a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强 利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。 (3)下左图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数: 。 (4)依据温度对合成氨反应的影响,在下右图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。 (5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,简述本流程中提高合成氨原料总转化率的方法: 。 11、二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应: 甲醇合成反应: (ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1 (ⅱ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1 水煤气变换反应: (ⅲ)CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1 二甲醚合成反应: (ⅳ)2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1 回答下列问题: (1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是____________________________________________(以化学方程式表示)。 (2)分析二甲醚合成反应(ⅳ)对于CO转化率的影响 ________________________________________________________________________。 (3)有研究者在催化剂(含Cu Zn Al O和Al2O3)、压强为5.0 MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示。其中CO转化率随温度升高而降低的原因是_________________________________________________。 (4)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为__________ _____________________,一个二甲醚分子经过电化学氧化,可以产生________________个电子的电量;该电池的理论输出电压为1.20 V,能量密度E=_______________(列式计算。能量密度=电池输出电能/燃料质量,1 kW·h=3.6×106 J)。 12、捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用.目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应: 反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)⇌(NH4)2CO3(aq)△H1 反应Ⅱ:NH3(l)+H2O(l)+CO2(g)(NH4)2HCO3(aq)△H2 反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2(NH4)2HCO3(aq)△H3 请回答下列问题: (1)△H3与△H1、△H2之间的关系是:△H3=______. (2)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度.然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1).则: ①△H3______0(填>、=或<). ②在T1~T2及T4~T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是______. ③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示.当时间到达t1时,将该反应体系温度上升到T2,并维持该温度.请在图中画出t1时刻后溶液的pH变化总趋势曲线. (3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有______(写出2个). (4)下列物质中也可能作为CO2捕获剂的是______. A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2. 13、化学反应原理在科研和生产中有广泛应用 (1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应 TaS2(s)+2I2(g) TaI4(g)+S2(g)△H﹥0 (I) 反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 (2)如图所示,反应(I)在石英真空管中进行, 先在温度为T2的一端放入未提纯的TaS2粉末和 少量I2(g),一段时间后,在温度为T1的一端 得到了纯净的TaS2晶体,则温度 T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。 (3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为 (4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中将 (填“增大”“减小”或“不变”)。查看更多