- 2021-05-13 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
北京高考一模试题分类汇编工艺流程试题(带答案)
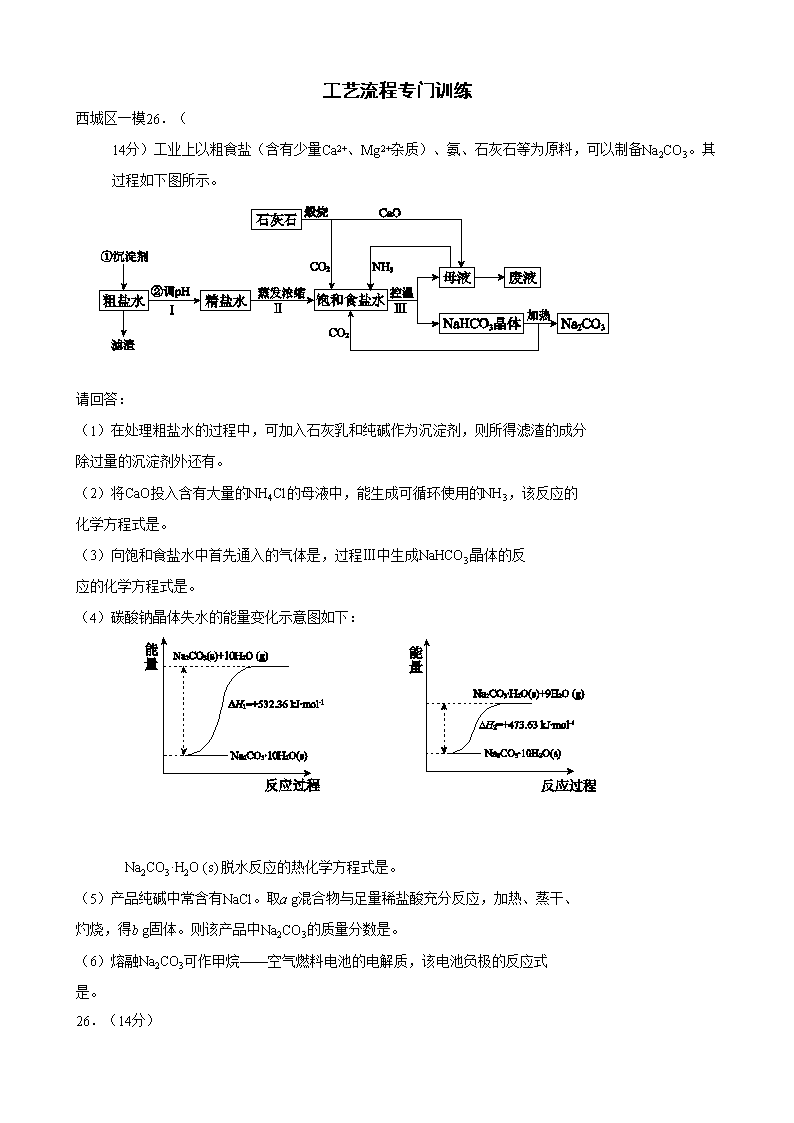
工艺流程专门训练 西城区一模26.( 14分)工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3。其过程如下图所示。 请回答: (1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分 除过量的沉淀剂外还有。 (2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的 化学方程式是。 (3)向饱和食盐水中首先通入的气体是,过程Ⅲ中生成NaHCO3晶体的反 应的化学方程式是。 (4)碳酸钠晶体失水的能量变化示意图如下: Na2CO3·H2O (s) 脱水反应的热化学方程式是。 (5)产品纯碱中常含有NaCl。取a g混合物与足量稀盐酸充分反应,加热、蒸干、 灼烧,得b g固体。则该产品中Na2CO3的质量分数是。 (6)熔融Na2CO3可作甲烷——空气燃料电池的电解质,该电池负极的反应式 是。 26.(14分) (1)CaCO3、Mg(OH)2(漏写得1分,错答得0分) (2)2NH4Cl+CaO=CaCl2+2NH3↑+H2O (3)NH3 NH3+H2O+CO2+NaCl =NaHCO3↓+NH4Cl (4)Na2CO3·H2O(s)= Na2CO3(s) +H2O(g) ΔH= + 58.73 kJ·mol-1 (5)106(b-a)/11a (6)CH4-8e-+4CO32-=5CO2+2H2O 丰台区一模27.(15分) 近年来,为提高能源利用率,西方提出共生系统。特指为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。 (1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池 的极(填“正”或“负”),负极反应式为。用这种方法处理SO2废气的优点是。 (2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下: 焦炭 CaCO3 空气 CaS 反应III CaSO4 反应I CO CO2 KCl 碳酸氢铵 氨气 二氧化硫尾气 K2SO4 反应V 反应IV CaCO333333 NH4Cl 氨水 (NH4)2SO3· H2O 反应II ①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是。 ②下列有关说法正确的是。 高温 A. 反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 B. 反应III中发生反应的化学方程式为CaSO4+4C === CaS+4CO↑ C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解 D.反应V中的副产物氯化铵可用作氮肥 ③反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是。 ④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式。 答案27.(15分) (1)负(2分) SO2+2H2O-2e-=SO42-+4H+(2分) 利用上述电池,可回收大量有效能,副产品为H2SO4,减少环境污染,实现(能质)共生。(2分) (2)①防止亚硫酸铵被氧化(1分) ②ABCD(4分) ③ K2SO4在有机溶剂乙二醇中溶解度小,能充分析出(2分) ④ 4(NH4)2SO3+2NO2=4(NH4)2SO4+N2(2分) 朝阳区一模27.(14分)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下: 回答下列问题: (1)氢氧化钠的电子式是________。 (2)经过步骤①后,加入NaOH固体的原因是________。 (3)步骤②反应的离子方程式是________。 (4)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离子方程式为________。 (5)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如下图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH ________(填“高”或“低”)。 (6)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的_____(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是_____(答出两点即可)。 答案27.(14分) (1) (2)Na2FeO4只在碱性环境中稳定存在,所以加入氢氧化钠可以调节溶液显碱性 (3)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O (4)2Fe3+ + 3ClO- + 10OH- = 2FeO42- + 3Cl- + 5H2O (5)高 (6)低 , 既能消毒杀菌又能净水(或无毒或方便保存等) 东城区各校联考26、(12分)氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下: (1) 试写出吸收塔中反应的离子方程式:__________________________。 (2) 饱和FeCl3溶液可制得 Fe(0H)3胶体,胶体区别于其它分散系的本质特征是___。 (3)已知FeCl3·6H2O在水中的溶解度如下: 温度/℃ 0 10 20 30 50 80 100 溶解度(g/100gH20) 74.4 81.9 91.8 106.8 315.1 525.8 535.7 从FeCl3溶液中获得FeCl3·6H2O的方法是:。 (4)如何验证FeCl3 溶液中是否含有Fe2+ , 请选出正确答案 A. KSCN 氯水 B. 铁粉 KSCN C. 酸性高锰酸钾 D. 黄色的 K3 [Fe(CN)6]溶液 (5)FeCl3的质量分数通常可用碘量法测定:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10mL,加入稍过量的KI溶液,充分反应后,滴入淀粉作为指示剂,并用cmol/LNa2S2O3溶液滴定,用去VmL。 (已知:I2+2S2O32-=2I- +S4O62-) 则滴定终点的现象是:______________________。 m克样品中氯化铁的质量分数为:。 26、(12分) (1)2Fe2++Cl2=2Fe3++2Cl-(2分) (2) 分散质粒径不同,胶体粒子直径1nm-100nm之间。(答丁达尔效应不得分)(2分) (3)加入少量浓盐酸, 加热浓缩,冷却结晶,过滤 (2分) (4)CD (2分) (5)滴入最后一滴,溶液颜色由蓝色变为无色。(2分) ( 162.5Vc/m ) %(2分) 东城区一模27.(14分)臭氧是一种强氧化剂,常用于消毒、灭菌等。 (1)已知O3与KI溶液反应的生成物中有两种单质,其离子反应方程式为。 (2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。 已知:O3的起始浓度为0.0216 mol/L。 pH t/min T/℃ 3.0 4.0 5.0 6.0 20 301 231 169 58 30 158 108 48 15 50 31 26 15 7 ①pH增大能加速O3分解,表明对O3分解起催化作用的是___________. ②在30°C、pH=4.0条件下,O3的分解速率为__________ mol/(L·min)。 ③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为______.(填字 母代号) a. 40°C、pH=3.0 b. 10°C、pH=4.0 c. 30°C、pH=7.0 (3)O3 可由臭氧发生器(原理如下图)电解稀硫酸制得。 ①图中阴极为_____(填“A”或“B”),其电极反应式为。 ②若C处通入O 2 ,则A极的电极反应式为。 答案27.(14分) (1)O3+H2O+2I-= O2+I2+2OH-(2分) (2)①OH-(2分) ②1.00×10-4(2分)③b、a、c(2分) (3)①A(2分)2H++2e-=H2↑(2分)②O2+4H++4e-=2H2O(2分) 昌平一模25. (15分)火力发电厂释放出大量气体会造成环境污染。对燃煤废气进行处理,可实现绿色环保、废物利用等目的。 (1)CO可以与H2O(g)发生反应:CO(g) + H2O(g) CO2(g)+H2(g) ΔH<0 在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0。 起始物质的量 甲 乙 丙 n(H2O)/ mol 0.10 0.20 0.20 n(CO)/ mol 0.10 0.10 0.20 ①该反应的平衡常数表达式为。 ②平衡时,丙容器中H2O的物质的量是mol,甲容器中CO的转化率是, 容器中CO的转化率:乙甲(填“>”、“=”或“<”)。 ③丙容器中,其他条件不变时,温度(填“升高”或“降低”),CO的平衡转化率升高。 (2)除去氮氧化物: ①利用甲烷催化还原NOx: CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1 CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1 甲烷直接将NO2还原为N2的热化学方程式为__________ ②也可用氨气与之发生反应:NOx+NH3→N2+H2O。 现有NO2和NO的混合气体3.0L,跟3.4L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2与NO的体积比是__________。 26 (14分)海水中蕴藏着丰富的资源,人类需要的很多材料都来源于海水的综合利用。 (1)下列有关海水综合利用的说法中正确的是 ( ) A.只需通过物理变化,可从海水中得到钾单质 B.海水通过蒸发可得到淡水,通过蒸馏可得到粗盐 C.从海水中可制取溴及其化工产品 D.利用潮汐发电是将化学能转化为电能 (2)写出工业上用MgCl2制备金属镁的化学方程式 (3)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可制备多种化工产品。 ①用石墨电极电解饱和食盐水时,阳极的电极反应式是 ②利用下图装置电解饱和食盐水,其中a为饱和食盐水,X和Y是惰性电极。 电解可制备“84”消毒液(主要成分是NaClO)。通电时阳极产生的气体被溶液完全吸收,若所得消毒液仅含一种溶质,电解的总化学方程式是。“84”消毒液在常温下的 PH 7,用离子方程式表示其原因。 (4)工业上利用一定的装置电解硫酸钾溶液可制取氢气、氧气、硫酸和氢氧化钾。若将制得的氢气、氧气和氢氧化钾溶液组合成氢氧燃料电池,则电池负极的电极反应式为。 答案25.(15分,除标注外其余每空2分) (1)① ②0.1 50% >③降低 (2)①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol (3分) ②7 : 3 26.(14分,每空2分) 电解 (1) C (2)MgCl2(熔融)= Mg+ Cl2↑ (3)① 2Cl--2e-=Cl2↑ ② NaCl+H2ONaClO+H2↑ > ClO-+H2OHClO+OH- (4)H2+2OH--2e-=2H2O 门头沟一模8.自来水生产的流程示意图如下,下列说法错误的是 水 加入 混凝剂 粗沙 过滤 加沉淀剂 细沙过滤 加氯 供民用 A.混凝剂除去悬浮物质的过程既有物理变化又有化学变化 B.FeSO4·7H2O是常用的混凝剂,它在水中最终生成Fe(OH)2沉淀 C.若要除去水中的Ca2+、Mg2+,可向水中加入石灰后再加入纯碱 D.用臭氧可以替代氯气进行消毒 26.(14分)无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是C)为原料制备无水AlCl3的工艺(碳氯化法)流程如下。 焙烧炉(800℃) 氯化炉(950℃) 冷却器 升华器 无水AlCl3 铝土矿 石油焦 NaCl固体 Cl2、 Al O2 石油焦 CO、Cl2 (1)氯化炉中Al2O3、C12和C反应的化学方程式为_______。 (2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为_______。 (3)升华器中主要含有AlCl3和FeCl3,需加入一定量Al,其目的是_______。 (4)为测定制得的无水AlCl3产品(含少量FeCl3杂质)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。 ①此过程涉及反应的离子方程式为_______、_______。 ②AlCl3产品的纯度为_______。 (5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O在氯化氢的气流中加热脱去结晶水而制得无水AlCl3,其原因是_______。 A12O3+3C12+3C 2A1C1 3+3CO 950℃ (2分) 答案26.(14分) (1) (2)SO32-+C12+H2O=SO42-+2C1-+2H+(2分) (3)除去FeCl3(2分) (4)①Fe3++3OH-=Fe(OH)3↓ (2分) Al3++4OH-=AlO2-+2H2O(2分)②96%(2分) (5)Al3++3 H2O Al(OH)3+ 3 H+,抑制AlCl3水解(2分) 房山区一模26.(13分)金属钛被称为“21世纪金属”。 (1)工业上用钛矿石(含FeTiO3,含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2: 其中,步骤Ⅱ发生的反应为:2H2SO4 + FeTiO3 = TiOSO4 + FeSO4 + 2H2O ①步骤Ⅰ中发生反应的化学方程式: ________________、________________。 ②将步骤Ⅱ所得FeSO4晶体溶于水,在酸性条件下加入H2O2溶液,可制得具有净水作用的铁盐,该反应的离子方程式为。 ③在步骤Ⅲ中需要控制条件以形成TiO2·nH2O胶体,该分散质颗粒直径大小在____________范围。 (2)可利用TiO2通过下述两种方法制备金属钛: 方法一:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,用碳块作电解槽池,电解TiO2制得钛,其阴极发生的反应:_____________。 方法二:通过以下反应制备金属钛 ① TiO2(s) + 2Cl2(g) TiCl4(g)+ O2(g);△H= +151kJ/mol ② TiCl4 + 2Mg 2MgCl2 + Ti 在实际生产中,需在反应①过程中加入碳才能顺利制得TiCl4,其原因是:。 (3)若已知:C(s) + O2(g) = CO2(g) △H= -394kJ/mol ,则由固体TiO2、固体C与Cl2气反应制取气态TiCl4的热化学方程式为____________。 26.(13分) (1)①__ Al2O3_+ 2NaOH = 2NaAlO2 +H2O__2分 __ SiO2 + 2NaOH = Na2SiO3 + H2O2分 ②2Fe2+ +H2O2+2H+ = 2Fe3+ + 2H2O 2分 ③1~100nm 1分 (2) TiO2+ 4e- = Ti + 2O2-_ 2分 利用高温使碳与O2反应减小O2的浓度,并利用反应放热,使生成更多TiCl42分 (3)TiO2(s) + 2Cl2(g) + C(s)= TiCl4(g) + CO2(g);△H=-243kJ/mol 2分 石景山一模27.(14分)丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。 已知:① (1)反应 (2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应: ①下列事实能说明该反应达到平衡的是 a.体系中的压强不发生变化 b. c.混合气体的平均相对分子质.量不发生变化 d.CO2的浓度不再反生变化 ②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)=。 ③向平衡体系中充入少量CO则平衡常数____(填“增大”、“减小”或“不变”)。 (3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导 O2—。在电池内部O2—由____极移向____极(填“正”或“负”);电池的负极电极反应式为 。 (4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____。 海淀区一模10.海洋约占地球表面积的71%,对其进行开发利用的部分流程如下图所示。下列说法 试剂1 Cl2 H2SO4 苦卤(K+、Mg2+、Br-等) K+、Mg2+等 Br2 Mg(OH)2 海水 粗盐 不正确的是 A.可用BaCl2溶液除去粗盐中的SO42- B.从苦卤中提取Br2的反应的离子方 程式为:2Br- + Cl2 == 2Cl- + Br2 C.试剂1可以选用石灰乳 D.工业上,电解熔融Mg(OH)2冶炼金属镁 26. (15分)工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主 要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。 钛铁矿 硫酸 353K ① Fe3+ Fe2+ TiO2+ H+ SO42-残渣 铁粉 ② 滤渣 Fe2+ TiO2+ H+ SO42- 冷却结晶 ③ FeSO4·7H2O Fe2+ TiO2+ H+ SO42- 热水 ④ H2TiO3固体 煅烧 ⑤ 废液(主要含Fe2+、 H+、SO42-) TiO2 已知:TiOSO4遇水会水解。 (1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为。 (2)步骤③中,实现混合物的分离是利用物质的(填字母序号)。 a. 熔沸点差异 b. 溶解性差异 c. 氧化性、还原性差异 (3)步骤②、③、④中,均需用到的操作是(填操作名称)。 (4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理: 。 (5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰 (MnSO4,易溶于水),该反应的离子方程式为。 (6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下 图所示装置获得金属钙,并以钙为还原剂,还 原二氧化钛制备金属钛。 ①写出阳极所发生反应的电极反应式: 。 ②在制备金属钛前后,CaO的总量不变,其原 因是(请结合化学用语解释) 。 分析26、工业流程题(较难) (1)2Fe3+ + Fe=2Fe2+ 不解释 (2)b 考查选择分离方法的依据:冷却结晶是利用溶解度的差异进行的,俗称冷却热饱和溶液,因此和溶解度相关。 (3)过滤 (4)TiO2+ + 2H2O=H2TiO3+2H+ 稀释升温,平衡正向移动,生成产物。 考查应用平衡移动理论解释陌生的转化,写出水解方程式,越热越稀越水解。 (5)MnO2+2Fe2+ +4H+ = Mn2+ +2Fe3+ +2H2O 考查陌生方程式的书写、配平: 废液是酸性的,含Fe2+,而氧化剂和还原产物题目已经给出,仅仅需要一次配平即可。 (6)2O2- - 4e- = O2 或 C-4e-+2O2- =CO2 考查分析陌生电解原理、分析陌生装置图能力:导电离子是O2- 电极是C,生成CO2,可以根据电荷守恒写出。 2CaO 2Ca+O2↑, 2Ca+TiO2=Ti+2CaO 故CaO不变 仔细读图,发现其实Ca只是为了置换Ti而制备的中间产物。所以前后不变。 27、实验综合题(中等难度) 任务1解读:考查定性实验常见模板 传统固体法制NH3 → 干燥 → 合并反应→??? 传统浓HNO3制NO2 → 干燥 → 该反应一般需要催化剂,加热,本题没有给出,故反应基本没法进行,另外根据装置连接模板,很明显缺少尾气处理装置。 任务2解读:考查陌生原理的探究 Na2O2与CO2是课本内容,本题考查源于课本而高于课本的探究,Na2O2与NO2反应,我们课上讲过,非金属氧化物和Na2O2反应,低价的化合成盐,最高价的才反应出O2,故该反应生成NaNO3 (1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑+2H2O (不解释) (2)C装置中混合气体颜色变浅 (NO2与NH3归中后变N2,颜色消失) (3)在此条件下,反应速率极慢(没催化,没加热,基本没戏) (4)缺少尾气处理装置 (5)NO2能被Na2O2还原(两个物质都是处于中间价态,所以逻辑是:AB和平相处,A能抢B的电子,B能抢A的电子) (6)EDBF (制备NO2 → 干燥不能用碱石灰所以是CaCl2→与B中的Na2O2反应 → 尾气处理) 2NO2+Na2O2=2NaNO3 答案26.(15分) (1)2Fe3+ + Fe === 3Fe2+ (2)b (3)过滤 (4)溶液中存在平衡:TiO2+ + 2H2O H2TiO3 + 2H+,当加入热水稀释、升温后, 平衡正向移动,生成H2TiO3。 (3分) (说明:写出离子方程式或化学方程式得1分,从稀释和升温角度正确分析平衡移 动各得1分。) (5)MnO2 + 2Fe2+ + 4H+ === Mn2+ + 2Fe3+ + 2H2O (6)① 2O2- - 4e- == O2↑(同时写出C + O2 == CO2不扣分) 或 C + 2O2- - 4e- == CO2↑ 一定条件 通电 ②制备TiO2时,在电解槽发生如下反应: 2CaO === 2Ca + O2↑, 2Ca + TiO2 ====== Ti + 2CaO, 由此可见,CaO的量不变。(两个方程式各1分,不写“一定条件”不扣分) 或: 制备TiO2时,在电解槽发生如下反应: 一定条件 阴极:2Ca2+ + 4e- == 2Ca 阳极:2O2- - 4e- == O2↑ 2Ca + TiO2 ====== Ti + 2CaO, 由此可见,CaO的量不变。(电极反应式和化学方程式各1分,不写“一定条件” 不扣分)。查看更多