- 2021-05-13 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考模拟系列试卷一理综试题新课标版
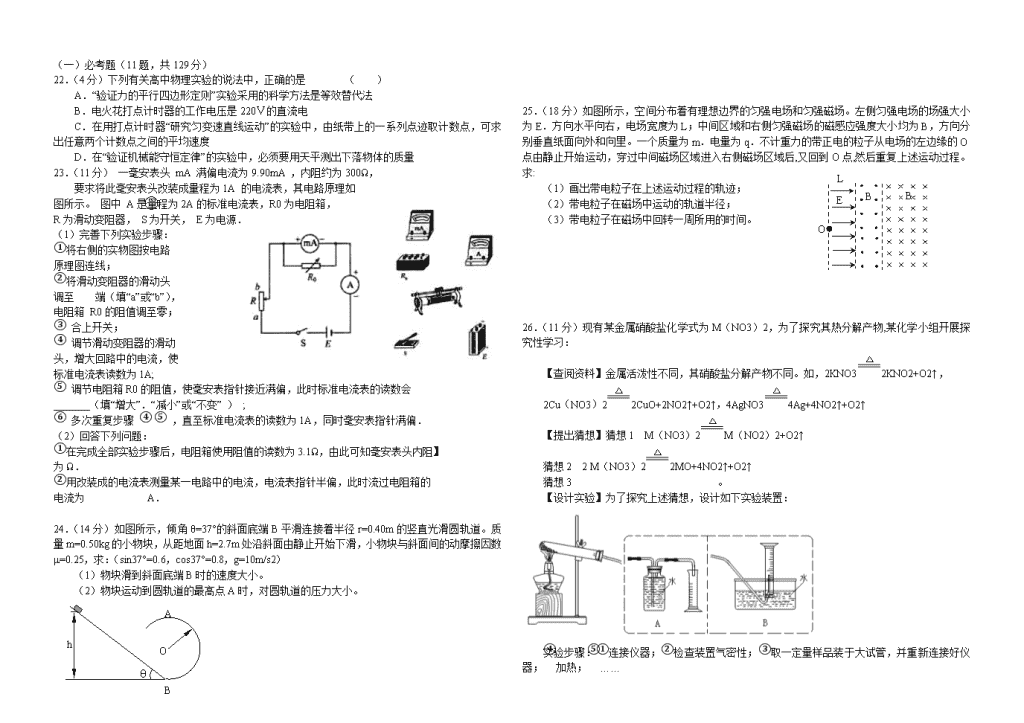
2011年高考理综模拟系列试卷(1) 题 号 第I卷 第II卷 必做题 选做题 得 分 本试卷分第I卷(选择题)和第II卷(非选择题)两部分。满分300分,考试时间150分钟。 第Ⅰ卷 (选择题 共126分) 可能用到的相对原子质量:C:12 H:1 O:16 Cl:35.5 Na:23 Fe:56 Mn:55 一、选择题(本题共13小题,每小题6分,共78分。在每小题给出的4个选项中,只有一项是符合题目要求的。) 1.存在于RNA而不存在于DNA,存在于叶绿体而不存在于线粒体,存在于动物细胞质而不存在于植物细胞质中的糖类物质分别是 ( ) A.核糖.葡萄糖.糖原 B.脱氧核糖.核糖.纤维素 C.核糖.脱氧核糖.麦芽糖 D.脱氧核糖.葡萄糖.淀粉 2.有关人类疾病的叙述,正确的是 ( ) A.癌细胞能扩散.转移是因为细胞形态结构发生改变 B.人类遗传病都是先天性疾病 C.单基因遗传病遵循孟德尔遗传定律 D.艾滋病可母婴传播,是一种遗传病 3.下列有关细胞器的说法正确的是 ( ) A.核糖体是噬菌体.细菌.酵母菌唯一共有的细胞器 B.线粒体是有氧呼吸的主要场所,在其中生成的产物有丙酮酸.二氧化碳和水 C.叶绿体是所有生物进行光合作用的场所,含有DNA.RNA.蛋白质和磷脂等成分 D.在植物细胞有丝分裂的末期,细胞中的高尔基体活动加强 4.下列有关基因重组的的说法不正确的是 ( ) A.生物体进行有性生殖的过程中,控制不同性状的基因的重新组合属于基因重组 B.减数分裂四分体时期,同源染色体的姐妹染色单体之间的局部交换,可导致基因重组 C.减数分裂过程中,非同源染色体上的非等位基因自由组合可导致基因重组 D.一般情况下,花药内可发生基因重组,而根尖则不能 5.在人体特异性免疫中反应中,体液免疫与细胞免疫的关系是 ( ) A.只有体液免疫才需要抗体的参与,只有细胞免疫才需要淋巴细胞的参与 B.体液免疫和细胞免疫分别组成人体内防止病原体入侵的第二.第三道防线 C.对侵入人体的病原体由体液免疫发挥作用,对癌细胞由细胞免疫发挥作用 D.在抗病毒感染中,往往需要体液免疫和细胞免疫的共同作用 6.生产者细胞中的叶绿体可产生ATP,同时生产者.消费者.分解者细胞中的线粒体及细胞质基质也能产生ATP。在一个处于生长期的森林生态系统中,下列判断正确的是( ) A.生产者叶绿体产生的ATP多于消费者和分解者的线粒体.细胞质基质产生的ATP之和 B.消费者的各细胞中线粒体产生的ATP都多于细胞质基质产生的ATP C.所有分解者都可通过线粒体产生的ATP供能 D.生产者叶绿体产生的ATP与其线粒体和细胞质基质中产生的ATP之和相等 7.继毒大米、苏丹红、三聚氰胺到地沟油,火锅“一滴香”事件,折射食品安全监管疲软。下列有关说法不正确的是 ( ) A.苏丹红.三聚氰胺.地沟油.生石灰粉都属对人体有害的有机物 B.地沟油,经过提炼可作为化工原料 C.地沟油是一种品质较差的动植物油脂,由于混有一些对人体有害杂质而不能食用。 D.工业上可通过煅烧贝壳制得生石灰粉 8.下列排列顺序正确的是 ( ) ①固体热稳定性:Na2CO3>CaCO3>NaHCO3 ②微粒半径:F->Na+>Mg2+>S2- ③燃烧热: S(气体)>S(液体)>S(固体) ④物质的沸点:SiO2>KCl>H2O>H2S ⑤物质的熔点:植物油>动物油 A.①③④ B.①③④⑤ C.①②③④ D.②③④⑤ 9.设NA为阿伏加德罗常数的数值,下列说法中正确的是 ( ) A.1L 1 mol/L 氨水中NH3·H2O 的物质的量为NA B.常温常压下,a molO2 与2 a mol NO混合,降温得到混合气体中氧原子数小于4aNA C.4.6 g C2H6O加入足量的金属钠,充分作用,生成氢气分子数一定为0.05NA D.足量Zn与一定量的浓硫酸反应,产生22.4L(标况)气体时,转移的电子数为2NA e- e- e- e- I- 染料 TiO2 Pt 10.利用半导材料TiO2与染料.铂电极及I和I-的混合物作电解质[I2(aq)+I-(aq)I3-(aq)],可构成染料敏化太阳能电池(DSSCs)工作原理如右图。下列说法不正确的是( ) A.该电池工作时,正极的电极反应为I3-+2e-=3I- B.在该电解质溶液中,加入少量KI能促进I2的溶解 C.在该电解质溶液中,加入苯,平衡不移动 D.电池工作中,I-浓度升高 11.下列离子方程式书写不正确的是 ( ) A.FeCl3腐蚀铜板印刷电路:2Fe3++Cu=2Fe2++Cu2+ B.等浓度等体积的Ca(HCO3)2溶液与氢氧化钠溶液混合: Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O C.在Fe(NO3)2溶液中滴入1~2滴盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O D.在H2O2中加入酸性高锰酸钾溶液:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O 12.水热法制备Fe(FeO2)2纳米颗粒的反应为3Fe2+ +2S2O32-+O2 +xOH-=Fe(FeO2)2+S4O62-+2H2O。下列说法中,不正确的是 ( ) A.每生成1mol Fe3O4转移4mol电子 B.该反应中Fe2+和S2O32-都是还原剂 C.3mol Fe2+被氧化时有1molO2被还原 D.反应方程式中化学计量数x=4 13.某兴趣小组为探究外界条件对可逆反应 A(g)+B(g)C(g)+D(s)的影响,在恒温条件下往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ。 A B C D Ⅰ 0.05 mol·L-1 a mol·L-1 0.05 mol·L-1 b mol Ⅱ 0.078 mol·L-1 0.078 mol·L-1 0.122 mol·L-1 m mol Ⅲ 0.06 mol·L-1 0.06 mol·L-1 0.04 mol·L-1 n mol Ⅳ 0.07 mol·L-1 0.07 mol·L-1 0.098 mol·L-1 p mol 针对上述系列试验,下列结论中正确的是 ( ) A.Ⅰ中a=1 B.实验Ⅳ结果的产生可能是因为采用从生成物配比的方法,且p≥0.98 C.Ⅱ对应的操作方法可以是在Ⅰ的基础上压缩反应容器的体积,且m>0.5 D.将Ⅲ与I比较,可以判断出正反应一定是放热反应 二、选择题(本题共8小题。在每小题给出的四个选项中,共48分。有的只有一个选项正确,有的有多个选项正确。全部选对的得6分,选对但不全的得3分,有选错的得0分。) 14.在力学范围内,国际单位制规定的三个基本量是 ( ) A.长度.力.时间 B.速度.力.质量 C.千克.米.秒 D.长度.质量.时间 15.我国于2007年10月发射了探月卫星“嫦娥l号”。假设该卫星的绕月轨道是圆形的,且贴近月球表面。已知月球的质量约为地球质量的l/81,月球的半径约为地球半径的l/4,地球上的第一宇宙速度约为7.9km/s,则该探月卫星绕月运行的速率约为 ( ) A.0.4km/s B.1.8km/s C.1lkm/s D.36km/s 16.t=0 时,甲乙两汽车从相距90 km的两地开始相向行驶, 它们的v一t 图象如图所示.忽略汽车掉头所需时间. 下列对汽车运动状况的描述正确的是 ( ) A.在第2小时末,甲乙两车相距30 km B.在第2小时末,甲乙两车相距最近 C.在前4小时内,两车相遇2次 D.在第4小时末,甲乙两车相遇 17.如图,理想变压器原副线圈匝数之比为2 : 1.原线圈接入一电压为 U=U0sinωt的交流电源,副线圈接一个R=55 Ω的负载电阻.若 U0=220V ,ω=100π rad/s , 则下述结论正确的是 ( ) A.副线圈中电压表的读数为 110V B.副线圈中输出交流电的周期为0.02s C.原线圈中电流表的读数为2A D.原线圈中的输入功率为220W 18.如图所示,虚线a.b.c代表电场中三个等势面,相邻等势面之间的电势差相等,即Uab = Ubc,实线为一带正电的质点仅在电场力作用下通过该区域时的运动轨迹,P.Q是这条轨迹上的两点,据此可知 ( ) A.三个等势面中,a的电势最高 B.带电质点在P点具有的电势能比在Q点具有的电势能大 C.带电质点通过P点时的动能比通过Q点时大 D.带电质点通过P点时的加速度比通过Q点时大 19.如图所示,图中的四个电表均为理想电表,当滑动变阻器 滑动触点P向右端移动时,下面说法中正确是 ( ) A.伏特表V1的读数减小,安培表A1的读数减小 B.伏特表V1的读数增大,安培表A1的读数增大 C.伏特表V2的读数减小,安培表A2的读数增大 D.伏特表V2的读数增大,安培表A2的读数减小 20.如图所示,水平放置的光滑平行金属导轨上有一质量为m 的金属棒ab.导轨的一端连接电阻R,其他电阻均不计, 磁感应强度为B的匀强磁场垂直于导轨平面向下,金属棒 ab在一水平恒力F作用下由静止起向右运动.则( ) A.随着ab运动速度的增大,其加速度也增大 B.外力F对ab做的功等于电路中产生的电能 C.当ab做匀速运动时,外力F做功的功率等于电路中的电功率 D.无论ab做何种运动,它克服安培力做的功一定等于电路中产生的电能 21.如图所示,一轻弹簧左端固定在长木块M的左端,右端与小物块m连接,且m.M及M与地面间接触均光滑,开始时,m和M均静止,现同时对m.M施加等大反向的水平恒力F1和F2,从两物体开始运动以后的整个过程中,对m.M和弹簧组成的系统(整个过程中弹簧形变不超过其弹性限度,M足够长),正确的说法是 ( ) A.由于F1、F2等大反向,故系统机械能守恒 B.由于F1、F2分别对m.M做正功,故m.M的动 能不断增大 C.由于F1、F2分别对m.M做正功,故系统机械 能不断增大 D.当弹簧弹力大小与F1、F2大小相等时,m、M动能最大 第Ⅱ卷 (非选择题 共174分) 三、非选择题(包括必考题和选考题两部分。第22题~第32题为必考题,每个试题考生都必须作答。第33题~第41题为选考题,考生根据要求作答。) (一)必考题(11题,共129分) 22.(4分)下列有关高中物理实验的说法中,正确的是 ( ) A.“验证力的平行四边形定则”实验采用的科学方法是等效替代法 B.电火花打点计时器的工作电压是220V的直流电 C.在用打点计时器“研究匀变速直线运动”的实验中,由纸带上的一系列点迹取计数点,可求出任意两个计数点之间的平均速度 D.在“验证机械能守恒定律”的实验中,必须要用天平测出下落物体的质量 23.(11分) 一毫安表头 mA 满偏电流为9.90mA ,内阻约为300Ω, 要求将此毫安表头改装成量程为1A 的电流表,其电路原理如 图所示。 图中 A是量程为2A的标准电流表,R0为电阻箱, R为滑动变阻器, S为开关, E为电源. (1)完善下列实验步骤: ①将右侧的实物图按电路 原理图连线; ②将滑动变阻器的滑动头 调至 端(填“a”或“b”), 电阻箱 R0的阻值调至零; ③ 合上开关; ④ 调节滑动变阻器的滑动 头,增大回路中的电流,使 标准电流表读数为1A; ⑤ 调节电阻箱R0的阻值,使毫安表指针接近满偏,此时标准电流表的读数会 _______(填“增大”.“减小”或“不变” ) ; ⑥ 多次重复步骤 ④ ⑤ ,直至标准电流表的读数为1A,同时毫安表指针满偏. (2)回答下列问题: ①在完成全部实验步骤后,电阻箱使用阻值的读数为3.1Ω,由此可知毫安表头内阻】 为Ω. ②用改装成的电流表测量某一电路中的电流,电流表指针半偏,此时流过电阻箱的 电流为 A. 24.(14分)如图所示,倾角θ=37°的斜面底端B平滑连接着半径r=0.40m的竖直光滑圆轨道。质量m=0.50kg的小物块,从距地面h=2.7m处沿斜面由静止开始下滑,小物块与斜面间的动摩擦因数μ=0.25,求:(sin37°=0.6,cos37°=0.8,g=10m/s2) (1)物块滑到斜面底端B时的速度大小。 (2)物块运动到圆轨道的最高点A时,对圆轨道的压力大小。 θ A B O h 25.(18分)B B E L O 如图所示,空间分布着有理想边界的匀强电场和匀强磁场。左侧匀强电场的场强大小为E.方向水平向右,电场宽度为L;中间区域和右侧匀强磁场的磁感应强度大小均为B,方向分别垂直纸面向外和向里。一个质量为m.电量为q.不计重力的带正电的粒子从电场的左边缘的O点由静止开始运动,穿过中间磁场区域进入右侧磁场区域后,又回到O点,然后重复上述运动过程。求: (1)画出带电粒子在上述运动过程的轨迹; (2)带电粒子在磁场中运动的轨道半径; (3)带电粒子在磁场中回转一周所用的时间。 26.(11分)现有某金属硝酸盐化学式为M(NO3)2,为了探究其热分解产物,某化学小组开展探究性学习: 【查阅资料】金属活泼性不同,其硝酸盐分解产物不同。如,2KNO32KNO2+O2↑, 2Cu(NO3)22CuO+2NO2↑+O2↑,4AgNO34Ag+4NO2↑+O2↑ 【提出猜想】猜想1 M(NO3)2M(NO2)2 +O2↑ 猜想2 2 M(NO3)22MO+4NO2 ↑+O2↑ 猜想3 。 【设计实验】为了探究上述猜想,设计如下实验装置: 实验步骤:①连接仪器;②检查装置气密性;③取一定量样品装于大试管,并重新连接好仪器;④加热;⑤…… (1)写出猜想3的化学方程式: ; (2)测定气体体积应选择 (填A或B);不选另一个装置的理由是 ; (3)实验收集到一定量气体,为了检验收集气体的成分,其操作方法是 ; (4)在实验后的水里加入适量碳酸氢钠粉末,溶液中产生大量气体,说明 正确(填:猜想1.猜想2或猜想3); (5) 该小组测得两组数据:①实验前样品质量为Wg,收集到气体体积为V L; ②实验前样品质量为Wg,完全分解后测得固体产物质量为m g; 请你选择其中一组数据,计算M的相对原子质量为 。 27.(17分)(I)(8分)下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去。A为含14个电子的双原子分子, C.E为金属单质,B化合物中含E原子质量含量为70%。反应①②均为工业上的重要反应。 请回答下列问题: (1)D的电子式为_______________。 (2)K的化学式为_______________。 (3)写出B与C高温反应生成E和F的化学方程式:______________。 (4)写出D与J的稀溶液反应生成G的离子方程式:______________。 (5)I→L的离子方程式________________________________________ (II)(9分)随着尖端技术的发展,氟的用途日益广泛,如用F2将UF4氧化成UF6,然后用气体扩散法使铀的同位素235U和238U分离。而氟单质的制备通常采用电解氧化法。下图是电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物,其装置如下: (1)已知阴极的反应为:2HF2- + 2e- =H2 + 4F- 则电解的总反应为:_________________。 (2)出口1是(写化学式,下同)_____________,出口2是_________________________。 (3)在电解质的熔盐中常加入另一种氟化物(AlF3),他的作用是①减少HF的挥发②_________________________________。 (4)随着电解的进行有一种物质会不断被消耗,需要从入口处进行补充,则从入口处加入的物质是(写化学式)________________。 (5)化学家Karl Chrite首次用化学方法制的氟,这是1986年合成化学研究上的一大突破。具体制法为: ①4KMnO4 + 4KF + 20HF = 4K2MnF6 + 10H2O + 3O2 ②SbCl5 + 5HF = SbF5 + 5HCl ③2K2MnF6 + 4SbF54KSbF6 + 2MnF3 + F2 则下列说法正确的是 ( ) A.反应①中KMnO4既是氧化剂又是还原剂,K2MnF6是氧化产物 B.反应③中K2MnF6一定是氧化剂可能还起到还原剂的作用,SbF5一定不是氧化剂 C.反应②能够发生可能原因是生成稳定的络合物SbF5的缘故 D.生成0.5mol的F2整个反应过程中转移的电子总数是4NA个。 浓硫酸 趁热过滤 钛铁矿 混合液 H2TiO3 水 副产品 加热 铁屑 滤渣 滤液 冷却结晶 TiOSO4 水 ②过滤 ①加热 滤液 加热 TiO2 28.(15分)钛白粉被广泛用于制造高级白色油漆。工业上以钛铁矿(主要成分为FeTiO3,杂质为Fe2O3 .脉石)为原料制钛白粉(金红石晶型TiO2)的主要工艺有硫酸法和氯化法两种。其工艺流程如下: 熔炼 四氯化钛 TiO2 碳 钛铁矿 氯气 精馏 精四氯化钛 水洗 干燥 (1)硫酸法工业流程中加入铁屑的目的是 。 (2)上述流程中副产品是 ,滤渣的成分是________________。 (3)从TiOSO4→H2TiO3需要加热,则加热的目的是_________________________。 (4)用浓硫酸处理钛铁矿,并向所得溶液中加入水和铁,此时0.5L的溶液中含有2molTiO2+.4.75molSO42-.2.5mol的一种未知阳离子和H+。常温下,其溶液的pH=___________。 (5)氯化法中熔炼过程的反应为: 2FeTiO3(s)+ 7Cl2(g)+ 6C(s)2TiCl4(l) + 2FeCl3(s) + 6CO(g) 该反应是在1173K的温度下进行,你认为还应该控制的反应条件是 , 平衡常数表达式K= , △S_______0(填:>.<) (6)熔炼后分离出四氯化钛的方法是________________,熔炼后物质中含有Fe3+,那么Fe3+检验的离子方程式为:________________。 29.下图方框内为某人工池塘生态系统的主要食物链,括号内前一数值表示一年内该营养级生物的总能量,后一数值表示一年内该营养级生物同化的总能量,单位为J/(cm2·a),据图回答问题: (1)图中有 条食物链,其中各种组成成分通 过 紧密联系,形成一个统一的整体。 (2)能量从第一营养级传递到第二营养级的效 率是 。 (3)由图可知,下一个营养级不能得到上一个营养级 的全部能量,原因包括 。 (从供选答案中选择,填序号)①各营养级生物体内的大 部分能量被呼吸作用消耗;②上一个营养级的部分能量未 被下一个营养级利用;③少数能量被分解者利用 (4)据资料显示,该生态系统每年7~8月份突发“鱼病.鱼死”现象,且有进一步严重化趋势。从生态系统稳定性的角度分析,发生该现象的原因是 。 (5)若要进一步提高该生态系统的稳定性,从而获得更大的经济效益,可采取的措施是 (答出一点即可)。 30.兔子的毛色有灰色.青色.白色.黑色.褐色等,控制毛色的基因在常染色体上。其中,灰色由显性基因(B)控制,青色(b1)、白色(b2)、黑色(b3)、褐色(b4)均为B基因的等位基因。 (1)已知b1、b2、b3、b4之间具有不循环而是依次的完全显隐性关系(即如果b1对b2显性、b2对b3显性,则b1对b3显性)。但不知具体情况,有人做了以下杂交试验(子代数量足够多,雌雄都有): 甲:纯种青毛兔×纯种白毛兔——F1为青毛兔 乙:纯种黑毛兔×纯种褐毛兔——f1为黑毛兔 丙:F1青毛兔×f1为黑毛兔 请推测杂交组合丙的子一代可能出现的性状,并结合甲.乙的子代情况,对b1、b2、b3、b4之间的显隐性关系做出相应的推断: ①若表现型及比例是 ,则b1、b2、b3对b4显性,b1、b2对b3 显性,b1对b2显性(可表示为b1>b2>b3>b4,以下回答问题时,用此形式表示) ②若青毛:黑毛:白毛大致等于2:1:1,则b1、b2、b3、b4之间的显隐性关系 是 。 (2)假设b1>b2>b3>b4。若一只灰色雄兔与群体中多只不同毛色的纯种雌兔交配,子代中灰毛兔占50%,青毛兔.白毛兔.黑毛兔和褐毛兔各占12.5%。该灰毛雄兔的基因型是 。若让子代中的青毛兔与白毛兔交配,后代的表现型及比你是 ,并请写出遗传图解 。 31.某人利用小球藻为实验材料做了下列两组实验,分析实验并回答下列问题: (1)实验一:小球藻在适宜条件下繁殖很快,在相同培养液中,以图甲中的装置(a)和 (b)分别培养小球藻(抽去空气),将两个装置都放在阳光下,观察最初的变化。 ①装置(a)的B试管中小球藻繁殖速度的变化是 (加快.减慢),其原 因是A瓶中的 。 ②装置(b)的C试管中小球藻繁殖速度的变化是 (加快.减慢),其原因是D瓶中的 。 (2)实验二:如果用图乙装置即E试管和F试管敞口培养小球藻,E试管用完全营养液,F试管用除去镁元素的完全营养液,研究光照强度对植物产生氧气量的影响,绘制 曲线如图丙,据图回答: ①分析E曲线中P.Q两点净氧量及产生的原因:P点净氧量 (小 于、大于、等于)零,因为 ,Q点净氧量(小于、大 于、等于)零,原因是此时小球藻细胞 。 ②造成E.F两试管净氧量差异的原因是: ,所以两试管中的净氧量有明显差异。 32.人和鼠都是哺乳动物,胰高血糖素对小白鼠和人具有相同的生理作用。为了验证“胰高血糖素具有升高血糖含量的生理作用”,请以小白鼠为实验对象设计探究性实验,完成实验步骤,预测和分析实验结果,并写出实验结论。 (1)材料用具: 大小、体重一祥,生长正常的小白鼠两组;生理盐水;用生理盐水配制的适宜浓度的胰高血糖素溶液;斐林试剂;注射器;试管;试管夹;吸管;烧杯;三角架;石棉网;酒精灯等。 (2)方法步骤:(提示:用腹腔注射给药,剂量不作实验要求,给药1h后,从小白鼠膀胱处穿刺取尿液) 第一步, ; 第二步,将两支试管编号为A和B,分别加入等量的斐林试剂; 第三步, 第四步,将两支试管摇匀后,放入盛有开水的烧杯内进行水浴加热3~5 min,观察两支试管中溶液颜色的变化。 (3)实验结果的预测.分析及结论: ①实验结果的预测及分析: A试管: ; B试管: 。 ②结论: (二)选考题(共45分,请考生从给出的3道物理题.3道化学题.2道生物题中每科任选一题作答。如果多做,则只能按所做的第一题计分。) 33.[物理——选修3-3](15分) (1)(5分)下列说法正确的是___________(填写选项前的字母代号) A.物体吸收热量,其温度一定升高 B.热量只能从高温物体向低温物体传递 C.做功和热传递是改变物体内能的两种方式 D.布朗运动是悬浮在液体中固体颗粒的分子无规则运动的反映 E.第二类永动机是不能制造出来的,尽管它不违反热力学第一定律,但它违反热力学第二定律 (2)(10分))一定质量的理想气体从状态A变化到状态B,再变化到状态C,其状态变化过程的p-V图象如图所示。已知该气体在状态A时的温度为27℃。则: ①该气体在状态 B.C时的温度分别为多少℃? ②该气体从状态A到状态C的过程中是吸热,还是放热?传递的热量是多少? 34.[物理——选修3-4](15分) (1)(5分)下列说法正确的是___________(填写选项前的字母代号) A.波的图象表示介质中“某个质点”在“各个时刻”的位移 B.当波源与观察者相互远离时,观察到的频率变小 C.光的偏振现象说明光是纵波 D.均匀变化的磁场产生均匀变化的电场,均匀变化的电场产生均匀变化的磁场 E.狭义相对论认为,在不同的惯性参考系中,一切物理规律都是相同的,真空的光 速都是相同的。 (2)(10分)高速公路上的标志牌都用“回归反射膜”制成,夜间行车时,它能把车灯射出的光逆向返回。这种“回归反射膜”是用球体反射元件制成的。如图,透明介质球的球心位于O点,半径为R,光线DC平行于直径AOB射到介质球的C点,DC与AB的距离H=R.若DC光线进入介质球折射后,经一次反射,再折射后射出的光线与入射光线平行,试作出光路图,并算出介质球的折射率. 35.[物理——选修3-5](15分) (1)(5分)下列说法正确的是___________(填写选项前的字母代号) A.放射性元素的半衰期随温度的升高而减小 B.放射性元素放射出的射线.射线和射线,电离能力最强的是射线 C.衰变成要经过6次衰变和4次衰变 D.原子从较高的激发态向较低的激发态或基态跃迁的过程,是吸收能量的过程。 E.光电效应的实验结论是:对于某种金属,超过极限频率的入射光频率越高,所产生的光电子的最大初动能就越大 h l M m v0 (2)(10分)如图所示,在高为h=5m的平台右边缘上,放着一个质量M=3kg的铁块,现有一质量为m=1kg的钢球以v0=10m/s的水平速度与铁块在极短的时间内发生正碰被反弹,落地点距离平台右边缘的水平距离为l=2m.已知铁块与平台之间的动摩擦因数为0.5,求铁块在平台上滑行的距离s(不计空气阻力,铁块和钢球都看成质点). 36.[化学——选修化学与技术](15分) 现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题. ⑴火法炼锌是将闪锌矿(主要含ZnS)通过浮选.焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为: 2ZnS +3O22ZnO+2SO2; 鼓风炉中:2C +O22CO ZnO+COZn + CO2 从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2 图1酸度对铟浸出率的影响 图2液固比对铟浸出率的影响 ①当酸度为196时,其物质的量浓度为 。 ②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______._______。 ⑵湿法炼锌的主要工艺流程为: ①从保护环境和充分利用原料角度,如何处理或利用烟气 。 ②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。 ③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________._______________。 37.【化学——选修物质结构与性质】(15分)金属钛呈银白色,因它坚硬.强度大.耐热.密度小,被称为高技术金属。目前生产钛采用氯化法,主要步骤如下: I.即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4: 2FeTiO3+7Cl2+6C2TiCl4+2FeCl3+6CO TiO2+2Cl2+2CTiCl4+2CO II.将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛: TiCl4+2MgTi+2MgCl2 III.用稀盐酸溶解MgCl2和过量Mg后得海绵状钛,再在真空熔化铸成钛锭。 请回答下列问题: ⑴基态钛原子的价电子排布式为 。 ⑵与CO互为等电子体的离子为 (填化学式)。 ⑶在CH2Cl2.HCHO.CO2.C2H4中,碳原子采取sp2杂化的分子有 。 ⑷TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于 (填“原子”.“分子”或“离子”)晶体。 ⑸与钛同周期的另一种元素钴(Co)可形成分子式均为Co (NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是 ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 。 ⑹在自然界中TiO2有金红石.板钛矿.锐钛矿三种晶型,其中金红石的晶胞如右图所示,则其中Ti4+的配位数为 。 38.【化学——选修有机化学基础】(15分) 双安妥明是一种降血脂药物,主要用于降低血液中胆固醇浓度,安全,副作用小,其结构简式为。 已知: I. II. 双安妥明的合成路线如下: 已知:C的分子式为C4H8,且支链有一个甲基;Ⅰ能发生银镜反应且1mol I能与2mol氢气发生加成反应;K的结构具有对称性。试回答下列问题: ①写出结构简式:A ,C ,J 。 ②反应(2)的条件是 ,反应(3)的类型是 。 ③写出反应(4)的化学方程式: 。 ④与F互为同分异构体,且属于酯类的有机物有 种(含F本身),并写出其中能发生银镜反应的有机物的结构简式: 。 39.[生物—选修模块1 生物技术实践] 某生物兴趣小组以带有落叶的表层土壤为实验材料,研究土壤微生物的分解作用,进行了如下实验: (1)该实验对照组是_________实验组合。 (2)本实验可得出的结论是:①_____________________ ___;(2分) ②________ _____________。(2分) (3)为了进一步研究土壤微生物对淀粉的分解作用,请利用下列实验材料和用具,设计实验并预期实验结果。 实验材料和用具:土壤浸出液.蒸馏水.淀粉糊.恒温箱.烧杯若干.试管若干.碘 液等主要实验步骤:①___________________________________________________ ②___________________________________________________________________ ③_____________________________________________________________________ ④________________________________________________________________ 预期最可能的实验结果:________________________________________________ B淋巴细胞 a ① b c 分离纯化的单克隆抗体 ② ③ 40.[生物—选修模块3 现代生物科技专题] 请根据材料回答下列问题。 材料 单克隆抗体在医疗.诊断等方面发挥着越来越 重要的作用。英国科学家米尔斯坦和柯勒设计了一个 用被免疫的B淋巴细胞制备单克隆抗体的实验,图示 其实验流程,请回答问题 (1)a是 ,b是 ①过程是 ,②过程包括了体外培养 和 。 (2)制备单克隆抗体时,选择B淋巴细胞的原因是 (3)诱导动.植物细胞融合常用的一种化学诱导剂是 (2分),植物体细胞杂交之前还需 用 (2分)酶去除细胞壁,植物体细胞杂 交技术在一定程度上解决了杂交育种的 问题。查看更多