- 2021-05-13 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
历年高考化学工艺流程题
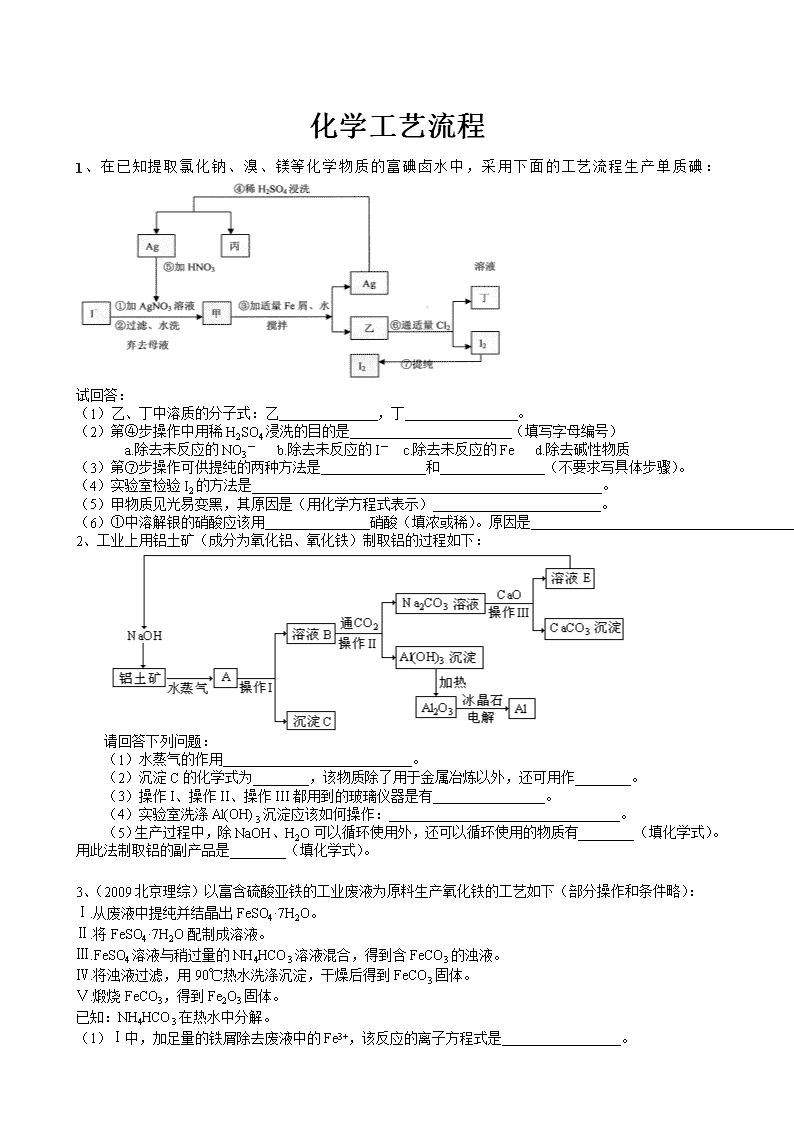
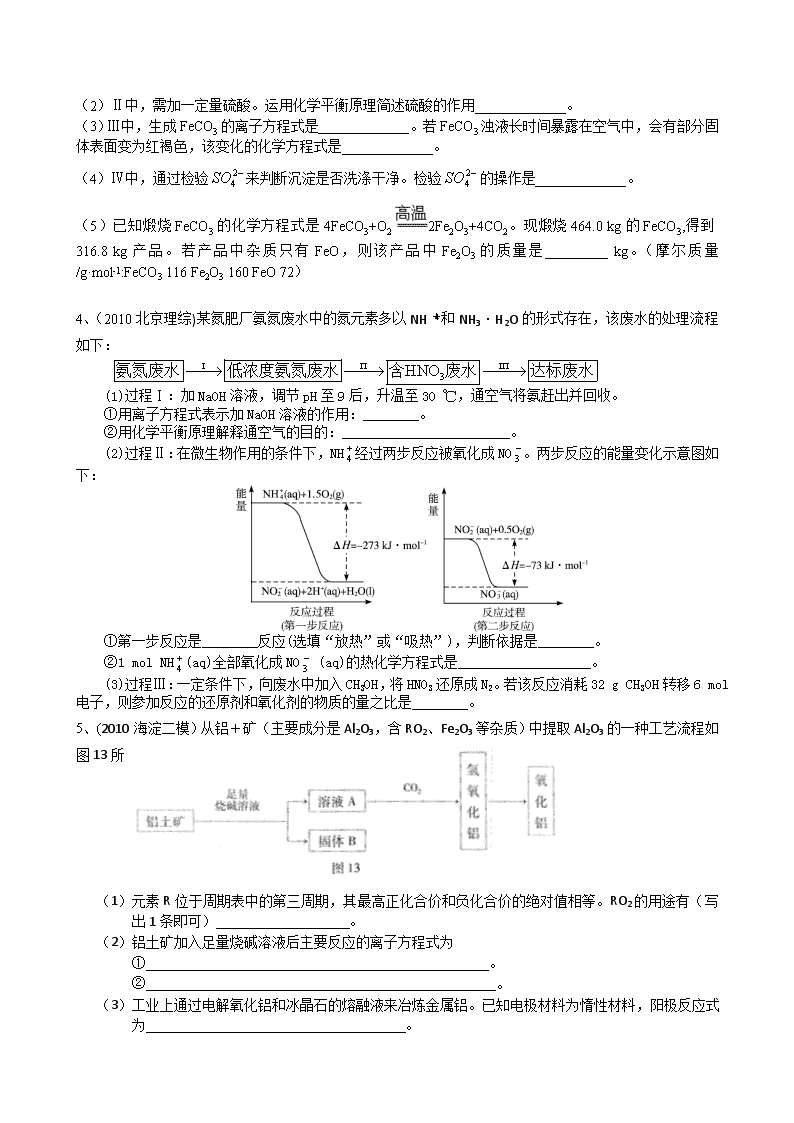
化学工艺流程 1、在已知提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘: 试回答: (1)乙、丁中溶质的分子式:乙 ,丁 。 (2)第④步操作中用稀H2SO4浸洗的目的是 (填写字母编号) a.除去未反应的NO3- b.除去未反应的I- c.除去未反应的Fe d.除去碱性物质 (3)第⑦步操作可供提纯的两种方法是 和 (不要求写具体步骤)。 (4)实验室检验I2的方法是 。 (5)甲物质见光易变黑,其原因是(用化学方程式表示) 。 (6)①中溶解银的硝酸应该用 硝酸(填浓或稀)。原因是 。 2、工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的过程如下: 请回答下列问题: (1)水蒸气的作用 。 (2)沉淀C的化学式为________,该物质除了用于金属冶炼以外,还可用作________。 (3)操作I、操作II、操作III都用到的玻璃仪器是有________________。 (4)实验室洗涤Al(OH)3沉淀应该如何操作: 。 (5)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。 3、(2009北京理综)以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略): Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。 Ⅱ.将FeSO4·7H2O配制成溶液。 Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。 Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。 Ⅴ.煅烧FeCO3,得到Fe2O3固体。 已知:NH4HCO3在热水中分解。 (1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________。 (2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用_____________。 (3)Ⅲ中,生成FeCO3的离子方程式是_____________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________。 (4)Ⅳ中,通过检验来判断沉淀是否洗涤干净。检验的操作是_____________。 (5)已知煅烧FeCO3的化学方程式是4FeCO3+O22Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72) 4、(2010北京理综)某氮肥厂氨氮废水中的氮元素多以NH和NH3·H2O的形式存在,该废水的处理流程如下: (1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。 ①用离子方程式表示加NaOH溶液的作用:________。 ②用化学平衡原理解释通空气的目的:________________________。 (2)过程Ⅱ:在微生物作用的条件下,NH经过两步反应被氧化成NO。两步反应的能量变化示意图如下: ①第一步反应是________反应(选填“放热”或“吸热”),判断依据是________。 ②1 mol NH(aq)全部氧化成NO (aq)的热化学方程式是___________________。 (3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是________。 5、(2010海淀二模)从铝+矿(主要成分是Al2O3,含RO2、Fe2O3等杂质)中提取Al2O3的一种工艺流程如图13所示: (1)元素R位于周期表中的第三周期,其最高正化合价和负化合价的绝对值相等。RO2的用途有(写出1条即可) 。 (2)铝土矿加入足量烧碱溶液后主要反应的离子方程式为 ① 。 ② 。 (3)工业上通过电解氧化铝和冰晶石的熔融液来冶炼金属铝。已知电极材料为惰性材料,阳极反应式为 。 (4)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AIN与一种中学常见气体X。已知每转移3 mol e-,有1.5mol化合物X生成,此反应的化学方程式 。 6、(2010、西城一模)工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: 过滤、热水洗涤 锂辉石 研磨 浸出 过滤 滤液1 滤渣1 过滤 滤液2 滤渣2 Li2CO3粗品 93% ~ 98 % 硫酸 250℃ ~ 300℃ ①石灰乳调pH至11 饱和Na2CO3溶液 ②Na2CO3溶液 250℃ ~ 300℃ 已知:① Li2O·Al2O3·4SiO2 +H2SO4(浓) Li2SO4+Al2O3·4SiO2·H2O↓ ② 某些物质的溶解度(S)如下表所示。 T/℃ 20 40 60 80 S(Li2CO3)/g 1.33 1.17 1.01 0.85 S(Li2SO4)/g 34.2 32.8 31.9 30.7 滤渣1 ( ) I ( ) II 灼烧 III Al2O3 (1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是___ ___。 (2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。 向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。 (3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。 (4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。 a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。 b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。 ① a中,阳极的电极反应式是 。 b中,生成Li2CO3反应的化学方程式是 。 7、CuFeS2 反应Ⅳ NaCl溶液 CuCl(s) S(s) 铁红 反应Ⅲ FeCO3 过滤② Na2CO3 反应Ⅱ 过滤① 、FeCl3 反应Ⅰ Cu 过滤③ Na[CuCl2] 反应Ⅴ 空气 水 溶液A 以黄铜矿为主要原料来生产铜、铁红颜料和硫单质,原料的综合利用率较高。其主要流程如下: ⑴过滤③得到的滤渣成分是: 。(填化学式) ⑵反应Ⅰ~Ⅴ中,共有 个反应不属于氧化还原反应。 ⑶溶液A中含有的溶质是 。(填化学式) ⑷写出反应Ⅰ的化学方程式: 。 ⑸反应Ⅲ是是FeCO3在空气中煅烧,写出化学方程式: 。 8、某地有软锰矿和闪锌矿两座矿山,它们的组成如下:软锰矿:MnO2含量≥65%,SiO2含量约20%,Al2O3含量约4%,其余为水分;闪锌矿:ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。 MnCO3、ZnCO3 反应Ⅰ 软锰矿 S、SiO2 硫酸 反应Ⅱ 闪锌矿 Zn(适量) 反应Ⅲ MnO2 反应Ⅳ Na2CO3 Na2SO4 反应Ⅴ MnO2 Zn Cu Fe(OH)3Al(OH)3 CO2 请回答下列问题: (1)反应Ⅰ后过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。试写出反应Ⅰ中生成CuSO4的化学方程式______________________________。 (2)反应Ⅱ加入适量锌的作用是_________________。如果锌过量,还会进一步发生反应的离子方程式为_______________________________。 (3)反应Ⅴ的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为 _______________________________________________________。 (4) 本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要______________等原料。 10、钛(Ti)被称为继铁、铝之后的第三金属,四川攀枝花和西昌地区的钒钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。 请填写下列空白: (1)电解食盐水时,总反应的离子方程式是__________________________________。 (2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:_________________________。 (3)已知: ①Mg(s) + Cl2(g)=MgCl2(s);△H=-641kJ/mol ;②Ti(s) + 2Cl2(g)=TiCl4(s);△H=-770kJ/mol。下列说法正确的是 。 A.Mg的燃烧热为641kJ/mol B.Ti的能量一定比TiCl4高 C.等质量的Mg(s)、Ti(s)与足量的氯气反应,前者放出的热量多 D.该冶炼Ti法对环境友好 (4)在上述产业链中,合成192t甲醇理论上需额外补充H2________ t(不考虑生产过程中物质的任何损失)。 (5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是____________________。 11、从含镍废催化剂中可回收镍,其流程如下: 某油脂化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。部分阳离子以氢氧化物形式完全沉淀时的pH如下: 沉淀物 Al(OH)3 Fe(OH)3 Fe(OH)2 Ni(OH)2 pH 5.2 3.2 9.7 9.2 回答下列问题: ⑴“碱浸”的目的是除去_______________________________。 ⑵“酸浸”时所加入的酸是_______________(填化学式)。酸浸后,滤液②中可能含有的金属离子是_________________。 ⑶“调pH为2~3”的目的是___________________________。 ⑷产品晶体中有时会混有少量绿矾(FeSO4·7H2O),可能是由于生产过程中___________________________导致Fe2+未被完全氧化造成的。 ⑸NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式是_______________________________________。 12、高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下: 试回答下列问题 (1)操作①搅拌的目的是: 。 (2) 操作②与操作③相同,该操作名称是:___________________。 (3)反应器中,NaOH、NaClO及Fe(NO3)3反应的离子方程式为: _______________________。 (4)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为_________。(计算结果保留一位小数) (5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为 。 13、根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示): (1)写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。 (2)某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。 (3)写出Cl2将Z氧化为K2EO4的化学方程式: 。 (4)由E制备的E(C5H5)2的结构如右图,其中氢原子的化学环境完全相同。但 早期人们却错误地认为它的结构为: 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。查看更多