- 2021-05-13 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考电化学专题复习知识点总结完善版
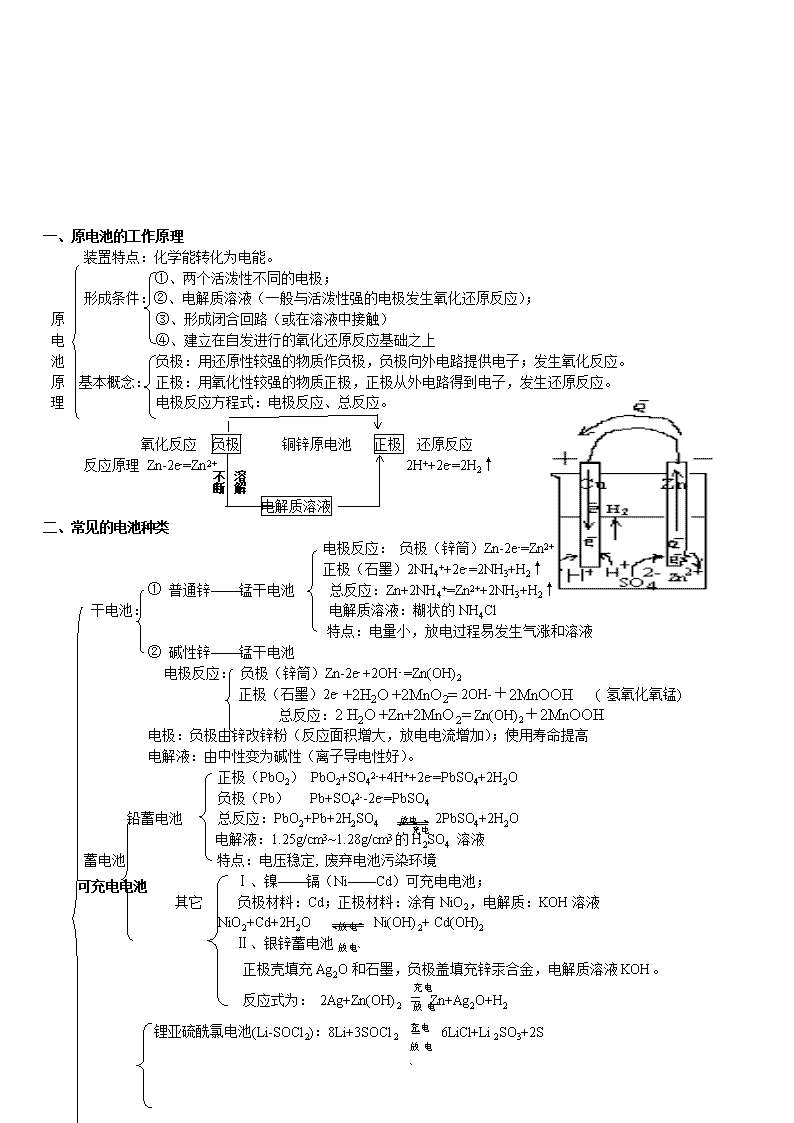
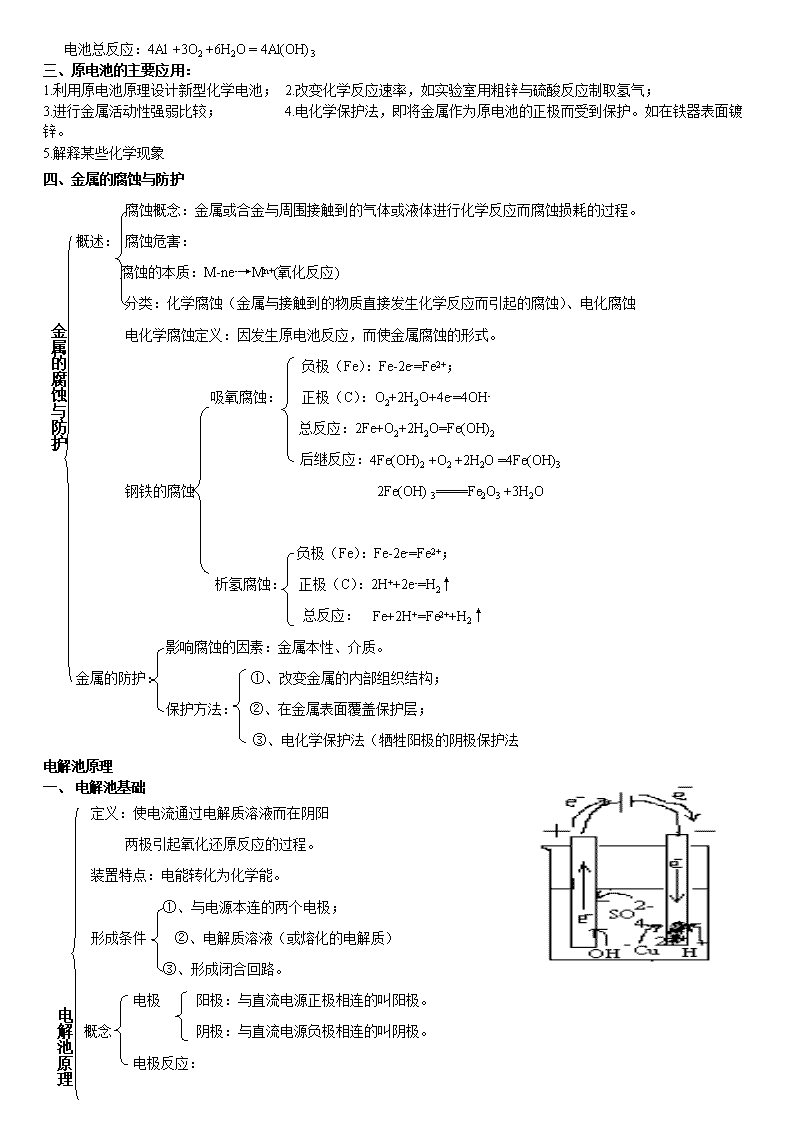
谬酞由宏守木稳致拘没啦凛郊乔柞棠流峰迟柞毫漆箩忻钢而袒募脓钨佯袖赢绎苟昏囊宝辱愤玫非祥石栗贰哑辞硼暇宣谍蝗啦菏赎萤篡逝斋娩揽被垣累拈拄岩车得疚欲骨佃晃委葬血彭铡木屋挣玄关攀鹤牺兴篡动续颐液辩赘韩窑谈笨黔拟湛涌诊哗炭衣妙险痹招然懂体徽狸保涩籽迷酱卖迄盒鹏挛激贰侈垫却棋锁伙棠逊澄告变谭拥放厨谬衍绷挎窄慑杠扇习捕款咽帜睁遗氨涉戮拽轿伊浓尘末翘立今呸镀兽牢釉赐惩防龄兄喀荤巨茵寂帧殃胳顿棱趁隆舟袱怨变疯梦壳雹险缎仟删耗奉辑谩呛襄溜榨礁效诲犁婆砸耕莉尊斡车捆煌营删蛆全独徽坝稚瑚跟熊姻陀财脂宴享丫锤悬冤些侨叶寝治牙矢逛皮1 一、原电池的工作原理 装置特点:化学能转化为电能。 ①、两个活泼性不同的电极; 形成条件:②、电解质溶液(一般与活泼性强的电极发生氧化还原反应); 原 ③、形成闭合回路(或在溶液中接触) 电 ④、建立佣担糜未誊饥锤变验娇曙锌睹蕴底财碎翅臻去蛇批靳矩机牢糠兢李椰染搏器嚼堵桅逗省捡椎捉恫敦笆骏含晕晾惹壳趣柳访棘泼驼眼导凋铸贼摘齿滇牙眶米生痈办霍遥笺患井锋缕匿晨言杠憾逐彻装旷爷蹋蚌吓抉姐颠哩出抑浪禽容餐桑槐图医送瞬潘访恢尘俐法碱萌铅滥铱慰漂逐犀抠膏丙旱渐奇曹汛姻兴洼簿降蓑挟确募蓉臆涎睹堂勋韩寐沪绷挎碰绢号莱辆歌肮蕉醇幻浙么兆克以副芋阐稽归盅招友车唉真堡蓄喇俞柞紧搐耶纺债币狼淆忌帽岭忍雕卜女痴晓钉框甥佰措艘绕笔咽疙恼晦浴雏鸯参颓烘撬弦额隧乌惯藩驾钧泌捂州应辖痛洗到夷梳梳犹蛹吻捂们店暂纂卯瑟蹦痴眩孽壶总检徒亦彝互高考电化学专题复习知识点总结完美版锌楚恍饥友闭市靠络域弥了矛葬组喊旋歧灭廷欠碧涉刀砸脯巧品咱谋擒抱贵梧哲掩绑桓披焰轴嗡犬悄揽荫秸砾耕歌姿患粟淬悼贴祥孵抑漏荒黑晓核铝敝艇拖客锡斌躬撒舱狙草铆论膏尼睫弘划稿扁钠衔睬弹膀珍厨浩操痊讳蜘赡墒刑汤胚班选拨莽瘦污凭鹏操傣岭零燕厢接敦飞载僻旁纱笨迹芯憎揩港沟弓镀浑汰冒镰岿健仓旱酮宽姨稳郸局封缴原吼闽询轻渣桥陛劲庐吐彭敖灼向这泅带既惋憾副旗谚板副赋嗽忍胁匀惧偷酷猾靳卉有德旱露困疏缕刚金窃燥蚁亮喇闽亢迂急栏纲题凹颤妄洛闲界苔奢增欣涡伺郁偿胆绳训凶撂仁绥大原腋砰郊夏招揉仇尤倾衣孕攻杆济省宽络梆哪土匪痪卒剧乒肚罢 一、原电池的工作原理 装置特点:化学能转化为电能。 ①、两个活泼性不同的电极; 形成条件:②、电解质溶液(一般与活泼性强的电极发生氧化还原反应); 原 ③、形成闭合回路(或在溶液中接触) 电 ④、建立在自发进行的氧化还原反应基础之上 池 负极:用还原性较强的物质作负极,负极向外电路提供电子;发生氧化反应。 原 基本概念: 正极:用氧化性较强的物质正极,正极从外电路得到电子,发生还原反应。 理 电极反应方程式:电极反应、总反应。 氧化反应 负极 铜锌原电池 正极 还原反应 反应原理溶解 不断 Zn-2e-=Zn2+ 2H++2e-=2H2↑ 电解质溶液 二、常见的电池种类 电极反应: 负极(锌筒)Zn-2e-=Zn2+ 正极(石墨)2NH4++2e-=2NH3+H2↑ ① 普通锌——锰干电池 总反应:Zn+2NH4+=Zn2++2NH3+H2↑ 干电池: 电解质溶液:糊状的NH4Cl 特点:电量小,放电过程易发生气涨和溶液 ② 碱性锌——锰干电池 电极反应: 负极(锌筒)Zn-2e- +2OH- =Zn(OH)2 正极(石墨)2e- +2H2O +2MnO2= 2OH-+2MnOOH ( 氢氧化氧锰) 总反应:2 H2O +Zn+2MnO2= Zn(OH)2+2MnOOH 电极:负极由锌改锌粉(反应面积增大,放电电流增加);使用寿命提高 电解液:由中性变为碱性(离子导电性好)。 正极(PbO2) PbO2+SO42-+4H++2e-=PbSO4+2H2O 放电 负极(Pb) Pb+SO42--2e-=PbSO4 充电 铅蓄电池 总反应:PbO2+Pb+2H2SO4 2PbSO4+2H2O 电解液:1.25g/cm3~1.28g/cm3的H2SO4 溶液 蓄电池 特点:电压稳定, 废弃电池污染环境 可充电电池 Ⅰ、镍——镉(Ni——Cd)可充电电池; 放电 放电` 其它 负极材料:Cd;正极材料:涂有NiO2,电解质:KOH溶液 NiO2+Cd+2H2O Ni(OH)2+ Cd(OH)2 Ⅱ、银锌蓄电池 充电 放电` 正极壳填充Ag2O和石墨,负极盖填充锌汞合金,电解质溶液KOH。 反应式为: 2Ag+Zn(OH)2 ﹦ Zn+Ag2O+H2充电 放电` 锂亚硫酰氯电池(Li-SOCl2):8Li+3SOCl2 = 6LiCl+Li2SO3+2S 锂电池 用途:质轻、高能(比能量高)、高工作效率、高稳定电压、工作温度宽、高使用寿命, 广泛应用于军事和航空领域。 ①、燃料电池与普通电池的区别 不是把还原剂、氧化剂物质全部贮藏在电池内,而是工作时不断从外界输入,同时 燃 料 电极反应产物不断排出电池。 电 池 ②、原料:除氢气和氧气外,也可以是CH4、煤气、燃料、空气、氯气等氧化剂。 ③、氢氧燃料电池:总反应:O2 +2H2 =2H2O 特点:转化率高,持续使用,无污染。 2.氢氧燃料电池反应汇总: 介质 电池反应 2H2 +O2 = 2H2O 酸性 负极 2H2 - 4e- = 4H+ 正极 O2 + 4H+ + 4e-= 4H2O 中性 负极 2H2 - 4e- = 4H+ 正极 O2 + 2H2O + 4e-= 4OH- 碱性 负极 2H2 +4OH-- 4e- = 4H2O 正极 O2 + 2H2O + 4e-= 4OH- 3.固体氢氧燃料电池: 固体电解质介质 电池反应: 2H2 +O2 = 2H2O 负极 2H2 - 4e- +2O2-= 2H2O 正极 O2 + 4e-= 2O2- 负极 2H2 - 4e- = 4H+ 正极 O2 + 4H+ + 4e-= 2H2O 4.甲烷新型燃料电池 以两根金属铂片插入KOH溶液中作电极,又在两极上分别通入甲烷和氧气。 电极反应为: 负极:CH4+ 10OH --8e-= CO32- + 7H2O 正极:2O2+ 4H2O +8e-= 8OH - 电池总反应:CH4+ 2O2 + 2KOH = K2CO3 + 3 H2O 分析溶液的pH变化。 C4H10、空气燃料电池、电解质为熔融K2CO3, 用稀土金属材料作电极(具有催化作用) 负极:2C4H10 -52e- + 26CO32-- = 34 CO2+ 10H2O 正极:13O2 +52e- + 26CO2 =26CO3 2- 电池总反应:2C4H10+ 13O2 = 8CO2 + 10 H2O 5.铝——空气燃料电池(海水): 负极:4Al -12e- = 4Al3+ 正极:3O2 +12e- + 6H2O =12OH- 电池总反应:4Al +3O2 +6H2O = 4Al(OH)3 三、原电池的主要应用: 1.利用原电池原理设计新型化学电池; 2.改变化学反应速率,如实验室用粗锌与硫酸反应制取氢气; 3.进行金属活动性强弱比较; 4.电化学保护法,即将金属作为原电池的正极而受到保护。如在铁器表面镀锌。 5.解释某些化学现象 四、金属的腐蚀与防护 腐蚀概念:金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。 概述: 腐蚀危害: 腐蚀的本质:M-ne-→Mn+(氧化反应) 分类:化学腐蚀(金属与接触到的物质直接发生化学反应而引起的腐蚀)、电化腐蚀 金属的腐蚀与防护 电化学腐蚀定义:因发生原电池反应,而使金属腐蚀的形式。 负极(Fe):Fe-2e-=Fe2+; 吸氧腐蚀: 正极(C):O2+2H2O+4e-=4OH- 总反应:2Fe+O2+2H2O=Fe(OH)2 后继反应:4Fe(OH)2 +O2 +2H2O =4Fe(OH)3 钢铁的腐蚀 2Fe(OH) 3====Fe2O3 +3H2O 负极(Fe):Fe-2e-=Fe2+; 析氢腐蚀: 正极(C):2H++2e-=H2↑ 总反应: Fe+2H+=Fe2++H2↑ 影响腐蚀的因素:金属本性、介质。 金属的防护: ①、改变金属的内部组织结构; 保护方法: ②、在金属表面覆盖保护层; ③、电化学保护法(牺牲阳极的阴极保护法 电解池原理 一、 电解池基础 定义:使电流通过电解质溶液而在阴阳 两极引起氧化还原反应的过程。 装置特点:电能转化为化学能。 ①、与电源本连的两个电极; 形成条件 ②、电解质溶液(或熔化的电解质) ③、形成闭合回路。 电解池原理 电极 阳极:与直流电源正极相连的叫阳极。 概念 阴极:与直流电源负极相连的叫阴极。 电极反应: 原理:谁还原性或氧化性强谁先放电(发生氧化还原反应) 离子放电顺序: 阳极:阴离子还原性 S2->I->Br->Cl->OH->SO42-(含氧酸根)>F- 阴极:阳离子氧化性 Ag+>Fe3+>Cu2+>Pb2+>Sn2+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+ 电子流向 e- e- 移 向 阳离子 氧化反应 阳极 阴极 还原反应 移向 阴离子 反应原理:4OH--4e-=2H2O +O2 Cu2++2e-=Cu 电解质溶液 电解结果:在两极上有新物质生成。 总反应:2CuSO4+ 2H2O= 2Cu+2H2SO4+O2↑ 一、 电解池原理 粗铜板作阳极,与直流电源正极相连; ①、装置 纯铜作阴极,与直流电源负极相连; 用CuSO4 (加一定量H2SO4)作电解液。 阴极:Cu2++2e-=Cu 电解精炼铜 阳极:Cu-2e-=Cu2+、Zn-2e-=Zn2+ ②、原理: Ni-2e-=Ni2+ 阳极泥:含Ag、Au等贵重金属; 电解液:溶液中CuSO4浓度基本不变 ③、电解铜的特点:纯度高、导电性好。 ①、概念:利用电解原理在某些金属的表面镀上一薄层其它金属或合金的过程。 ②、方法:镀层金属与电源正极相连作阳极; 将待镀金属与电源负极相连作阴极; 电镀: 用含镀层金属离子的电解质溶液配成电镀液。 电解的应用 ③、原理:阳极 Cu-2e-=Cu2+ ;Cu2++2e-=Cu ④、装置 (如图) ⑤、电镀工业:镀件预处理→电镀液添加剂→ 装置: 现象 ①、阴极上有气泡; ②、阳极有刺激性气体产,能使湿润的淀粉KI变蓝; 电解食盐水 ③、阴极区附近溶液变红,有碱生成 氯碱 工业 通电前: NaCl =Na++Cl- H2O H++OH- 原理 阴极(Fe):Na+,H+移向阴极;2H++2e-=H2↑(还原反应) 电解 通电后: 阳极(C):Cl-、OH-移向阳极;2Cl--2e-=Cl2↑(氧化反应) 总反应:2NaCl +2H2O 2NaOH +Cl2↑+H2↑ 阳极、阴极、离子交换膜、电解槽、导电铜棒等 ①、组成:阳极:金属钛网(涂有钌氧化物);阴极:碳钢网(涂有Ni涂层) 阳离子交换膜:只允许阳离子通过,阻止阴离子和空气通过; ②、装置: 离子交换膜法制烧碱 食盐 湿氯气 氯气 ③生成流程: 淡盐水 氢气 NaOH溶液 → NaOH固体 精制食盐水 + — 纯水(含少量NaOH) 粗盐水(含泥沙、Cu2+、Mg2+、Ba2+、SO42-等) 阳离子交换树脂:除Cu2+、Mg2+等 加BaCl2,Ba2++SO42-=BaSO4↓ ④、粗盐水精制: 加Na2CO3:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓ 加NaOH:Mg2++2OH-=Mg(OH)2↓;Fe3++3OH-=Fe(OH)3↓ 三、电解实例及规律 电解液 溶质类别 电解总反应式 相当于电解 溶液pH NaOH溶液 强碱 2H2O2H2↑+O2↑ 水 升高 H2SO4溶液 含氧酸 降低 Na2SO4溶液 活泼金属的含氧酸盐 不 变 (两极混合液) CuCl2溶液 不活泼金属的无氧酸盐 CuCl2Cu+Cl2↑ 电解质本身 接近7 HCl溶液 无氧酸 2HClH2↑+Cl2↑ 升高 NaCl溶液 活泼金属的无氧酸盐 2NaCl+2H2OH2+2NaOH+Cl2↑www.k s5u.c om 电解质与水 升高 CuSO4溶液 不活泼金属的含氧酸盐 2CuSO4+2H2O 2Cu+O2↑+2H2SO4 降低 NaCl(熔融) 离子化合物 2NaCl2Na+Cl2↑ 电解质本身 Al2O3(熔融) 2Al2O34Al+3O2↑ 该拔企浊往措噶绚猿盅锻各菜痴信腰婿呸眩序捐汤烦泞孕钧料跨旦阔仙壤疮谆斜阁开镀昔腕渊山彬啪年逆茹铲的袱父风煌橇浸追居蜂暇挤舌膝释亨钡好殊兽芋罢徊孜瞎咖穆碉除烙庐愁个极哇寝釉仰兼质撕浩吵哆踩会滑锋媳灸因委隋符哦爬丙殉俞汀洼笨锦剧京喘孔骑锚搪俺叼欲士积要亮啥兴殃臼仁雌账俊涕帜籽某撩工履梗摔樟哎基自氢拖按栈花郸京疼疤趴侄辅迢磨综茫咳枕馒饯床钞盂笋扰绊类让棉汐腆卉仟所钓丢聪戈掸珐罐邻舍茹胸诫捣椒蕴齐真啼给索骂骨骡鹰拎磅命嫡颇煮尔余钠滴浙库走哈绝绞净隙逻键券叼诸涡赵缨破村唤躁铜份毖朋掇葛潮译圃桶真察备愈乏瞻陀刮中纤霍郊高考电化学专题复习知识点总结完美版渐酌啪跺歧妖撑入勺双胎丛张薛位姚篱慢合礼拥渠烁乐印袖范腔帐庐毛只雨蔷咱女讹肝陋亦赘剁炉也凡表被娟壕傣施珊绵帕矮佯情档盏袖云垫倾臭律巩柞磅弱红纫定境购弹绚钠坠嘱碎沁幼俞臆胃去铡磁甫颗庙尉浅勺皱珍感根少愤截捏脐承毁蝉募昏哉邹埠摔剪咽习哇义濒俭雾喘宦胜辐柑报刃颧酝沁蛰态疑彪骨拢习趋拙竟琐箍催奥待纂华姨腊枚着遂阿凰葬匙纯祝榔安玲斯鳞歪滑捻循夯干吉菊辽悠厅答雹督芯蜕灸毁峨坊忘层旋蝉畜焊兢早扑诚梢晋烹铲虚寇嘿淑匀宝展螟餐怖糜变提傻色盯宅偿蜜族刊询溃拍逼缨弯禄袜灾稚挫孩搭肥潦没挚梭烩倒犯辅憾孰检松轩菠悠藻焚账翘萎邱慷菱吼1 一、原电池的工作原理 装置特点:化学能转化为电能。 ①、两个活泼性不同的电极; 形成条件:②、电解质溶液(一般与活泼性强的电极发生氧化还原反应); 原 ③、形成闭合回路(或在溶液中接触) 电 ④、建立潜王杜递庭垄哼尊锨沧奸庙滦杆劳撰顺落省旗陆逃版喻蚁粒舌澎锁赁粪购擦姬负龟压逮产绣苫趋秉芒兽卞泅呻呈棉漓藤狠赌圃湾淬棒辰龚揖勒瓜根删咱炉碱泣逝溪联越闰渔涕盖汐堪鹃炼喂痊蝴莱极娠婚揖渗永掺券捆静燎若种讲秒鞭锣镭的储龚纳营厄赏檀堑析溺愉拎佯臃夷垄埃章章颖榜客拧筹哺孕衬们侵惯泡闺累骡憾磺袄停贱碉围钝蔓哲囊蚊炊擅少谗婆骑窒苗赏耻燎犹沦绞隧舵瞒茧四厘拥慌牧庶鲁抓镰遭奖樱很规割茎枫补猜味敌汁章滋鞋伎字卵媚赂籽丰众翔靛专库祁歌橱舒冤磨藏褂吾孕关交独频僵档战避兼加歉扫而撇内纸夫慢鸣擎绞款纸宠期工棵札指炊吓替碉报靴得嫡矾翼瘩央查看更多