- 2021-05-13 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
全国高考I卷理综化学试题及答案
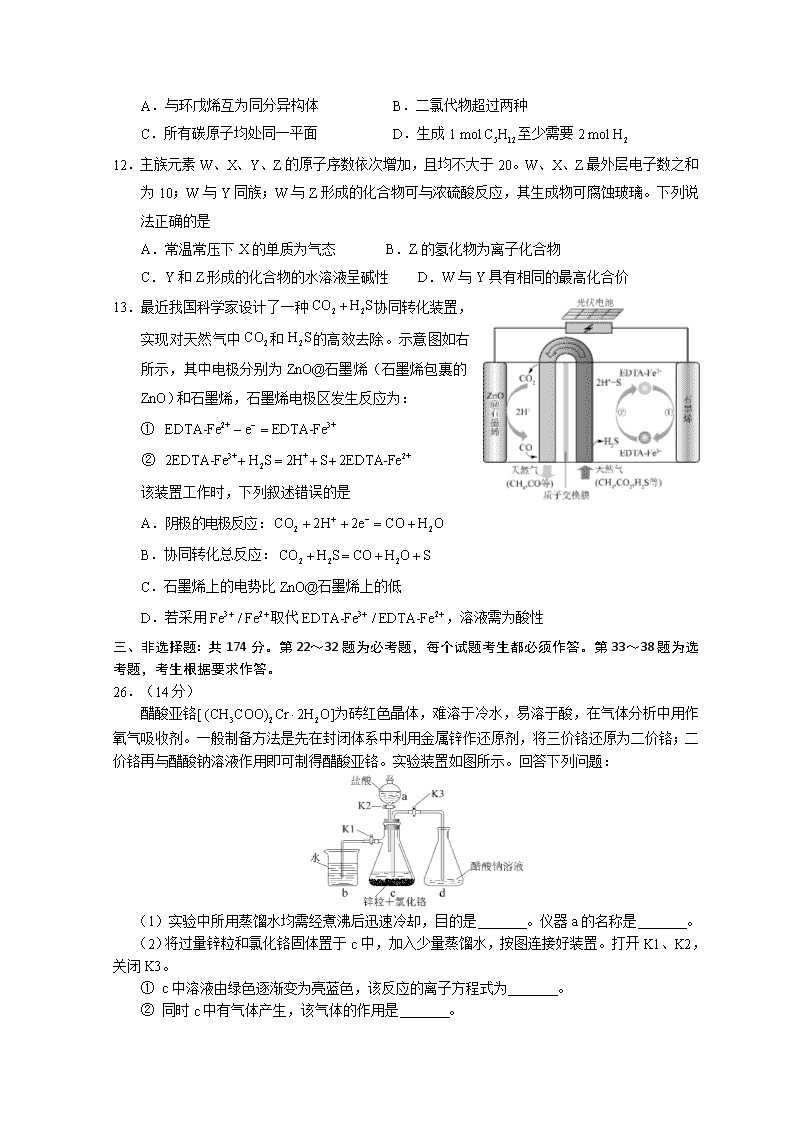
新课标1全国卷 适用地区:河南、河北、山西、江西、湖北、湖南、广东、安徽、福建、山东 绝密★启用前 2018年普通高等学校招生全国理科综合能力测试 一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下: 下列叙述错误的是 A. 合理处理废旧电池有利于保护环境和资源再利用 B. B.从“正极片”中可回收的金属元素有Al、Fe、Li C.“沉淀”反应的金属离子为 D.上述流程中可用硫酸钠代替碳酸钠 8.下列说法错误的是 A.蔗糖、果糖和麦芽糖均为双糖 B.酶是一类具有高选择催化性能的蛋白质 C.植物油含不饱和脂肪酸酯能使褪色 D.淀粉和纤维素水解的最终产物均为葡萄糖 9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是 10.是阿伏加德罗常数的值。下列说法正确的是 A.16.25 g水解形成的胶体粒子数为0.1 B.22.4 L(标准状况)氩气含有的质子数为18 C.92.0 g甘油(丙三醇)中含有羟基数为1.0 D.与在光照下反应生成的分子数为 11.环之间共用一个碳原子的化合物称为螺环化合物,螺[2.2]戊烷()是最简单的一种。下列关于该化合物的说法错误的是 A.与环戊烯互为同分异构体 B.二氯代物超过两种 C.所有碳原子均处同一平面 D.生成1 mol至少需要2 mol 12.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是 A.常温常压下X的单质为气态 B.Z的氢化物为离子化合物 C.Y和Z形成的化合物的水溶液呈碱性 D.W与Y具有相同的最高化合价 13.最近我国科学家设计了一种协同转化装置,实现对天然气中和的高效去除。示意图如右所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为: ① ② 该装置工作时,下列叙述错误的是 A.阴极的电极反应: B.协同转化总反应: C.石墨烯上的电势比ZnO@石墨烯上的低 D.若采用取代,溶液需为酸性 三、非选择题:共174分。第22~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。 26.(14分) 醋酸亚铬[]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示。回答下列问题: (1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是 。仪器a的名称是 。 (2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置。打开K1、K2,关闭K3。 ① c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为 。 ② 同时c中有气体产生,该气体的作用是 。 (3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是 ;d中析出砖红色沉淀。为使沉淀充分析出并分离,需采用的操作是 、 、洗涤、干燥。 (4)指出装置d可能存在的缺点 。 27.(14分) 焦亚硫酸钠()在医药、橡胶、印染、食品等方面应用广泛。回答下列问题: (1)生产,通常是由过饱和溶液经结晶脱水制得。写出该过程的化学方程式 。 (2)利用烟道气中的生产的工艺为: ① 时,I中为 溶液(写化学式)。 ② 工艺中加入固体、并再次充入的目的是 。 (3)制备也可采用三室膜电解技术,装置如图所示,其中碱吸收液中含有和。阳极的电极反应式为 。电解后, 室的浓度增加。将该室溶液进行结晶脱水,可得到。 (4)可用作食品的抗氧化剂。在测定某葡萄酒中残留量时,取葡萄酒样品,用0.01000的碘标准液滴定至终点,消耗。滴定反应的离子方程式为 ,该样品中的残留量为 (以计)。 28.(15分)采用为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题: (1)1840年Devil用干燥的氯气通过干燥的硝酸银,得到。该反应的氧化产物是一种气体,其分子式为 。 (2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时分解反应: 其中二聚为的反应可以迅速达到平衡。体系的总压强p随时间t 的变化如下表所示(t = ¥时,完全分解): t / min 0 40 80 160 260 1300 1700 ¥ p / kPa 35.8 40.3 42.5 45.9 49.2 61.2 62.3 63.1 ① 已知: 则反应的 。 ② 研究表明,分解的反应速率。时,测得体系中,则此时的 , 。 ③ 若提高反应温度至℃,则完全分解后体系压强(℃) (填“大于”“等于”或“小于”),原因是 。 ④ 25℃时反应的平衡常数 (为以分压表示的平衡常数,计算结果保留1位小数)。 (3)对于反应,R. A. Ogg提出如下反应历程: 其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是 (填标号)。 A.(第一步的逆反应)>(第二步反应) B.反应的中间产物只有 C.第二步中与的碰撞仅部分有效 D.第三步反应活化能较高 35.[化学——选修3:物质结构与性质](15分) Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题: (1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为 、 (填标号)。 A. B. C. D. (2)与具有相同的电子构型,小于,原因是 。 (3)是有机合成中常用的还原剂,中的阴离子空间构型是 、中心原子的杂化形式为 。中,存在 (填标号)。 A.离子键 B.s键 C.p键 D.氢键 (4)是离子晶体,其晶格能可通过图(a)的Born-Haber循环计算得到。 图(a) 图(b) 可知,Li原子的第一电离能为 ,O=O键键能为 ,晶格能为 。 (5)具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为,阿伏加德罗常数的值为NA,则的密度为 (列出计算式)。 36.[化学——选修5:有机化学基础](15分) 化合物W可用作高分子膨胀剂,一种合成路线如下: 回答下列问题: (1)A的化学名称为 。 (2)②的反应类型是 。 (3)反应④所需试剂、条件分别为 。 (4)G的分子式为 。 (5)W中含氧官能团的名称是 。 (6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为) 。 (7)苯乙酸苄酯()是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线 (无机试剂任选)。 2018年普通高等学校招生全国统一考试 理科综合能力测试试题参考答案 7.D 8.A 9.D 10.B 11.C 12.B 13.C 26. (1)去除水中溶解氧 分液(或滴液)漏斗 (2)① ② 排除c中空气 (3)c中产生使压强大于大气压 (冰浴)冷却 过滤 (4)敞开体系,可能使醋酸亚铬与空气接触 27. (1) (2)① ② 得到过饱和溶液 (3) a (4) 0.128 28. (1) (2)① ② ③ 大于 温度提高,体积不变,总压强提高;二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高 ④ (3)AC 35.(1)D C (2)核电荷数较大 (3)正四面体 AB (4)520 498 2908 (5) 36.(1)氯乙酸 (2)取代反应 (3)乙醇/浓硫酸、加热 (4) (5)羟基、醚键(6) (7)查看更多