- 2021-05-13 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学图像专题题复习水溶液中的离子平衡
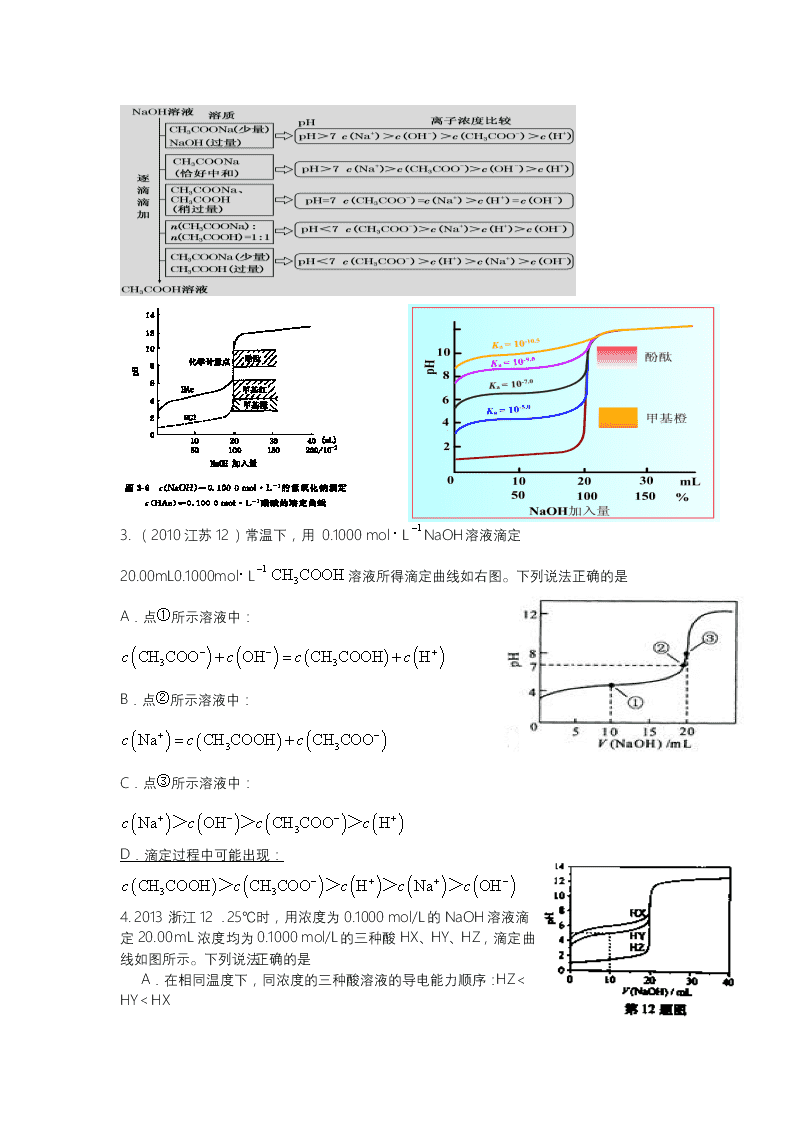
高考化学教研材料 《水溶液中的离子平衡》中的常见图像题 张维青 2015.3.7 解答图像题的一般思路: 1. 分析横纵坐标表示的意义 2. 结合原理分析点-线-面。点:起点、拐点、终点、过量点.线:增函数、减函数、斜率、线性关系等 3. 化学平衡中的先拐先平、定一议二等技巧仍适用 一、 稀释曲线: Ⅰ稀溶液中电离度、水解度均增大,无限稀释看作水。 Ⅱ、主要离子的浓度均下降。 1.(2015年1卷13题,6分)浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图所示,下列叙述错误的是( ) A.MOH的碱性强于ROH的碱性B.ROH的电离程度:b点大于a点 C.若两溶液无限稀释,则它们的c(OH-)相等 D.当lg=2时,若两溶液同时升高温度,则c(M+)/c(R+)增大 2.(2015海南 11.)下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离度与浓度关系的是 二.滴定曲线:以滴定酸为例 Ⅰ、起点的PH确定酸的强弱 Ⅱ、突变范围(终点±0.1%)确定指示剂: 同一强酸浓度越大突变范围越宽。同浓度的不同酸酸性越弱,突变范围越窄。 Ⅲ、酸性太弱的(如铵根)用间接滴定法 3. (2010江苏12)常温下,用 0.1000 mol·LNaOH溶液滴定 20.00mL0.1000mol·L溶液所得滴定曲线如右图。下列说法正确的是 A.点①所示溶液中: B.点②所示溶液中: C.点③所示溶液中: D.滴定过程中可能出现: 4. 2013浙江12.25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定20.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是 A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX B.根据滴定曲线,可得Ka(HY)≈10—5 C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X—)>c(Y—)>c(OH—)>c(H+) Ka(HY)·c(HY) c(Y—) D.HY与HZ混合,达到平衡时:c(H+)= + c(Z—) +c(OH—) 5.(海南2014)室温下,用0.100mol•L-1 NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( ) A.Ⅱ表示的是滴定醋酸的曲线 B.pH=7时,滴定醋酸消耗的V(NaOH)小于20mL C.V(NaOH)=20.00mL时,两份溶液中c(Cl-)=c(CH3COO-) D.V(NaOH)=10.00mL时,醋酸溶液中 c(Na+)>c(CH3COO-)>c(H+)>c(OH-) 6.2014全国2卷实验题(间接滴定) 三、分布分数曲线 表示酸碱分布分数(某物种的浓度占各物种浓度之和的分数)与pH 的关系 Ⅰ、交点处的[H+]==Ka,可以依次计算出Ka1Ka2Ka3,得出某种离子存在的PH范围 Ⅱ、各组分的分布分数之和为1(物料) 7(.江苏201215.) 25°C,有c(CH3COOH)+c(CH3COO-)= 0. 1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图7 所示。下列有关溶液中离子浓度关系的叙述正确的是 A. pH=5. 5 的溶液中: c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) B. W 点所表示的溶液中: c(Na+)+c(H+)= c(CH3COOH)+c(OH-) C. pH = 3. 5 的溶液中: c(Na+) +c(H+) -c(OH-) +c(CH3COOH)= 0. 1mol·L-1 D. 向W 点所表示的1. 0 L 溶液中通入0. 05 mol HCl 气体(溶液体积变化可忽略): c(H+)= c(CH3COOH)+c(OH-) 8.江苏2013. (14分)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。 (1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下: 2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) △H1=+3359.26 kJ·mol-1 CaO(s)+SiO2(s)=CaSiO3(s) △H2=-89.61 kJ·mol-1 2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) △H3 则△H3=2821.6 kJ·mol-1。 (2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示: 11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4 60molCuSO4能氧化白磷的物质的量是3mol (3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如右图所示。 ①为获得尽可能纯的NaH2PO4,pH应控制在4~5.5(介于此区间内的任意值或区间均可);pH=8时,溶液中主要含磷物种浓度大小关系为c(HPO42-)>c(H2PO4-) ②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是 用离子方程式表示)。3Ca2++2HPO42-=Ca3(PO4)2↓+2H+ (4)略 9.2015浙江12.40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是 A.在pH=9.0时,c(NH4+)>c(HCO)>c(NH2COOˉ)>c(CO32-) B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ) C.随着CO2的通入,不断增大 D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 四、有关溶解度、KSP(待完善)提纯固体的方法一般方法 1、重结晶:如:溶解-加热浓缩---冷却结晶—过滤、洗涤、干燥(除除KNO3中NaCI) 2、溶解-加热浓缩结晶—趁热过滤—洗涤—干燥(除NaCI中KNO3) 说明:Ⅰ趁热过滤:溶质在低温时可能大量析出,在过滤除杂时为避免它析出应采取方法。用热漏斗完成。 Ⅱ洗涤:水洗、醇洗、混合洗:目的是洗去固体表面的可溶物 Ⅲ右图中的A,C点为恰好饱和,曲线上为沉淀区,下为溶解区 10、[2013高考∙重庆卷∙8](14分)合金是建造航空母舰的主体材料。 (1) 航母升降机可由铝合金制造。 ① 铝元素在周期表中的位置为 。工业炼铝的原料由铝土矿提取而得。提取过程中通入的气体为 。② Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为 。焊接过程中使用的保护气为 (填化学式)。 (2) 航母舰体为合金钢。 ① 舰体在海水中发生的电化学腐蚀主要为 。 ② 航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为 。 1 2 3 4 5 6 7 8 9 10 11 12 I I I I I I I I I I I I I I I I I I I I 1 2 3 4 5 6 7 8 9 10 11 12 pH 题8图 开始 沉淀 沉淀 完全 Fe3+ Al3+ Cu2+ Fe2+ Ni2+ Mg2+ (3) 航母螺旋桨主要用铜合金制造。 ① 80.0gCu-Al合金用酸完全溶解后, 加入过量氨水,过滤得白色沉淀 39.0g,则合金中Cu的质量分数 为 。 ② 为分析某铜合金的成分,用酸将 其完全溶解后,用NaOH溶液调 pH,当pH=3.4时开始出现沉淀, 分别在pH为7.0、8.0时过滤沉 淀。结合题8图信息推断该合金 中除铜外一定含有 。 11.背景:柠檬酸亚铁的制备 难点:①混合溶液次序来控制PH②在乙醇中析出晶体③加热浓缩---冷却结晶的具体温度 ④控制PHpH约为5除去AlFe离子,冰水洗涤 (2013江苏)19.(15分)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3=== FeCO3↓+Na2SO4 FeCO3+C6H8O7 === FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。 金属离子 开始沉淀的pH 沉淀完全的pH Fe3+ 1. 1 3. 2 Al3+ 3. 0 5. 0 Fe2+ 5. 8 8. 8 (1)制备FeCO3时,选用的加料方式是c(填字母),原因是 避免生成Fe(OH)2沉淀 a.将FeSO4溶液与Na2CO3 溶液同时加入到反应容器中 b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中 c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中 (2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。 (3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是防止+2价的铁元素被氧化。②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全 (4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出 。 (5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,先制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, (过滤,)向反应液中加入足量的铁粉,充分搅拌后,滴加NaOH溶液调节反应液的pH约为5,过滤,充分洗涤固体,向固体加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤 ,得到FeSO4 溶液,加热浓缩得到60℃饱和溶液,冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥 ,得到FeSO4·7H2O 晶体。 12. 背景:含氟牙膏的使用 (1)钙、磷在骨骼牙齿中的存在形式为羟基磷酸钙(Ca5(PO4)3OH) 含氟牙膏中含氟离子,可以使使牙齿更坚固,原因是生成Ca5(PO4)3F ,写出该过程的离子反应方程式 ;此反应能发生的原因是 (2)糖在酶的作用下产生了一种有机弱酸,食糖过多会会出现龋齿,从平衡移动加以解析: 13、背景:葡萄糖酸钙的制备 难点: ①水浴加热的方法:②葡萄糖酸的酸性强于碳酸但是仍是弱酸 ③趁热过滤④乙醇-水混合溶液洗涤 (2014浙江)28.(14分)葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得: C6H12O6(葡萄糖) + Br2 + H2O → C6H12O7(葡萄糖酸) + 2HBr 2C6H12O7(葡萄糖酸) + CaCO3 → Ca(C6H11O7)2(葡萄糖酸钙) + H2O + CO2↑ 相关物质的溶解性见下表: 物质名称 葡萄糖酸钙 葡萄糖酸 溴化钙 氯化钙 水中的溶解性 可溶于冷水 易溶于热水 可溶 易溶 易溶 乙醇中的溶解性 微溶 微溶 可溶 可溶 实验流程如下: C6H12O6溶液悬浊液Ca(C6H11O7)2 请回答下列问题: ⑴第①步中溴水氧化葡萄糖时,下列装置中最适合的是_B 。 制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是_C____。 A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液 C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液 ⑵第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率;便于后续分离;本实验中不宜用CaCl2替代CaCO3,理由是_氯化钙难以与葡萄糖酸直接反应得到葡萄糖酸钙_______。 ⑶第③步需趁热过滤,其原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品____。 ⑷第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出_。 ⑸第⑥步中,下列洗涤剂最合适的是D。 A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液 单纯的课本内容,并不能满足学生的需要,通过补充,达到内容的完善 教育之通病是教用脑的人不用手,不教用手的人用脑,所以一无所能。教育革命的对策是手脑联盟,结果是手与脑的力量都可以大到不可思议。查看更多