- 2021-05-13 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学总复习对对练考点12化学反应速率与化学平衡的综合应用
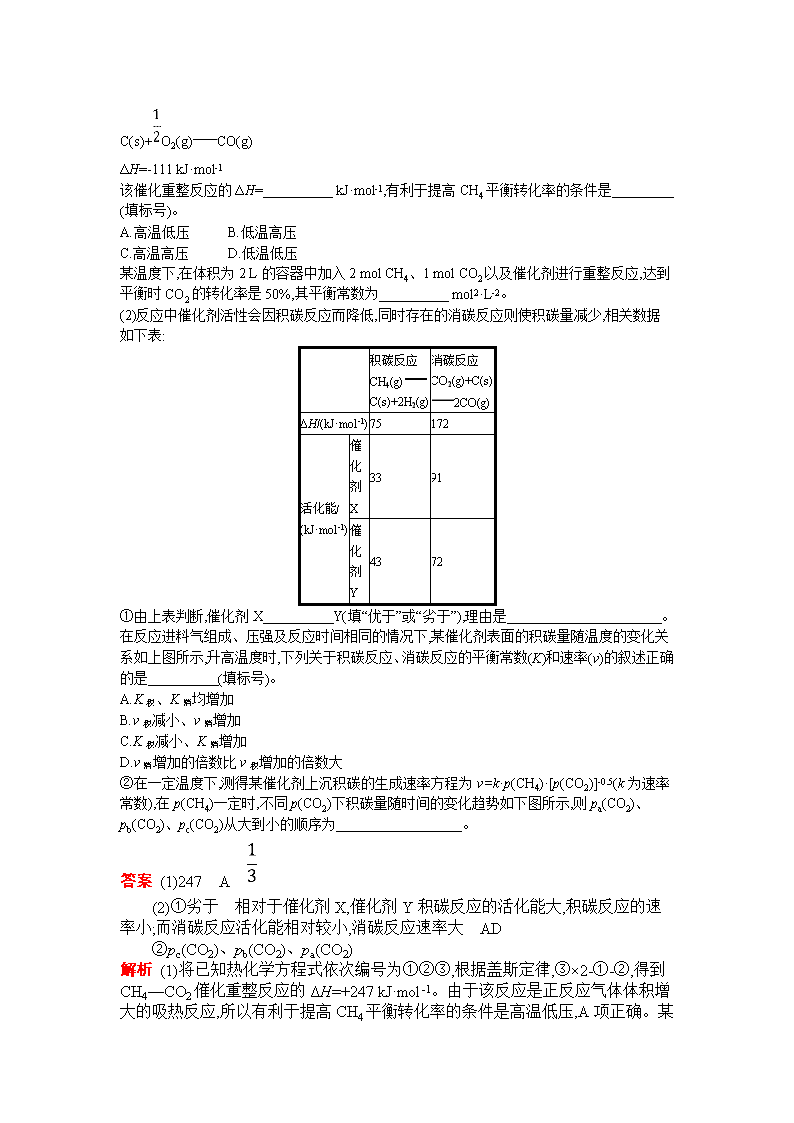
考点12 化学反应速率与化学平衡的综合应用 命题角度化学反应速率与化学平衡图像分析答案P24 高考真题体验·对方向 1.(2019四川·6)一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)。设起始=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如右图所示。下列说法正确的是( ) A.该反应的焓变ΔH>0 B.图中Z的大小为a>3>b C.图中X点对应的平衡混合物中=3 D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小 答案 A 解析 A项,随着温度的升高,φ(CH4)减小,说明升温平衡正向移动,正反应吸热,ΔH>0,正确;B项,=Z,Z越大,CH4转化率越大,CH4体积分数越小,则b>3>a,错误; C项, CH4 + H2O CO + 3H2 起始: a 3a 0 0 转化: x x x x 平衡: a-x 3a-x x x >3,错误; D项,加压平衡逆向移动,φ(CH4)增大,错误。 2.(2019全国Ⅱ·27)CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题: (1)CH4—CO2催化重整反应为:CH4(g)+CO2(g)2CO(g)+2H2(g)。 已知: C(s)+2H2(g)CH4(g) ΔH=-75 kJ·mol-1 C(s)+O2(g)CO2(g) ΔH=-394 kJ·mol-1 C(s)+O2(g)CO(g) ΔH=-111 kJ·mol-1 该催化重整反应的ΔH= kJ·mol-1,有利于提高CH4平衡转化率的条件是 (填标号)。 A.高温低压 B.低温高压 C.高温高压 D.低温低压 某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为 mol2·L-2。 (2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少,相关数据如下表: 积碳反应 CH4(g) C(s)+2H2(g) 消碳反应 CO2(g)+C(s) 2CO(g) ΔH/(kJ·mol-1) 75 172 活化能/ (kJ·mol-1) 催化剂X 33 91 催化剂Y 43 72 ①由上表判断,催化剂X Y(填“优于”或“劣于”),理由是 。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如上图所示,升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是 (填标号)。 A.K积、K消均增加 B.v积减小、v消增加 C.K积减小、K消增加 D.v消增加的倍数比v积增加的倍数大 ②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数),在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如下图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为 。 答案 (1)247 A (2)①劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对较小,消碳反应速率大 AD ②pc(CO2)、pb(CO2)、pa(CO2) 解析 (1)将已知热化学方程式依次编号为①②③,根据盖斯定律,③×2-①-②,得到CH4—CO2催化重整反应的ΔH=+247 kJ·mol-1。由于该反应是正反应气体体积增大的吸热反应,所以有利于提高CH4 平衡转化率的条件是高温低压,A项正确。某温度下,在体积为2 L的容器中加入2 mol CH4,1 mol CO2,达到平衡时CO2的转化率是50%,则平衡时各物质的物质的量浓度分别为c(CH4)=0.75 mol·L-1、c(CO2)=0.25 mol·L-1、c(CO)=0.5 mol·L-1、c(H2)=0.5 mol·L-1,根据K=,计算得出K=或0.33。 (2)①根据表格中活化能数据分析,催化剂X劣于催化剂Y。因为相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小,而消碳反应活化能相对较小,消碳反应速率大。由于积碳反应和消碳反应均为吸热反应,所以升高温度平衡正向移动,K积、K消均增加;温度高于600 ℃时,积碳量随温度的升高而下降,说明v消增加的倍数比v积增加的倍数大,A、D两项正确。 ②根据v=k·p(CH4)·[p(CO2)]-0.5,当p(CH4)一定时,积碳量随p(CO2)的增大而减小,故pc(CO2)>pb(CO2)>pa(CO2)。 3.(2019全国Ⅲ·28)三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题: (1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式 。 (2)SiHCl3在催化剂作用下发生反应: 2SiHCl3(g)SiH2Cl2(g)+SiCl4(g) ΔH1=48 kJ·mol-1 3SiH2Cl2(g)SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·mol-1 则反应4SiHCl3(g)SiH4(g)+3SiCl4(g)的ΔH为 kJ·mol-1。 (3)对于反应2SiHCl3(g)SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。 ①343 K时反应的平衡转化率α= %。平衡常数K343 K= (保留2位小数)。 ②在343 K下:要提高SiHCl3转化率,可采取的措施是 ;要缩短反应达到平衡的时间,可采取的措施有 、 。 ③比较a、b处反应速率大小:va vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正-k逆,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的= (保留1位小数)。 答案 (1)2SiHCl3+3H2O(HSiO)2O+6HCl (2)114 (3)①22 0.02 ②及时移去产物 改进催化剂 提高反应物压强(浓度) ③大于 1.3 解析 (1)SiHCl3与H2O反应生成(HSiO)2O为非氧化还原反应,由原子守恒配平:2SiHCl3+3H2O(HSiO)2O+6HCl。 (2)2SiHCl3(g)SiH2Cl2(g)+SiCl4(g) ΔH1=48 kJ·mol-1 ① 3SiH2Cl2(g)SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·mol-1 ② 根据盖斯定律:①×3+②即可得4SiHCl3(g)SiH4(g)+3SiCl4(g) ΔH=114 kJ·mol-1。 (3)①由图根据“先拐先平速率大”可知a曲线温度较高(343 K),平衡转化率为22%; 设SiHCl3起始物质的量为1 mol,则有 2SiHCl3(g)SiH2Cl2(g)+SiCl4(g) 起始物质 的量/mol 1 0 0 转化物质 的量/mol 0.22 0.11 0.11 平衡物质 的量/mol 0.78 0.11 0.11 平衡常数K343 K=≈0.02 ③a处反应相当于在b处反应的基础上升高温度,反应速率va大于vb; 达平衡时v正、v逆相等,k正=k逆 =K343 K=0.02 a处SiHCl3转化率为20%,设起始时SiHCl3物质的量为1 mol,则有: 2SiHCl3(g)SiH2Cl2(g)+SiCl4(g) 起始物质 的量/mol 1 0 0 转化物质 的量/mol 0.2 0.1 0.1 a点物质的 量/mol 0.8 0.1 0.1 此时SiHCl3、SiH2Cl2、SiCl4的物质的量分数分别为0.8、0.1、0.1, =1.28≈1.3。 4.(2019全国Ⅱ·27)丙烯腈(CH2CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2CHCHO)和乙腈(CH3CN)等。回答下列问题: (1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下: ①C3H6(g)+NH3(g)+O2(g)C3H3N(g)+3H2O(g) ΔH=-515 kJ·mol-1 ②C3H6(g)+O2(g)C3H4O(g)+H2O(g) ΔH=-353 kJ·mol-1 两个反应在热力学上趋势均很大,其原因是 ;有利于提高丙烯腈平衡产率的反应条件是 ;提高丙烯腈反应选择性的关键因素是 。 (2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460 ℃。低于460 ℃时,丙烯腈的产率 (填“是”或“不是”)对应温度下的平衡产率,判断理由是 ;高于460 ℃时,丙烯腈产率降低的可能原因是 (双选,填标号)。 A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D.反应活化能增大 图(a) 图(b) (3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为 ,理由是 。进料气氨、空气、丙烯的理论体积比约为 。 答案 (1)两个反应均为放热量大的反应 降低温度、降低压强 催化剂 (2)不是 该反应为放热反应,平衡产率应随温度升高而降低 AC (3)1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低 1∶7.5∶1 解析 (1)从反应的焓变可看出这两个反应都为放热反应,且“1 mol反应”放出的热量大,故两个反应在热力学上的趋势很大。由于生成丙烯腈的反应为气体体积增大的放热反应,故要提高丙烯腈的产率可采取的措施为降温、降压。提高丙烯腈反应选择性的关键因素是使用合适的催化剂。 (2)图(a)中,低于460 ℃时的曲线不表示丙烯腈的产率,因为合成丙烯腈的反应为放热反应,温度降低时,丙烯腈的产率应增大,而非减小。高于460 ℃时,丙烯腈产率降低的原因分析:催化剂活性降低,合成丙烯腈的反应速率减小,而副反应可能更多地发生,A项符合题意;平衡常数增大,丙烯腈的产率增大,B项不符合题意;副反应增多,可能导致丙烯腈产率降低,C项符合题意;反应活化能增大,并不影响平衡的移动,不会导致丙烯腈的产率变化,D项不符合题意。 (3)由图(b)可知,当n(氨)/n(丙烯)在1.0左右时丙烯腈的产率达最大值,而副产物丙烯醛的产率达最小值。由反应①知,V(NH3)∶V(O2)∶V(C3H6)=2∶3∶2,而V(O2)∶V(空气)≈1∶5,则进料气的理论体积比约为V(NH3)∶V(空气)∶V(C3H6)=2∶15∶2,即1∶7.5∶1。 5.(1)[2019全国Ⅰ·28(4)]Bodensteins研究了下列反应: 2HI(g)H2(g)+I2(g) 在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表: t/min 0 20 40 60 80 120 x(HI) 1 0.91 0.85 0.815 0.795 0.784 x(HI) 0 0.60 0.73 0.773 0.780 0.784 ①根据上述实验结果,该反应的平衡常数K的计算式为 。 ②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 (以K和k正表示)。若k正=0.002 7 min-1,在t=40 min时,v正= min-1。 ③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为 (填字母)。 (2)(2019全国Ⅱ·26)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。 回答下列问题: ①反应的ΔH 0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为 mol·L-1·s-1;反应的平衡常数K1为 。 ②100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。 a:T 100 ℃(填“大于”或“小于”),判断理由是 。 b:列式计算温度T时反应的平衡常数K2 。 ③温度T时反应达平衡后,将反应容器的容积减少一半。平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。 答案 (1)① ② 1.95×10-3 ③AE (2)①大于 0.001 0 0.36 mol·L-1 ②a:大于 反应正方向吸热,反应向吸热方向进行,故温度升高 b:平衡时,c(NO2)=0.120 mol·L-1+0.002 0 mol·L-1·s-1×10 s×2=0.16 mol·L-1 c(N2O4)=0.040 mol·L-1-0.002 0 mol·L-1·s-1×10 s=0.020 mol·L-1 K2==1.3 mol·L-1 ③逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动 解析 (1)①由表中数据可知120 min时反应达到平衡,根据反应可知:x(HI)=0.784,x(H2)=x(I2)=0.108,将数据代入平衡常数表达式:K=。 ②因为v逆=k逆x(H2)x(I2),则k逆=(因为平衡状态时v逆=v正),k逆=。 在t=40 min时,由表中数据可知x(HI)=0.85,若k正=0.002 7 min-1,代入公式:v正=k正x2(HI)= 0.002 7 min-1×0.852=1.95×10-3。 ③升高温度,平衡:2HI(g)H2(g) + I2(g) ΔH=+11 kJ·mol-1向正向移动,且正、逆速率均增大,x(HI)减小,x(H2)增大;故x(HI)对应的平衡点为A点;x(H2)对应的平衡点为E点。 (2)①随温度升高气体颜色变深,正向为吸热反应,ΔH>0;v(N2O4)==0.001 0 mol·L-1·s-1;K1= =0.36 mol·L-1。②a:改变温度后,N2O4浓度减小,反应正向进行,正向吸热,故温度升高。b:平衡时,c(NO2)=0.120 mol·L-1+0.002 mol·L-1·s-1×10 s×2=0.16 mol·L-1 c(N2O4)=0.040 mol·L-1-0.002 0 mol·L-1·s-1×10 s=0.020 mol·L-1 K2==1.3 mol·L-1。 ③增大压强,平衡向气体分子数减小的方向进行,将反应容器的体积减小一半,相当于增大压强,故平衡向逆反应方向进行。 化学反应速率和化学平衡图像题解法思路 1.两个原则 (1)先拐先平。例如,在转化率—时间图像上,先出现拐点的曲线先达到平衡,此时逆向推理可得该曲线对应的温度高、浓度大或压强大。 (2)定一议二。当图像中有三个量时,先确定一个量不变再讨论另外两个量的关系。 2.三个步骤 看图像→一看面(纵坐标与横坐标的意义) 二看线(线的走向和变化趋势) 三看点(起点、拐点、终点) 四看辅助线(如等温线、等压线、平衡线) 五看量的变化(如浓度变化、温度变化) 想规律→联想外界条件的改变对化学 反应速率和化学平衡的影响 作判断→根据图像中呈现的关系与所学规律 相对比,做出符合题目要求的判断 新题演练提能·刷高分 1.(2019北大附中郑州分校第一次质检)一定条件下向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体,图甲表示各物质的物质的量浓度随时间的变化,图乙表示反应速率随时间的变化,t2、t3、t4、t5时刻后各改变一种条件。若t4时刻改变条件是压强,则下列说法错误的是( ) A.若t1=15 s,则前15 s的平均反应速率v(C)=0.004 mol·L-1·s-1 B.该反应的化学方程式为3A(g)B(g)+2C(g) C.t2、t3、t5时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度 D.B的起始物质的量为0.04 mol 答案 C 解析 由题图甲可知,15 s内c(C)由0.05 mol·L-1升高到0.11 mol·L-1,则有v(C)= =0.004 mol·L-1·s-1,A正确。由题图甲可知,t1时刻达到平衡状态时,Δc(A)、Δc(C)分别为0.09 mol·L-1、0.06 mol·L-1,则A、C的化学计量数之比为3∶2;由题图乙可知,t4 时刻改变压强,正、逆反应速率同等程度变化,说明反应前后气体总分子数相等,从而推知该反应为3A(g)B(g)+2C(g),B正确。t2时刻正、逆反应速率均增大,可能是升高温度;t3时刻正、逆反应速率均同等程度增大,可能是加入了催化剂;t5时刻正、逆反应速率均增大,不可能是仅增大反应物浓度引起的,C错误。起始时加入0.1 mol C,此时c(C)=0.05 mol·L-1,则容器容积为=2 L;由题图甲可知,反应中消耗0.09 mol·L-1 A,则生成0.03 mol·L-1 B,故B的起始物质的量为0.05 mol·L-1×2 L-0.03 mol·L-1×2 L=0.04 mol,D正确。 2.(2019辽宁鞍山高三下月考)乙硼烷(B2H6)、甲烷(CH4)、甲醇(CH3OH)、二甲醚(CH3OCH3)在化学工业上有广泛的用途。 请回答下列问题: (1)乙硼烷与氧气反应的热化学方程式为B2H6(g)+3O2(g)B2O3(s)+3H2O(g) ΔH=-2 033.8 kJ· mol-1。乙硼烷有望成为导弹和火箭燃料的主要原因是 (2)我国科学家以甲烷为原料,在催化剂作用下进一步高效生产重要化工原料苯,反应过程中碳原子的利用率为100%,写出该反应的化学方程式: ,该反应的原子利用率为 。 (3)甲醇合成反应:CO(g)+2H2(g)CH3OH(g) ΔH1=-90.1 kJ· mol-1,一定温度时,该反应的平衡常数Kp=4.80×10-2,向容器中充入2 mol H2和1 mol CO,反应达到平衡状态时,甲醇的分压p(CH3OH)=24.0 kPa,则平衡时,混合气体中CH3OH的物质的量分数约为 (Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数)。 (4)二甲醚合成反应: Ⅰ.2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ· mol-1 Ⅱ.2CH3OH(g)C2H4(g)+2H2O(g) ΔH3=-29.1 kJ· mol-1 二甲醚合成反应过程中两反应的能量变化如图所示。 ①反应速率较大的是 (填“Ⅰ”或“Ⅱ”),原因是 。 ②若在容器中加入催化剂,则E2-E1将 (填“变大”“不变”或“变小”)。 (5)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响: 。 答案 (1)乙硼烷的摩尔质量较小且燃烧放出大量的热 (2)6CH4C6H6+9H2 81.25% (3)61.5% (4)①Ⅰ 反应Ⅰ的活化能低,在相同条件下反应速率较大 ②不变 (5)2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH=-204.1 kJ· mol-1 该反应的正反应为气体总分子数减小的反应,压强升高使平衡右移,CO和H2的转化率升高,CH3OCH3的产率增加;压强升高使CO和H2的浓度增加,反应速率增大 解析 (1)分析题给热化学方程式可知,乙硼烷的摩尔质量较小(28 g· mol-1),且燃烧时放出大量的热[1 mol B2H6(g)完全反应时放出2 033.8 kJ热量],因此乙硼烷有望成为导弹和火箭的燃料。 (2)利用甲烷(CH4)为原料,在催化剂作用下生产苯,反应过程中碳原子的利用率为100%,结合原子守恒推知,反应中还产生H2,化学方程式为6CH4C6H6+9H2,该反应的原子利用率为×100%=81.25%。 (3)起始时充入2 mol H2和1 mol CO,设开始时H2的压强为2p kPa,CO的压强为p kPa,则有 CO(g) + 2H2(g)CH3OH(g) 起始量/kPa p 2p 0 转化量/kPa 24.0 48.0 24.0 平衡量/kPa p-24.0 2p-48.0 24.0 该温度下平衡常数Kp==4.80×10-2,解得p=29.0,则平衡时,混合气体中CH3OH的物质的量分数为×100%=×100%≈61.5%。 (4)①由二甲醚合成反应的能量变化图可知,反应Ⅰ的活化能低于反应Ⅱ的活化能,而在其他条件相同时,反应的活化能越低,反应速率越大,故反应Ⅰ的速率较大。 ②使用催化剂能降低反应的活化能,从而加快反应速率,但不能改变化学反应的反应热,故加入催化剂,E2-E1的值不变。 (5)将热化学方程式CO(g)+2H2(g)CH3OH(g) ΔH1=-90.1 kJ· mol-1编号为Ⅲ,根据盖斯定律,由Ⅲ×2+Ⅰ可得:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g),则有ΔH=2×(-90.1 kJ· mol-1)+(-23.9 kJ· mol-1)=-204.1 kJ· mol-1。该反应的正反应为气体总分子数减小的放热反应,增大压强,平衡正向移动,H2和CO的转化率升高,二甲醚的产率增加。 3.(2019山东烟台一中高三下4月月考)CO2是造成温室效应的废气,研究二氧化碳的利用具有十分重要的意义。CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH=-127.8 kJ·mol-1。请回答: (1)已知:H2的燃烧热是285.8 kJ·mol-1,且H2O(g)H2O(l) ΔH=-44.0 kJ·mol-1,则表示C2H4燃烧热的热化学方程式为 (2)图1、图2分别是CO2的平衡转化率(α)随压强及温度的变化关系,已知Z为起始时的投料比,即Z=。 图1 图2 ①图1中投料比相同,温度从低到高的顺序为 。 ②图2中Z1、Z2、Z3投料比从大到小的顺序为 ,理由是 。 ③若要进一步提高CO2的平衡转化率,除了可以适当改变反应温度外,还可以采取的措施有 。(任写一种) (3)若图2中Z1=2.5,在温度为680 K、体积为2 L的恒容密闭容器中,充入1 mol H2和0.4 mol CO2,10 min后达到平衡状态。 ①从反应开始到恰好达到平衡时,H2的平均反应速率v(H2)= 。 ②680 K时,反应的平衡常数K= 。 (4)在催化剂M的作用下,CO2和H2同时发生下列两个反应: ①2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ②2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH<0 右图是乙烯在相同时间内,不同温度下的产率,则高于T ℃时乙烯产率降低的原因可能是 。 A.催化剂M的活性降低 B.①反应的平衡常数变大 C.②反应的活化能增大 D.生成甲醚的量增加 答案 (1)C2H4(g)+3O2(g)2H2O(l)+2CO2(g) ΔH=-1 411.0 kJ·mol-1 (2)①T1查看更多