- 2021-05-13 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考能力测试步步高化学基础训练
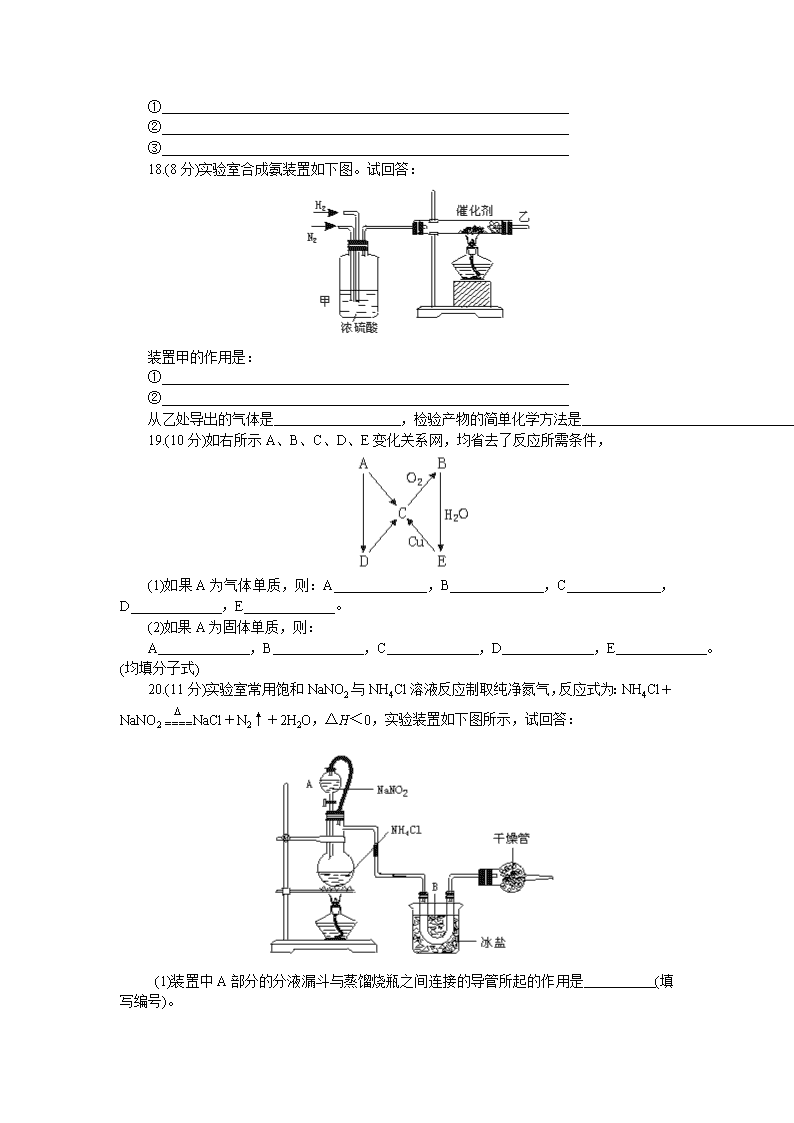
高考能力测试步步高化学基础训练21 基础训练21 氮和磷 (时间60分钟,赋分100分) ●训练指要 氮族元素性质的相似性和递变规律;氮气的分子结构及其化学性质;磷的两种同素异形体的有关性质。 一、选择题(每小题3分,共45分) 1.(2001年全国高考题)有一种磷的结构式是 有关它的下列 叙述中不正确的是 A.它完全燃烧时的产物是P2O5 B.它不溶于水 C.它在常温下呈固态 D.它与白磷互为同分异构体 2.下列反应起了氮的固定作用的是 A.N2与H2在一定条件下反应生成NH3 B.NH3经催化氧化生成NO C.NO与O2反应生成NO2 D.由NH3制碳铵和尿素 3.关于氮族元素的性质,下列推断错误的是 A.最高价氧化物为R2O5,其水化物化学式为HRO3或H3RO4 B.非金属性:磷>砷,气态氢化物的还原性:PH3>AsH3 C.最高价含氧酸的酸性:硒酸>砷酸>锗酸 D.所形成的氢化物中BiH3最不稳定 4.下列比较中正确的是 A.硝酸酸性比磷酸强 B.PH3的稳定性大于NH3 C.PH3的还原性大于NH3 D.氮气的化学性质比磷活泼 5.新电灯泡的玻璃柱上涂有一点暗红色物质,以除去灯泡内残留的氧,该物质是 A.Cu2O B.Fe2O3 C.红磷 D.铜粉 6.红磷和白磷在一定条件下可以相互转化,这一变化属于 A.物理变化 B.化学变化 C.氧化还原反应 D.分解反应 7.在两密闭容器中分别盛有31 g白磷和1 mol氧气,控制条件使其发生反应,容器甲:P4+5O2===P4O10,容器乙:P4+3O2===P4O6,经充分反应后,两容器中分别所得的P4O10和P4O6的物质的量的比为 A.5∶4 B.4∶5 C.4∶3 D.3∶5 8.将(NH4)2CO3加热全部气化后,将气体先通过Na2O2,固体质量增加x g,再通过浓H2SO4,溶液质量增加y g;若先通过浓H2SO4,溶液增重z g,再通过Na2O2,固体质量增加w g,则x、y、z、w的质量大小排列顺序正确的是 A.x>y>z>w B.w>z>y>x C.y=z>x=w D.z>y>x>w 9.在一定温度和压强下,将一支容积为15 mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管内液面上升至一定高度不再变化时,在相同条件下再通入O2,若要使试管内的液面仍保持在原高度,则通入O2的体积为 A.3.75 mL B.7.5 mL C.8.75 mL D.10.5 mL 10.在下列反应中,氨作氧化剂的是 A.8NH3+3Br2===6NH4Br+N2 B.2NH3+H2S===(NH4)2S C.2NH3+2Na===2NaNH2+H2 D.NH3+NaH===NaNH2+H2 11.下列关于磷及其化合物的叙述不正确的是 A.红磷用于制造安全火柴、农药和燃烧弹 B.磷酸二氢盐都易溶于水 C.磷酸是三元酸,比硝酸的酸性强 D.P2O5溶于热水生成磷酸,溶于冷水生成偏磷酸 12.下列制氮气的方法中,不合理的是 A.分离液态空气 B.加热使NH3分解 C.将空气通过足量灼热的铜网 D.将空气通过加热的镁粉 13.把等质量的镁分别放在下列气体中完全燃烧:①纯O2中,②空气中,③CO2中, ④Cl2中,⑤N2中,得到固体物质的质量分别为:m1、m2、m3、m4、m5,其由大到小的关系正确的是 A.①②③⑤④ B.④③①②⑤ C.④③②①⑤ D.④①③②⑤ 14.关于磷的下列叙述中,正确的是 ①红磷没有毒性而白磷剧毒 ②白磷在空气中加热到260℃可转化为红磷 ③少量白磷保存于水中 ④红磷可升华,且转化为白磷时属化学变化 ⑤白磷和红磷都可溶于CS2 ⑥白磷为非金属单质,其晶体为正四面体型的原子晶体 A.①②③ B.②③④ C.①③④ D.③⑤⑥ 15.为了测知红磷在氯气中燃烧的产物,可以根据它的质量增加来确定。现有红磷31 g,在氯气中燃烧其质量增加150 g,由此可判断这个反应中,红磷燃烧的产物是 A.只有PCl3 B.只有PCl5 C. PCl3和PCl5 D.无法确定 二、非选择题(共55分) 16.(8分)第ⅤA族某元素的单质15.5 g在空气中充分燃烧生成最高价氧化物。其质量比原单质质量增加20 g。该元素是 ,此元素原子结构示意图为 。 17.(9分)雷雨时,从天空落下的雨水中常含有少量硝酸,其原因是(用化学方程式表示): ① ② ③ 18.(8分)实验室合成氨装置如下图。试回答: 装置甲的作用是: ① ② 从乙处导出的气体是 ,检验产物的简单化学方法是 。 19.(10分)如右所示A、B、C、D、E变化关系网,均省去了反应所需条件, (1)如果A为气体单质,则:A ,B ,C ,D ,E 。 (2)如果A为固体单质,则: A ,B ,C ,D ,E 。(均填分子式) 20.(11分)实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,反应式为:NH4Cl+NaNO2NaCl+N2↑+2H2O,ΔH<0,实验装置如下图所示,试回答: (1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是 (填写编号)。 a.防止NaNO2饱和溶液蒸发 b.保证实验装置不漏气 c.使NaNO2饱和溶液容易滴下 (2)B部分的作用是 。 a.冷凝 b.冷却氮气 c.缓冲氮气流 (3)加热前必须进行的一个操作步骤是 ;加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 。 (4)收集N2前,必须进行的操作步骤是(用文字说明) 。收集N2最适宜的方法是(填写编号) 。 a.用排气法收集在集气瓶中 b.用排水法收集在集气瓶中 c.直接收集在球胆或塑料袋中 21.(9分)实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置(烧瓶内加入稀硝酸和铜片,必要时可加热)。实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。 (1)用Ⅰ装置做实验时,用排水法收集到的气体的颜色为 色;实验过程中由于观察到 现象,而不能有力证明反应产物是NO。 (2)用Ⅱ装置做实验时,将有关操作补充完全: ①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到 为止。 ②关闭活塞,用酒精灯在U形管的A侧加热,当 时,立即撤去酒精灯。 (3)回答下列问题: ①反应在什么情况下可以自动停止?可在何处观察到无色的NO气体? ②如果再将分液漏斗的活塞慢慢打开,可立即观察到哪些明显现象? 高考能力测试步步高化学基础训练21答案 一、1.D 2.解析:氮的固定是把单质氮转变成化合物的氮的过程。 答案:A 3.B 4.AC 5.解析:反应消耗灯泡内少许氧气。 答案:C 6.B 7.解析:依反应方程式进行过量与适量的判断后计算。 答案:B 8.D 9.C 10.CD 11.C 12.BD 13.解析:用差量法求解比较方便,但注意2Mg+CO2===2MgO+C,固体物质是两部分。 答案:B 14.C 15.C 17.①N2+O22NO ②2NO+O2===2NO2 ③3NO2+H2O===2HNO3+NO↑ 18.①干燥气体 ②使两种气体充分混合,并通过观察气泡以调节氢气、氮气流速 NH3及N2和H2的混合物 用湿润的红色石蕊试纸检验气体,试纸变蓝(或其他合理方法) 19.(1)N2 NO2 NO NH3 HNO3 (2)S SO3 SO2 H2S H2SO4 20.(1)c (2)a (3)检查装置的气密性 本反应为放热反应 (4)将系统内空气排尽 c 21.(1)无 烧瓶内有红棕色气体 (2)①单孔塞下沿与液面间不留有空隙(无气泡存在) ②铜丝上有气泡产生 (3)①当产生的NO气体将稀HNO3排入U型管B侧管内使铜丝网与稀HNO3脱离后反应会立即停止;在U型管A侧管中可观察到无色的NO气体。②U型管的B侧管中的稀HNO3又回到A侧管内,分液漏斗中有红棕色气体出现。查看更多