- 2021-05-13 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学反应及其能量高考化学一轮复习化学反应及其能量变化1氧化还原反应
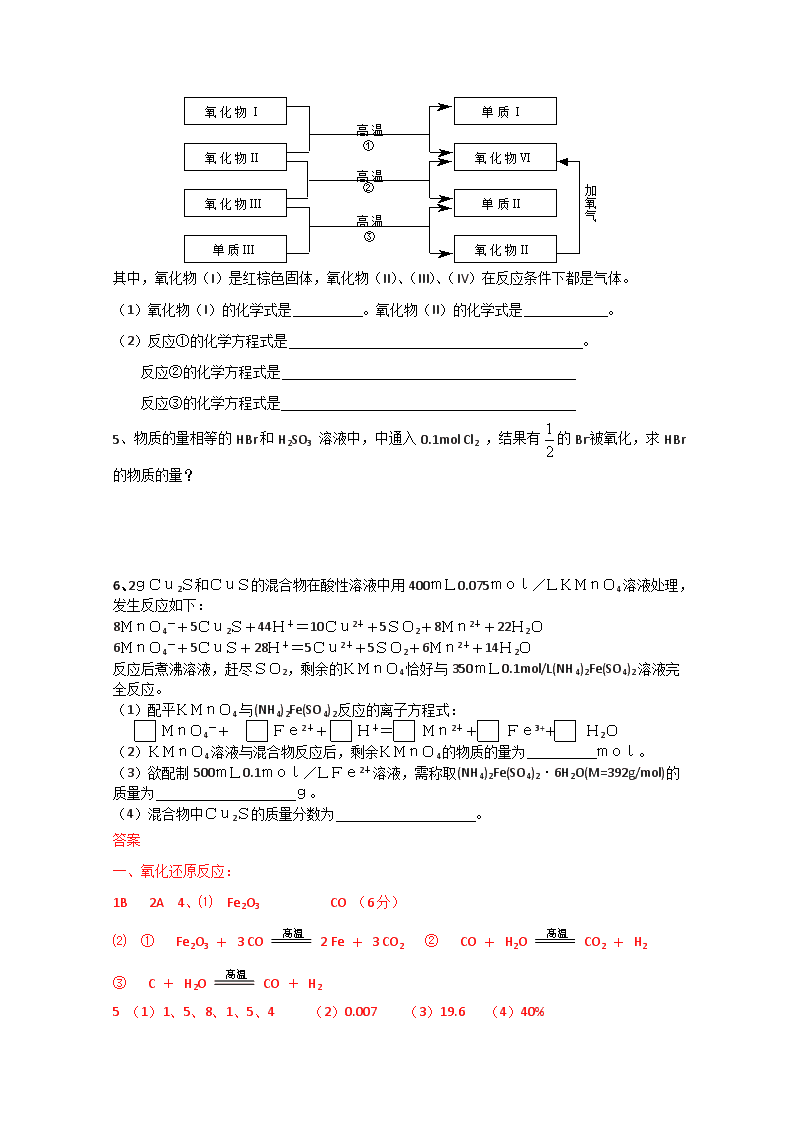
第一章 1 氧化还原反应 1.氧化还原反应基本概念:结合特例以价态为题眼展开 2.氧化还原反应的规律: (1)“强强生弱弱”规律。 (2)强弱律: ①先强后弱规律:例:FeI2溶液中滴加氯水 ②易得难失: (3)同种元素不同价态间转移电子时, “归中不交叉”。 得5e- 得6e- ① KClO3+6HCl==KCl+3Cl2↑+3H2O ② KClO3+6HCl==KCl+3Cl2↑+3H2O 失5e- 失6e- 判断上述双线桥对错? 3.氧化还原反应中电子转移的两种“线桥”表示方法 (1)双线桥表示法: (2)单线桥表示法: 2eˉ 4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O ; 2Na2O2 + 2H2O = 4.物质的氧化性、还原性 (1)物质氧化性和还原性的比较途径: ① 根据一个已知的氧化还原反应判断(电解反应除外): 强 → 弱 ② 根据反应效果判断 例如,氯气跟铁反应,硫跟铁反应时→可见 的氧化性比 强。 ③根据反应条件(实质是难易程度)判断 ④ 根据金属活动性顺序比较: 位置靠前的金属,单质 性较强,其离子的 较弱,非金属活动性顺序反之。 (注:Fe2+符合原序,Fe3+氧化性强过Cu2+) ⑤ 根据元素所在周期表位置关系比较: 同主族: 同周期: (非金属性属于 性,其阴离子 性;金属性反之。) ⑥ 根据原电池和电解池电极的极别或发生的反应判断: A: 原电池被腐蚀的一极是 性较强的 极; 冒气体(H2)或质量增加的极是 极,该金属还原性比负极金属 。 B: 电解反应中,遵照 原则。 5.氧化还原反应方程式的配平 (1)基本依据是 守恒和 守恒。 (2)基准物质配平: 6.应用电子守恒规律解计算题 :“电子得失守恒” “电荷数守恒”等. 例:ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( ) A 1:1 B 2:1 C 1:2 D 2:3 练习 1、已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2 → H2O IO3- → I2 MnO4- → Mn2+ HNO3 → NO如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是: A. H2O2 B. IO3- C. MnO4- D. HNO3 2、3物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质: ①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液 由于浓度不同而能发生不同氧化还原反应的是 A.①③ B.③④ C.①② D.①③④ 3、已知I-、Fe2+、SO2、Cl-、H2O2都有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-查看更多
相关文章
- 当前文档收益归属上传用户