- 2021-05-13 发布 |
- 37.5 KB |
- 3页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
氮和硫高考真题及各地模拟题
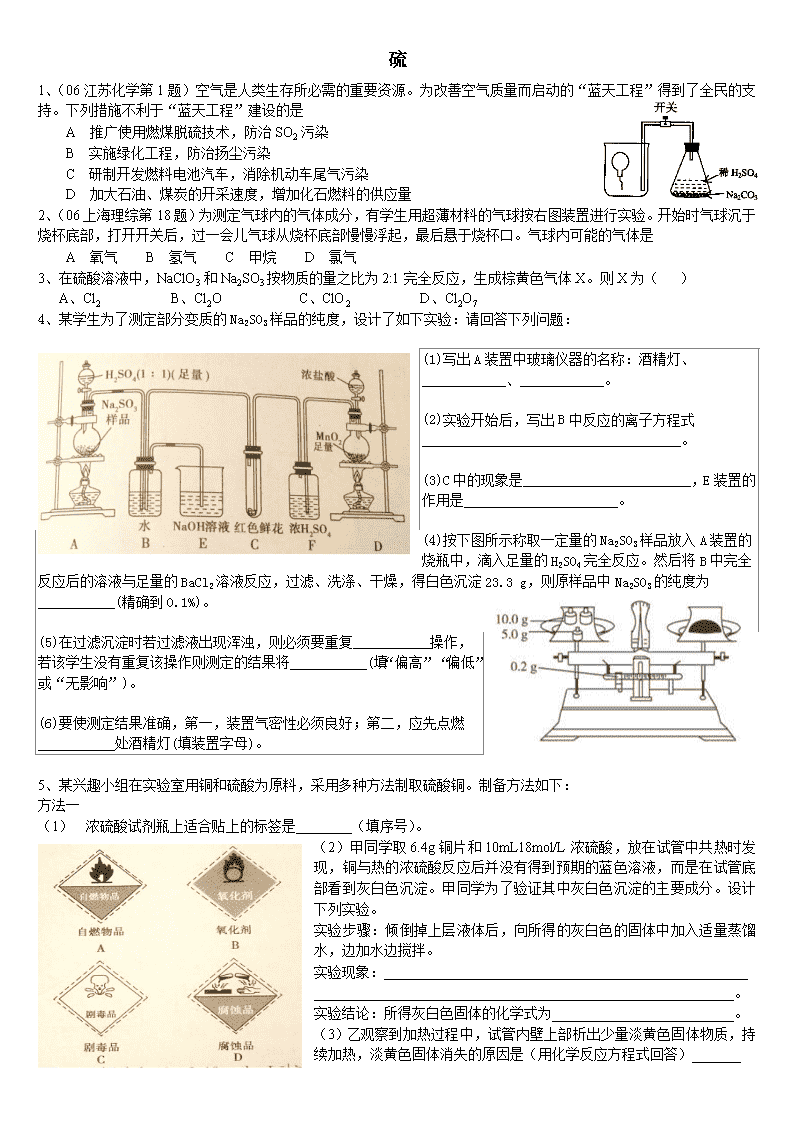
硫 1、(06江苏化学第1题)空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是 A 推广使用燃煤脱硫技术,防治SO2污染 B 实施绿化工程,防治扬尘污染 C 研制开发燃料电池汽车,消除机动车尾气污染 D 加大石油、煤炭的开采速度,增加化石燃料的供应量 2、(06上海理综第18题)为测定气球内的气体成分,有学生用超薄材料的气球按右图装置进行实验。开始时气球沉于烧杯底部,打开开关后,过一会儿气球从烧杯底部慢慢浮起,最后悬于烧杯口。气球内可能的气体是 A 氧气 B 氢气 C 甲烷 D 氯气 3、在硫酸溶液中,NaClO3和Na2SO3按物质的量之比为2:1完全反应,生成棕黄色气体X。则X为( ) A、Cl2 B、Cl2O C、ClO2 D、Cl2O7 4、某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验:请回答下列问题: (1)写出A装置中玻璃仪器的名称:酒精灯、____________、____________。 (2)实验开始后,写出B中反应的离子方程式_____________________________________。 (3)C中的现象是________________________,E装置的作用是______________________。 (4)按下图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应。然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3 g,则原样品中Na2SO3的纯度为___________(精确到0.1%)。 (5)在过滤沉淀时若过滤液出现浑浊,则必须要重复___________操作,若该学生没有重复该操作则测定的结果将___________(填“偏高”“偏低”或“无影响”)。 (6)要使测定结果准确,第一,装置气密性必须良好;第二,应先点燃___________处酒精灯(填装置字母)。 5、某兴趣小组在实验室用铜和硫酸为原料,采用多种方法制取硫酸铜。制备方法如下: 方法一 (1) 浓硫酸试剂瓶上适合贴上的标签是________(填序号)。 (2)甲同学取6.4g铜片和10mL18mol/L浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲同学为了验证其中灰白色沉淀的主要成分。设计下列实验。 实验步骤:倾倒掉上层液体后,向所得的灰白色的固体中加入适量蒸馏水,边加水边搅拌。 实验现象:____________________________________________________ ____________________________________________________________。 实验结论:所得灰白色固体的化学式为__________________________。 (3)乙观察到加热过程中,试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体消失的原因是(用化学反应方程式回答)_______ __________________________________________________。直到最后反应完毕,发现试管中还有铜片剩余。乙根据自己所学的化学知识,认为试管中还有硫酸剩余。他这样认为的理由是________________________。 方法二 加热 (4)丙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O2==2CuO,CuO+H2SO4==CuSO4+H2O。对比甲的方案,你认为丙同学的优点是 1)_______________________________________________;2)______________________________________________。 方法三 (5)丁同学取一铜片和稀硫酸放在试管中,再向其中滴加双氧水,发现溶液逐渐呈蓝色。写出反应的化学反应方程式: ____________________________________________。 氮 1、实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。则 (1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为:________________________。 (2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:_____________。上述现象说明溶液中________结合OH-的能力比_________强(填离子符号)。 (3)B与A的差值为:___________mol。 (4)B点对应的沉淀量为:__________mol,C点对应的溶液体积为:_________mL。 2、氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答: (1)实验室制取氨气的化学方程式是 。 (2)①右图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是 。 ②氨气使烧杯中溶液由无色变为红色,其原因是_______________________________(用电离方程式表示)。 (3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。 ① 实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式 。 ② 碱石灰的作用是 。 ③该装置存在明显缺陷,请指出存在的问题并提出改进意见 。 (4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+Cu + Cu2+)。 请你设计一个简单的实验检验该红色物质中是否含Cu2O。 ; (5)工业废气中的氮氧化物是主要的大气污染物之一。为了治理污染,工业上常用氨气与之发生反应:NOx+NH3→N2+H2O,使其转化为无毒的N2 。现有NO2和NO的混合气体3.0 L,跟3.4 L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2与NO的体积比是__________。查看更多