- 2021-05-13 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学专题复习 物质的量
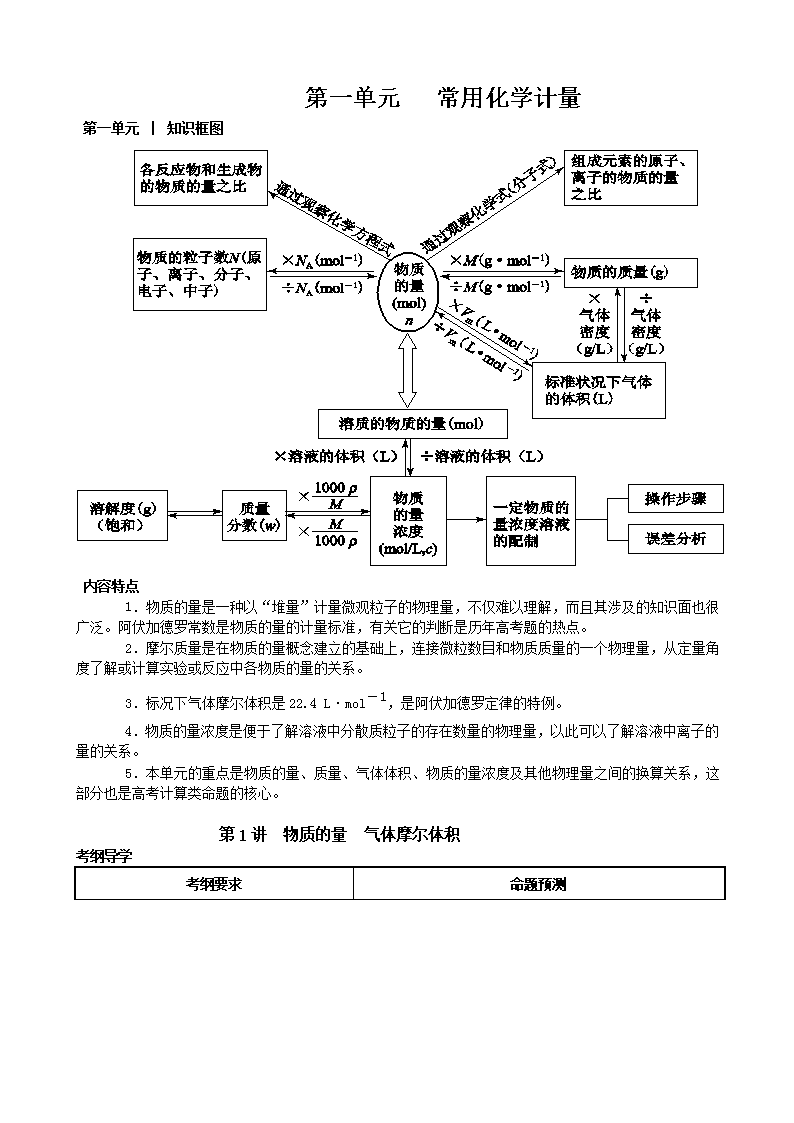
第一单元 常用化学计量 第一单元 │ 知识框图 内容特点 1.物质的量是一种以“堆量”计量微观粒子的物理量,不仅难以理解,而且其涉及的知识面也很广泛。阿伏加德罗常数是物质的量的计量标准,有关它的判断是历年高考题的热点。 2.摩尔质量是在物质的量概念建立的基础上,连接微粒数目和物质质量的一个物理量,从定量角度了解或计算实验或反应中各物质的量的关系。 3.标况下气体摩尔体积是22.4 L·mol-1,是阿伏加德罗定律的特例。 4.物质的量浓度是便于了解溶液中分散质粒子的存在数量的物理量,以此可以了解溶液中离子的量的关系。 5.本单元的重点是物质的量、质量、气体体积、物质的量浓度及其他物理量之间的换算关系,这部分也是高考计算类命题的核心。 第1讲 物质的量 气体摩尔体积 考纲导学 考纲要求 命题预测 1.了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积、阿伏加德罗常数的含义。 2.能根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。 3.能正确书写化学方程式和离子方程式,并能进行有关计算。 1.阿伏加德罗常数正误判断。本考点通常与基本概念、基本理论、元素化合物知识、物质结构等结合起来考查,考查形式为选择题,难度中等。 2.气体摩尔体积、阿伏加德罗定律及其推论。该考点主要是在题干信息的理解中出现,或与阿伏加德罗常数的考查联系在一起,难度较小。 3.物质的量在方程式运算中的应用。一般涉及“技巧计算”。该考点通常为选择题或综合题中定量型的填空题,难度较大。 要点探究 探究点一 物质的量 摩尔质量 【知识梳理】 一、物质的量 1.物质的量:物质的量是一个表示含有____________粒子集合体的物理量,它的符号是___,物质的量的单位是摩尔(简称摩,符号是_____ )。物质的量适用于微观粒子,如原子、分子、_______、________、电子、质子、中子等。 2.阿伏加德罗常数:国际上规定,1 mol粒子所含的粒子数与0.012 kg 12C中所含的碳原子数相同,符号为________,通常用 _____________________表示。 3.关系式:物质所含粒子数目(N)、物质的量(n)、阿伏加德罗常数(NA)三者之间的关系式:_______。 二、摩尔质量 单位物质的量的物质所具有的质量叫____________。符号为____,单位为__________ (或_______)。表达式:M=____。摩尔质量单位为g/mol时,在数值上与物质的________________ ____________ 相等。 【要点深化】 1.洞悉阿伏加德罗常数的误区 (1)状况条件 在对气体的体积与物质的量关系考查时,题目经常给出非标准状况,如常温常压下或不指明温度和压强等,要特别注意。 (2)物质状态 考查气体摩尔体积时,常结合在标准状况下非气态的物质,如H2O、SO3、己烷、辛烷、CHCl3等。SO3标准状况下为固态。 (3)物质结构 考查一定物质的量的物质中含有多少粒子(分子、原子、电子、质子、中子、离子等),常涉及稀有气体He、Ne等单原子分子,Cl2、N2、O2、H2等双原子分子及O2、18O2、D2O、Na2O2等特殊物质,也会考查一些物质中的化学键数目,如Si、CH4、P4、CO2、Na2O2等。 (4)氧化还原反应 考查指定物质参加氧化还原反应时,常设置氧化还原反应中氧化剂、还原剂、氧化产物、还原产物、被氧化、被还原、电子转移(得失)数目方面的陷阱。如Na2O2与H2O的反应,Cl2与NaOH的反应,电解AgNO3溶液等。 (5)弱电解质的电离或盐类的水解 考查电解质溶液中粒子数目及粒子浓度大小关系时,常涉及弱电解质的电离平衡及盐类的水解平衡。如NH4Cl溶液中n(NH4+)<n(Cl-)。 2.计算摩尔质量的技巧 (1)利用质量和物质的量:M=。 (2)利用相对密度:==D,M1=M2·D。 (3)标准状况下:M=22.4ρ。 (4)混合气体平均相对分子质量的求法 ①对于任何状态的混合物,平均摩尔质量: = ②均相混合物的平均相对分子质量在数值上等于其平均摩尔质量,可由下式求得: r=M甲×甲的物质的量分数+M乙×乙的物质的量分数+…… ③对于混合气体还可用下式: r=M甲×甲的体积分数+M乙×乙的体积分数+…… 注意以下两点: ①应用“(1)(2)(3)”可进行气体质量、摩尔质量、标准状况密度、相对密度、气体体积、物质的量之间的换算。 ②应用“(4)”可进行气体平均摩尔质量、体积分数的计算和气体成分分析。 【典例精析】 例1 NA表示阿伏加德罗常数,下列叙述正确的是( ) A.等物质的量的N2和CO所含分子数均为NA B.1.7 g H2O2中含有的电子数为0.9NA C.1 mol Na2O2固体中含离子总数为4NA D.标准状况下,2.24 L戊烷所含分子数为0.1NA 变式训练 NA表示阿伏加德罗常数,下列判断正确的是( ) A.在18 g 18O2中含有NA个氧原子 B.标准状况下,22.4 L空气含有NA个单质分子 C.1 mol Cl2参加反应转移电子数一定为2NA D.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol·L-1 例2 某气体物质的质量为4.4 g,含有6.02×1022个分子,则气体( ) A.其相对分子质量为44 g·mol-1 B.一定是CO2 C.1 mol该气体的质量是44 g D.该气体的摩尔质量是44 变式训练 在一定的条件下,完全分解下列某化合物2 g,产生氧气1.6 g,此化合物是( ) A.1HO B.2HO C.1HO D.2HO 要点探究 探究点二 气体摩尔体积 阿伏加德罗定律 【知识梳理】 一、物质的量 1.影响物质体积的因素。影响物质体积的因素有________________、_________、____________。在粒子数目相同的情况下,固体、液体的体积大小主要由_______________决定,气体体积主要由_____________决定,而气体的粒子间距离又由_______和_______决定。 2.气体摩尔体积:一定温度和压强下,1 mol的气体所占的体积,符号为_____,单位为_____________________ ____________________。标准状况下(___℃、______kPa),气体摩尔体积约为______________。25 ℃和101 kPa时,气体摩尔体积约为_____________。物质的量和气体摩尔体积之间的关系为_________。 3.阿伏加德罗定律:在相同的温度和压强下,相同体积的_________都含有________________。 【要点深化】 1.全面理解标况下的气体摩尔体积 (1)标准状况:指0 ℃、1.01×105Pa 的状态。温度越高,体积越大;压强越大,体积越小。故在非标准状况下,气体摩尔体积不一定就是22.4 L·mol-1。但若同时增大压强,升高温度,或是降低压强和温度,1摩尔任何气体所占的体积有可能为22.4 L。 (2)1 mol气体在非标准状况下,其体积可能为22.4 L,也可能不为22.4 L。如在室温(20 ℃,一个大气压)的情况下1 mol气体的体积是24 L。 (3)气体分子间的平均距离比分子的直径大得多,因而气体体积主要决定于分子间的平均距离。在标准状况下,不同气体的分子间的平均距离几乎是相等的,所以任何气体在标准状况下的气体摩尔体积都约是22.4 L·mol-1。 (4)理解此概念时应注意: ①是气态物质; ②物质的量为1 mol; ③0 ℃和1.01×105Pa(标准状况); ④22.4 L体积是近似值; ⑤Vm的单位为L·mol-1或m3·mol-1。 (5)适用对象:纯净气体与混合气体均可 2.气体摩尔体积(标况)在计算中的应用 常用的物理量表示符号:气体体积V,物质的量n,质量m,摩尔质量M,密度ρ,式量Mr。 (1)据气体体积求其物质的量:n=; (2)据气体质量求其标况下的体积: V=×22.4 L·mol-1; (3)据气体摩尔质量求其标况下的密度: ρ=; (4)据气体标况下的体积求质量:m=; (5)据标况下气体的密度求式量:Mr=22.4 L·mol-1 ρ; (6)据气体标况下的溶解度,求饱和溶液的质量分数、物质的量浓度(具体算式略)。 相同条件 结 论 公式 语言叙述 T、p相同 = 同温、同压下,气体的体积与物质的量成正比 T、V相同 = 温度、体积相同的气体,压强与物质的量成正比 n、p相同 = 物质的量、压强相同的气体,其体积与温度成正比 3.阿伏加德罗定律的推论——两同定比例 相同条件 结 论 公式 语言叙述 n、T相同 = 物质的量相等、温度相同的气体,其压强与体积成反比 T、p相同 = 同温、同压下,气体的密度与其相对分子质量(或是摩尔质量,下同)成正比 T、p、V相同 = 同温、同压下,体积相同的气体,其相对分子质量与其质量成正比 T、p、m相同 = 同温、同压下,等质量的气体,其相对分子质量与其体积成反比 T、V、m相同 = 同温、同体积下,等质量的气体,其相对分子质量与其压强成反比 [说明] 以上所有推论均可由pV=nRT= RT或p=RT导出,不要机械记忆。 例3 在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是() A . p( Ne)、p(H2)、p(O2) B .p(O2)、p(Ne)、p(H2) C. p(H2)、p(O2)、p(Ne) D. p(H2)、p(Ne)、p(O2) 变式训练 在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( ) A.两种气体的压强相等 B.O2比O3的质量小 C.两种气体的分子数目相等 D.两种气体的氧原子数目相等 要点探究 ► 探究点三 物质的量应用于化学方程式的计算 【知识梳理】 1.化学方程式在量方面的含义 化学方程式可以明确地表示出化学反应中粒子之间的数目关系,即化学计量数之比等于反应中各物质的____________之比。 2.根据化学方程式计算需注意的问题 (1)化学方程式所表示的是纯净物之间的量的关系,所以不纯物质或不完全转化物质的质量只有换算成纯净物的质量,才能按化学方程式列出比例式进行计算。 (2)单位问题 一般说来,在一个题目里如果都用统一的单位,不会出现错误,但如果题内所给的两个量不一致,这时只要做到两个量及单位“________________________”即可,例如: MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑ 87 g 4 mol x g y mol (3)如果是离子反应,可以根据离子方程式进行计算。如果是氧化还原反应,也可以利用____________进行有关计算。 要点深化 1.物质的量应用于化学计算的原理 物质的量架起了宏观物质的量如质量、体积等与微观粒子数目之间的关系,尤其巧妙的是,利用0.012 kg12C中所含的碳原子数作为计量标准,与相对原子质量的计量标准——12C的质量统一在了一起,使得物质的摩尔质量在用g·mol-1做单位时在数值上等于其相对原子质量或相对分子质量,大大地方便了计算和计量。又由于物质的量与粒子的个数成正比,因此,利用化学方程式计算时各物质的化学计量数、各物质的粒子数、各物质的物质的量成正比,可以直接列在化学方程式中进行计算。 例如:4NH3+5O2=4NO+6H2O 化学计量数之比:4∶5∶4∶6 粒子(分子)数之比:4∶5∶4∶6 物质的量之比: 4∶5∶4∶6 2.根据方程式计算的基本步骤 (1)根据题意写出配平的化学方程式。 (2)求出已知物和未知物的物质的量(有时可用质量、体积等表示,分别写在化学方程式中有关的化学式下面)。 (3)把已知和待求的量[用m(B)、n(B)、V(B)或设未知数x、y等表示]分别写在化学方程式中有关化学式的下面。 (4)将有关的量列出比例式,求出待求的量。 【典例精析】 例4 臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O22O3。 (1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______g·mol-1(保留一位小数)。 (2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为________L。 (3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0 g铜粉的反应器中,充分加热后,粉末的质量变为21.6 g。求原混合气中臭氧的体积分数。 第2讲 物质的量浓度 考纲导学 考纲要求 命题预测 1.了解溶液的含义。 2.了解溶解度、饱和溶液的概念。 3.了解溶液的组成。理解溶液中溶质的质量分数的概念,并能进行有关计算。 4.了解配制一定溶质质量分数、物质的量浓度溶液的方法。 1.物质的量浓度相关计算。物质的量浓度在高考题中起到考查考生定量处理问题的能力,命题角度定位于技巧计算,主要是选择题形式,难度中等。 2.物质的量浓度溶液配制实验。该考点的考查多是在与化工生产等有关的非选择题中出现,主要形式是仪器选择、配制操作等,偶尔在选择题中也会出现误差分析的选择项,难度较小。 要点探究 探究点一 物质的量浓度及溶液配制 1.定义:以1 L溶液里所含溶质B的____________来表示溶液的浓度叫做物质的量浓度。符号为:___;单位为:_________。 2. 表达式:cB=__。(n为溶质B的物质的量,单位为____;V为溶液的体积,单位为___) 3.配制一定物质的量浓度溶液的主要仪器 (1)天平:应使用分析天平(或电子天平),可用__________代替。 (2)容量瓶 容量瓶的构造:容量瓶是一种细颈梨形平底的容量器,带有磨口玻璃塞,容量瓶上标有:______、______、_______。容量瓶是为配制准确的__________________的溶液用的精密仪器。实验中常用的是________、________和________的容量瓶。 ___ 容量瓶的使用注意事项: ①使用之前要检查是否漏水。在瓶中加入适量蒸馏水,塞紧瓶塞,使其______,用干滤纸片沿瓶口缝处检查,看有无水珠渗出。如果不漏,再把塞子旋转________,塞紧,倒置,试验这个方向有无渗漏。 巧记:加水→倒立→观察→正立→瓶塞旋转180°→倒立→观察。 ②________在容量瓶里进行溶质的溶解,应将溶质在________中溶解,冷却后转移到容量瓶里。 ③容量瓶只能用于配制溶液,________储存溶液,因为溶液可能会对瓶体进行腐蚀,从而使容量瓶的精度受到影响。 (3)其他仪器:量筒、烧杯、________、_______等。 4.配制一定物质的量浓度溶液的步骤 (1)计算:如溶质为固体时,计算所需固体的________;如溶液是液体时,则计算所需液体的________。 (2)称量:用______称出所需固体的质量或用_______量出所需液体的体积。 (3)溶解:把称量出的溶质放在________中加少量的水溶解,边加水边振荡。 (4)转移:把所得的溶液用________引流注入容量瓶中。 (5)洗涤:用少量的蒸馏水洗涤烧杯和玻璃棒______次,把每次的洗涤液一并注入容量瓶中。 (6)定容:向容量瓶中缓缓注入蒸馏水至离容量瓶刻度线________处,再用__________滴加蒸馏水至凹液面与刻度线相切。 (7)摇匀:盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,反复上下颠倒摇匀,然后将所配的溶液倒入指定_______并贴好________。 实验流程图: 【要点深化】 1.溶液的特点 (1)溶液是均一、稳定的分散系。从一定物质的量浓度的溶液中取出一定体积的溶液,其密度、质量分数、物质的量浓度与原溶液相同。 (2)物质的量浓度相同,体积也相同的任何溶液,所含溶质的物质的量相等,但是溶质的质量、粒子数不一定相等。 (3)溶液的体积不等于溶质的体积,也不等于溶剂的体积,也不等于溶质和溶剂体积之和。在计算溶液的体积时,必须通过V(溶液)=来计算。 2.配制一定物质的量浓度溶液误差分析技巧 (1)分析判断的依据: 由cB=可分析实验误差, 若nB偏小, V值准确,则cB偏小;若nB准确,V值偏小,则cB偏大。 (2)具体分析判断的方法 可能引起误差的一些操作(以配制0.1 mol·L-1的NaOH溶液为例) 因变量 c/mol·L-1 m V 称量固体溶质时,所用砝码生锈 增大 - 偏大 称量前小烧杯内有水 - - 无影响 称量时间过长 减小 - 偏小 用滤纸称NaOH 减小 - 偏小 未洗涤烧杯和玻璃棒 减小 - 偏小 向容量瓶注液时有少量流出 减小 - 偏小 未冷却到室温就注入定容 - 减小 偏大 定容时水加多了,用滴管吸出 减小 - 偏小 定容摇匀时,液面下降,再加水 - 增大 偏小 定容后,经振荡、摇匀、静置,液面下降 - - 无影响 定容时,俯视刻度数线 - 减小 偏大 定容时,仰视刻度数线 - 增大 偏小 注意:定容时,仰视、俯视对溶液体积的影响如图2-3所示: 【典例精析】 例1 实验室需要配制0.50 mol·L-1 NaCl溶液480 mL。 按下列操作步骤填上适当的文字,以使整个操作完整。 (1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、______、_______以及等质量的两片滤纸。 (2)计算。配制该溶液需取NaCl晶体________g。 (3)称量。 ①天平调平之后,应将天平的游码调至某个位置(1 g以下用游码),请在图2-4中用一根竖线标出游码左边缘所处的位置: 图2-4 ②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。 ③称量完毕,将药品倒入烧杯中。 (4)溶解、冷却,该步实验中需要使用玻璃棒,目的是________________。 (5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了_________________________。 (6)定容,摇匀。 (7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。 (8)在配制过程中,某学生观察定容时液面情况如图2-5所示,所配溶液的浓度会_____(填“偏高”“偏低”或“无影响”)。 图2-5 变式训练 实验室要配制1 mol·L-1的稀硫酸250 mL,回答下列问题: (1)需要98%密度为1.84 g·cm-3的浓硫酸______________________________________________mL; (2)配制时,必须使用的仪器有________(填代号),还缺少的仪器是____________; ①烧杯 ②100 mL量筒 ③20 mL量筒 ④1000 mL容量瓶 ⑤250 mL容量瓶 ⑥托盘天平(带砝码) ⑦玻璃棒 (3)配制时,该实验两次用到玻璃棒,其作用分别是____________、__________; (4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”或“不影响”): ①没有洗涤烧杯和玻璃棒________; ②如果加水超过了刻度线,取出水使液面恰好到刻度线________; ③容量瓶没有干燥________。 ► 探究点二 以物质的量为中心的各物理之间的换算 【知识梳理】 溶解度 (1)概念 ①固体溶质的溶解度:在____________下,某固态物质在_____溶剂里达到________状态时溶解溶质的________(单位是g)。掌握这一概念必须抓住四个要点:一定________;在________溶剂里,达到________状态;单位是___。 ②气体的溶解度:在压强为___________Pa,一定______时溶解在___体积水里达到______状态时的气体______数。 (2)定性描述 ①溶解性:一种物质溶解在另一种物质里的能力。 ②溶解度和溶解性的关系:难(不)溶:溶解度<________; 微溶:溶解度介于________和____之间;可溶:溶解度介于____和______之间;易溶:溶解度>________。 (3)影响溶解度的因素 ①内因:溶质和溶剂的性质。 ②外因 A.温度:大多数固体物质的溶解度随着温度的升高而________(如KNO3),个别固体物质的溶解度随温度的升高而________[如Ca(OH)2],少数物质溶解度受温度影响不大(如NaCl)。气体物质的溶解度随温度升高而减小。 B.压强:固体物质的溶解度一般不受压强的影响,而气体的溶解度随压强增大而______。 【要点深化】 1.与溶夜有关的几个物理量之间的转化关系 2.与物质的量浓度有关的计算式 (1)物质的量浓度与溶质质量分数之间的换算 c==== w=(ρ单位为g·cm-3) [说明]c为物质的量浓度mol·L-1,ρ为溶液的密度g·mL-1,w为溶质的质量分数,M为溶质的摩尔质量g·mol-1,下同。 (2)饱和溶液中物质的量浓度与溶解度(S)的换算 c=== S=(ρ单位为g·cm-3) (3)饱和溶液中质量分数与溶解度之间的换算 w=×100% (4)气体溶质溶于水中制得溶液,其物质的量浓度的计算 在标准状况下,1 L水中溶解某气体y L,所得溶液密度为ρ(ρ单位为g·cm-3),则: c=== w=×100% =×100% =×100% (5)稀释定律 ①如用V1、V2、c1、c2分别表示稀释前后溶液的体积和 物质的量浓度。表达式:c1V1=c2V2。 ②如用m1、m2、w1、w2分别表示稀释前后溶液的质量和质量分数。表达式:m1w1=m2w2。 ③稀释后浓度越小,密度越小的溶液有硫酸、氢氧化钠溶液、氯化钠溶液等;稀释后浓度越小,密度越大的溶液有氨水、乙醇等。 【典例精析】 例2 标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是( ) A.ρ= B.w= C.w= D.c= 变式训练 把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( ) A. mol·L-1 B. mol·L-1 C. mol·L-1 D.mol·L-1 查看更多