- 2021-05-13 发布 |
- 37.5 KB |
- 5页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高一化学 必修 必修一 高三化学 高中化学 高考化学 元素化合物 非金属及其化合物 氮
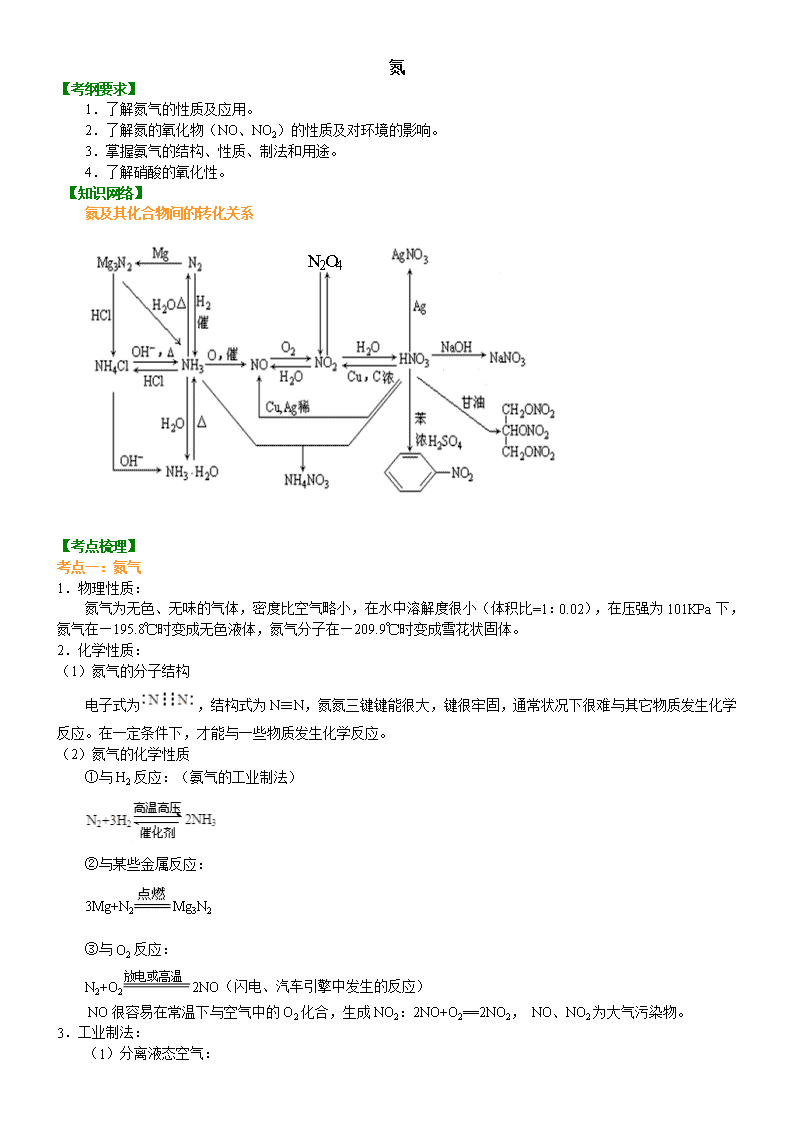
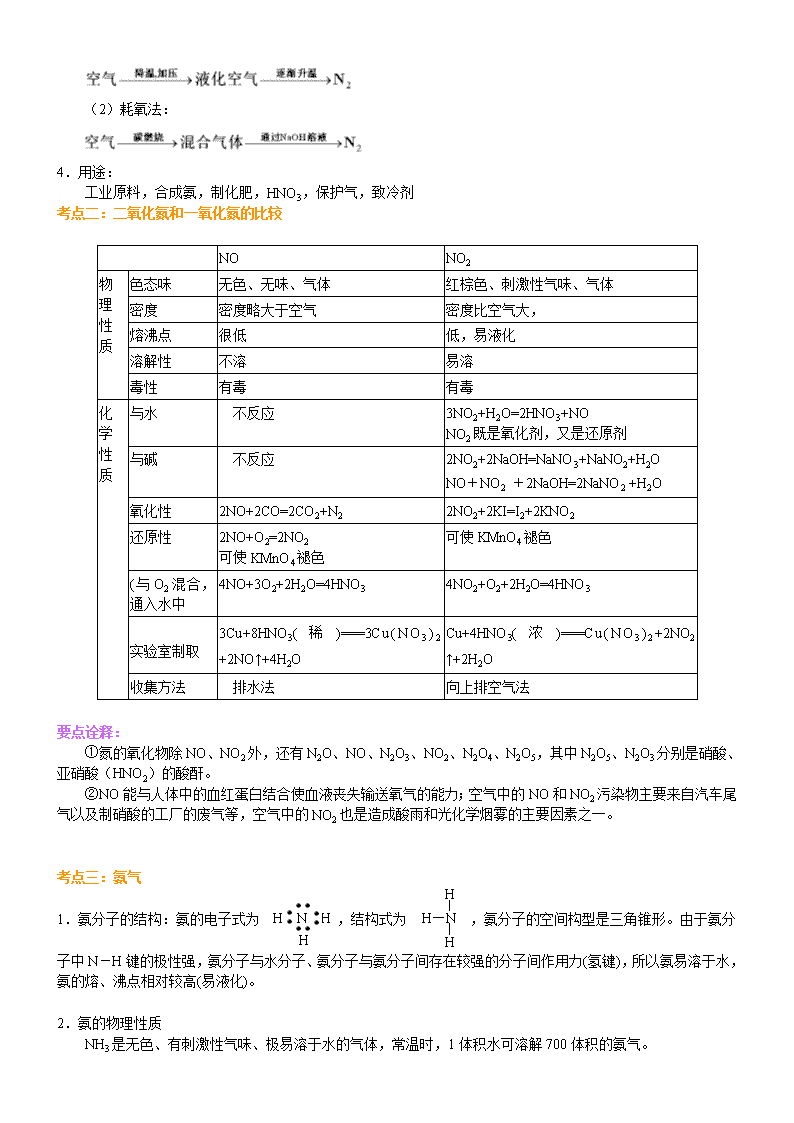
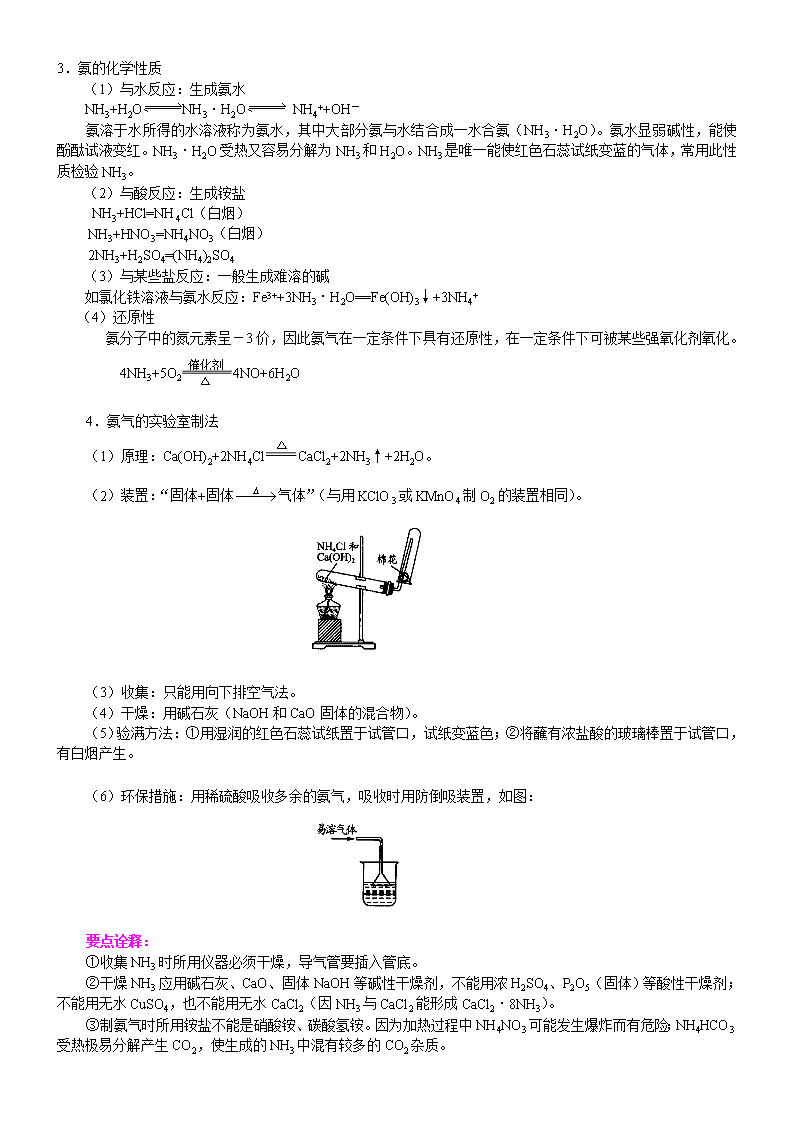
氮 【考纲要求】 1.了解氮气的性质及应用。 2.了解氮的氧化物(NO、NO2)的性质及对环境的影响。 3.掌握氨气的结构、性质、制法和用途。 4.了解硝酸的氧化性。 【知识网络】 氮及其化合物间的转化关系 【考点梳理】 考点一:氮气 1.物理性质: 氮气为无色、无味的气体,密度比空气略小,在水中溶解度很小(体积比=1:0.02),在压强为 101KPa 下, 氮气在—195.8℃时变成无色液体,氮气分子在—209.9℃时变成雪花状固体。 2.化学性质: (1)氮气的分子结构 电子式为 ,结构式为 N≡N,氮氮三键键能很大,键很牢固,通常状况下很难与其它物质发生化学 反应。在一定条件下,才能与一些物质发生化学反应。 (2)氮气的化学性质 ①与 H2 反应:(氨气的工业制法) ②与某些金属反应: 3Mg+N2 Mg3N2 ③与 O2 反应: N2+O2 2NO(闪电、汽车引擎中发生的反应) NO 很容易在常温下与空气中的 O2 化合,生成 NO2:2NO+O2==2NO2, NO、NO2 为大气污染物。 3.工业制法: (1)分离液态空气: N2O4 放电或高温 (2)耗氧法: 4.用途: 工业原料,合成氨,制化肥,HNO3,保护气,致冷剂 考点二:二氧化氮和一氧化氮的比较 NO NO2 色态味 无色、无味、气体 红棕色、刺激性气味、气体 密度 密度略大于空气 密度比空气大, 熔沸点 很低 低,易液化 溶解性 不溶 易溶 物 理 性 质 毒性 有毒 有毒 与水 不反应 3NO2+H2O=2HNO3+NO NO2 既是氧化剂,又是还原剂 与碱 不反应 2NO2+2NaOH=NaNO3+NaNO2+H2O NO+NO2 +2NaOH=2NaNO2 +H2O 氧化性 2NO+2CO=2CO2+N2 2NO2+2KI=I2+2KNO2 还原性 2NO+O2=2NO2 可使 KMnO4 褪色 可使 KMnO4 褪色 (与 O2 混合, 通入水中 4NO+3O2+2H2O=4HNO3 4NO2+O2+2H2O=4HNO3 实验室制取 3Cu+8HNO3( 稀 )===3C u ( N O 3 ) 2 +2NO↑+4H2O Cu+4HNO3( 浓 )===C u ( N O 3 ) 2 +2NO2 ↑+2H2O 化 学 性 质 收集方法 排水法 向上排空气法 要点诠释: ①氮的氧化物除 NO、NO2 外,还有 N2O、NO、N2O3、NO2、N2O4、N2O5,其中 N2O5、N2O3 分别是硝酸、 亚硝酸(HNO2)的酸酐。 ②NO 能与人体中的血红蛋白结合使血液丧失输送氧气的能力;空气中的 NO 和 NO2 污染物主要来自汽车尾 气以及制硝酸的工厂的废气等,空气中的 NO2 也是造成酸雨和光化学烟雾的主要因素之一。 考点三:氨气 1.氨分子的结构:氨的电子式为 ,结构式为 ,氨分子的空间构型是三角锥形。由于氨分 子中 N-H 键的极性强,氨分子与水分子、氨分子与氨分子间存在较强的分子间作用力(氢键),所以氨易溶于水, 氨的熔、沸点相对较高(易液化)。 2.氨的物理性质 NH3 是无色、有刺激性气味、极易溶于水的气体,常温时,1 体积水可溶解 700 体积的氨气。 H N H H H—N H H 3.氨的化学性质 (1)与水反应:生成氨水 NH3+H2O NH3·H2O NH4++OH― 氨溶于水所得的水溶液称为氨水,其中大部分氨与水结合成一水合氨(NH3·H2O)。氨水显弱碱性,能使 酚酞试液变红。NH3·H2O 受热又容易分解为 NH3 和 H2O。NH3 是唯一能使红色石蕊试纸变蓝的气体,常用此性 质检验 NH3。 (2)与酸反应:生成铵盐 NH3+HCl=NH4Cl(白烟) NH3+HNO3=NH4NO3(白烟) 2NH3+H2SO4=(NH4)2SO4 (3)与某些盐反应:一般生成难溶的碱 如氯化铁溶液与氨水反应:Fe3++3NH3·H2O==Fe(OH)3↓+3NH4+ (4)还原性 氨分子中的氮元素呈-3 价,因此氨气在一定条件下具有还原性,在一定条件下可被某些强氧化剂氧化。 4NH3+5O2 4NO+6H2O 4.氨气的实验室制法 (1)原理:Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O。 (2)装置:“固体+固体 气体”(与用 KClO3 或 KMnO4 制 O2 的装置相同)。 (3)收集:只能用向下排空气法。 (4)干燥:用碱石灰(NaOH 和 CaO 固体的混合物)。 (5)验满方法:①用湿润的红色石蕊试纸置于试管口,试纸变蓝色;②将蘸有浓盐酸的玻璃棒置于试管口, 有白烟产生。 (6)环保措施:用稀硫酸吸收多余的氨气,吸收时用防倒吸装置,如图: 要点诠释: ①收集 NH3 时所用仪器必须干燥,导气管要插入管底。 ②干燥 NH3 应用碱石灰、CaO、固体 NaOH 等碱性干燥剂,不能用浓 H2SO4、P2O5(固体)等酸性干燥剂; 不能用无水 CuSO4,也不能用无水 CaCl2(因 NH3 与 CaCl2 能形成 CaCl2·8NH3)。 ③制氨气时所用铵盐不能是硝酸铵、碳酸氢铵。因为加热过程中 NH4NO3 可能发生爆炸而有危险;NH4HCO3 受热极易分解产生 CO2,使生成的 NH3 中混有较多的 CO2 杂质。 △ 催化剂 △ ∆→ (7)快速制 NH3 的方法: ①加热浓氨水(装置:见图Ⅰ) 反应原理:NH3·H2O NH3↑+H2O。 ②浓氨水中加固态碱性物质(装置:见图Ⅱ) 反应原理: 浓氨水中存在以下平衡:NH3+H2O NH3·H2O NH4++OH―,加入固态碱性物质(如 CaO、 NaOH、碱石灰等),消耗水且使 c (OH―)增大,使平衡逆向移动,同时反应放热,促进 NH3·H2O 的分解。 NH3·H2O+CaO=NH3↑+ Ca(OH)2 5.氨的喷泉实验 (1)、实验步骤:在干燥的圆底烧瓶时充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶 口。立即倒置烧瓶,使玻璃管插入盛有水的烧杯里(水里事先加入少量酚酞试液),按图甲安装好装置。打开橡 皮管上的夹子,挤压滴管的胶头,使少量水进入烧瓶,观察现象。 (2)、实验现象:可以看到,烧杯里的水经玻璃管进入烧瓶,形成喷泉,烧瓶内液体呈红色。 (3)、实验结论:氨易溶于水,氨与水反应生成了易溶于水且能使溶液显碱性的物质。 要点诠释:喷泉实验原理 ①容器内气体极易溶于水或容器内气体易与溶液中的溶质发生化学反应。当外部的水或溶液接触容器内气体 时,由于气体大量溶解或与溶液中的溶质发生化学反应,使容器内压强迅速降低,在外界的大气压作用下,外部 液体迅速进入容器,通过尖嘴导管喷出,形成喷泉。下表列出的气体作用于吸收剂,就能形成喷泉。 气体 HCl NH3 CO2、Cl2、H2S、SO2 NO2+O2 CH2=CH2 吸收剂 水或 NaOH 溶液 水或盐酸 浓 NaOH 溶液 水 溴水 ②密闭容器内的液体由于受热挥发(如浓盐酸、浓氨水、酒精等)或发生化学反应,容器内产生大量气体, 容器内压强迅速增大,促使容器内液体迅速向外流动,形成喷泉。如喷雾器、人造喷泉、火山喷发等均是此原理。 考点四:铵盐 1.物理性质 铵盐是由铵根和酸根构成的离子化合物,铵盐都是白色或无色晶体,都易溶于水。 2.化学性质 (1)受热分解(热解) NH4Cl NH3↑+HCl↑(用于除去或分离铵盐) 说明:NH4Cl 受热分解成 NH3 和 HCl,遇冷 NH3 和 HCl 又反应生成的 NH4Cl,本质上发生了化学反应,不 要误认为是升华。 △ △ NH4HCO3 NH3↑+CO2↑+H2O (NH4)2CO3 2NH3↑+CO2↑+H2O (2)碱解——与强碱反应(铵盐的共性) NH4++OH- NH3↑+H2O 3.NH4+的检验方法: (1)取少许样品与碱混合于试管中共热,将湿润的红色石蕊试纸靠近管口,若石蕊试纸变蓝,则证明样品 中含 NH4+。 (2)取少许样品于试管口,加入烧碱后加热,用蘸有浓盐酸的玻璃棒检验产生的气体,若有白烟产生,则 证明样品中含有 NH4+。 考点五:硝酸 1.物理性质 (1)纯硝酸是无色、有刺激性气味的液体。 (2)硝酸沸点(83℃)低,易挥发,在空气中遇水蒸汽呈白雾状。 (3)质量分数 69%以上的硝酸称为浓硝酸。 2.化学性质 (1)酸的通性:一元强酸。如:稀硝酸使紫色石蕊试液变红。 (2)不稳定性 ①硝酸不稳定,见光或受热易分解,其反应方程式为:4HNO3 2H2O+4NO2↑+O2↑ ②存放:HNO3 应盛放在棕色试剂瓶里,并存放在黑暗阴凉处。 ③浓硝酸常呈黄色是因为 HNO3 分解产生的 NO2 溶解于硝酸中,去掉硝酸中黄色的方法是通入少量 O2,发 生的反应为:4NO2+O2+2H2O==4HNO3 (3)强氧化性 ①与金属的反应(大部分金属能与硝酸反应) a.Cu 与浓、稀硝酸均能起反应,其反应方程式分别为: Cu+4HNO3 (浓)==Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3 (稀)==3Cu(NO3)2+2NO↑+4H2O b.常温下,铁、铝遇冷的浓 HNO3 能发生钝化,原因是浓 HNO3 使 Fe、Al 表面生成一层致密的氧化物薄膜, 阻止了酸与内层金属的进一步反应,故常温下可用铁、铝容器盛装冷的浓 HNO3。但加热能和它们发生剧烈的发 生化学反应。如: Al+6HNO3(浓) Al(NO3)3+3NO2↑+3H2O ②与非金属(木炭)的反应:C+4NHO3 (浓) CO2↑+4NO2↑+2H2O。 ③硝酸还能与其他还原剂,如 H2S、SO2、Na2SO3、FeSO4、KI、NaBr 等发生氧化还原反应。 ④王水 浓 HNO3 和浓盐酸按体积比 1∶3 混合即为王水,它的氧化性更强,能溶解 Pt、Au 等金属。 3.用途:制炸药、染料、塑料、硝酸盐等。 △ △ △ 光照或△ △ △查看更多