- 2021-05-13 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学专项训练压轴题2
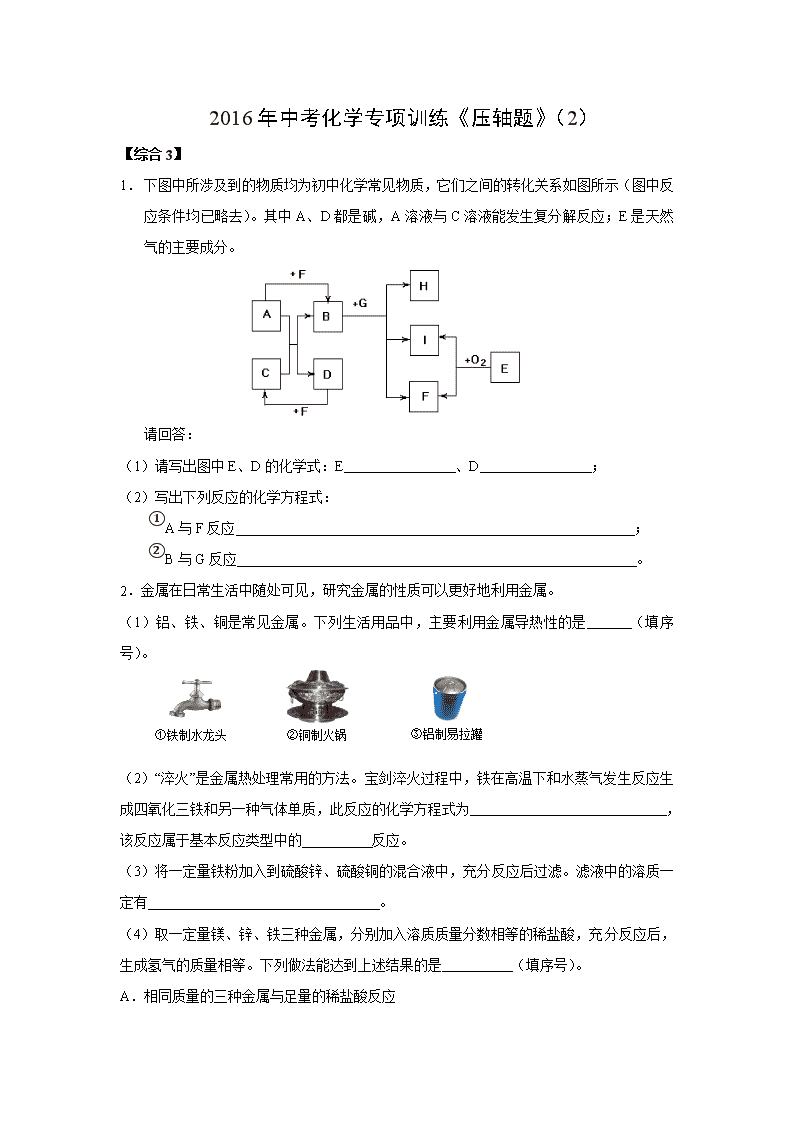
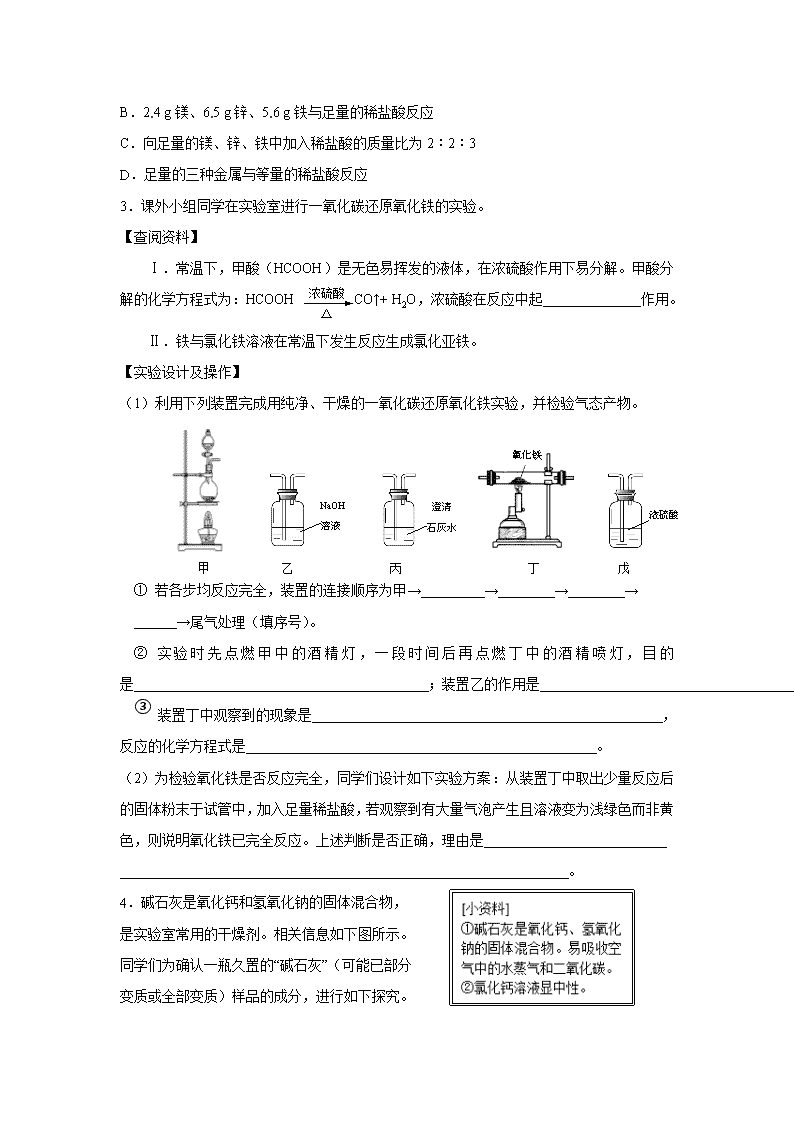
2016年中考化学专项训练《压轴题》(2) 【综合3】 1. 下图中所涉及到的物质均为初中化学常见物质,它们之间的转化关系如图所示(图中反应条件均已略去)。其中A、D都是碱,A溶液与C溶液能发生复分解反应;E是天然气的主要成分。 请回答: (1)请写出图中E、D的化学式:E 、D ; (2)写出下列反应的化学方程式: ①A与F反应 ; ②B与G反应 。 2.金属在日常生活中随处可见,研究金属的性质可以更好地利用金属。 (1)铝、铁、铜是常见金属。下列生活用品中,主要利用金属导热性的是 (填序号)。 ①铁制水龙头 ②铜制火锅 ③铝制易拉罐 (2)“淬火”是金属热处理常用的方法。宝剑淬火过程中,铁在高温下和水蒸气发生反应生成四氧化三铁和另一种气体单质,此反应的化学方程式为 ,该反应属于基本反应类型中的 反应。 (3)将一定量铁粉加入到硫酸锌、硫酸铜的混合液中,充分反应后过滤。滤液中的溶质一定有 。 (4)取一定量镁、锌、铁三种金属,分别加入溶质质量分数相等的稀盐酸,充分反应后,生成氢气的质量相等。下列做法能达到上述结果的是 (填序号)。 A.相同质量的三种金属与足量的稀盐酸反应 B.2.4 g镁、6.5 g锌、5.6 g铁与足量的稀盐酸反应 C.向足量的镁、锌、铁中加入稀盐酸的质量比为2︰2︰3 D.足量的三种金属与等量的稀盐酸反应 3.课外小组同学在实验室进行一氧化碳还原氧化铁的实验。 【查阅资料】 浓硫酸 △ Ⅰ.常温下,甲酸(HCOOH)是无色易挥发的液体,在浓硫酸作用下易分解。甲酸分解的化学方程式为:HCOOH CO↑+ H2O,浓硫酸在反应中起 作用。 Ⅱ.铁与氯化铁溶液在常温下发生反应生成氯化亚铁。 【实验设计及操作】 (1)利用下列装置完成用纯净、干燥的一氧化碳还原氧化铁实验,并检验气态产物。 NaOH 溶液 澄清 石灰水 浓硫酸 氧化铁 甲 乙 丙 丁 戊 ① 若各步均反应完全,装置的连接顺序为甲→ → → → →尾气处理(填序号)。 ② 实验时先点燃甲中的酒精灯,一段时间后再点燃丁中的酒精喷灯,目的是 ;装置乙的作用是 。 ③ 装置丁中观察到的现象是 ,反应的化学方程式是 。 (2)为检验氧化铁是否反应完全,同学们设计如下实验方案:从装置丁中取出少量反应后的固体粉末于试管中,加入足量稀盐酸,若观察到有大量气泡产生且溶液变为浅绿色而非黄色,则说明氧化铁已完全反应。上述判断是否正确,理由是 _ 。 4.碱石灰是氧化钙和氢氧化钠的固体混合物, 是实验室常用的干燥剂。相关信息如下图所示。 同学们为确认一瓶久置的“碱石灰”(可能已部分 变质或全部变质)样品的成分,进行如下探究。 [提出问题]实验室中久置的碱石灰样品的成分是什么? [进行猜想]久置的碱石灰样品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分。用化学方程式表示样品中含有Ca(OH)2或Na2CO3可能含有的原因 (写2个)。 溶液C 固体B 溶液变红 操作① 样品 浊液 (烧杯壁发热) 溶液A 固体B 浊液 加入 足量水 操作① 加入过量 CaCl2溶液 加入 酚酞 [探究过程] 试回答下列问题: (1)操作①的名称是 ,溶液C中一定含 离子。 (2)溶液A中加入CaCl2溶液后产生固体,说明样品中一定含有 ,反应的方程式为 。 (3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是 。 [实验结论] 依据上述实验操作过程及现象,综合对滤液和固体成分的探究,下列对样品成分的分析正确的是 ②③ (填序号)。 ①样品中一定含NaOH ②样品中一定含Na2CO3 ③样品中含NaOH、CaO中的一种或两种 [拓展延伸] 为测定实验室中一瓶变质的烧碱中NaOH的含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g。请分析计算: (1)反应产生的CO2的质量为 g。 (2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?(写出计算过程) (3)用同浓度的硫酸,分别与未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等。从钠元素质量守恒的角度解释其原因是: 。 5.将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某研究性学习小组对固体沉淀的成分进行了如下探究。请完成下列各题: (一)猜想与假设: 猜想一:固体为CuCO3,理由: (用 化学反应方程式表示)。 猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈 性。 猜想三:固体为Cu(OH)2和CuCO3的混合物。 (二)资料查阅: ①结晶水合物受热后易失去结晶水,如CuSO4•5H2OCuSO4 + 5H2O↑; ②Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物。 ③无水氯化钙可做吸水剂;碱石灰的主要成分为氢氧化钠固体和氧化钙 (三)设计与实验: Ⅰ.固体的获取: 将反应后的固、液混合物经过滤、洗涤、室温晾干得蓝色固体。 Ⅱ.定性探究固体的成分: 无色气体 白色浑浊 通入澄清 石灰水 蓝色粉末 加入过量 稀硫酸 蓝色溶液 用下图所示方案,进行实验,并得到下列现象: (1)上图中无色气体为 ,所以猜想二不成立。 (2)向蓝色溶液中加入足量的铁屑,实验现象为 。 发生反应的方程式为 、 。 Ⅲ.定量测定固体的组成: 设固体为aCu(OH)2•bCuCO3•cH2O,为测定其组成,称取24.0 g蓝色固体。 继续进行实验: A B C D 碱石灰 E 浓硫酸 无水氯化钙 氢氧化钠溶液 x 碱石灰 F y 蓝色粉末 图中注射器处为两个单向阀:推注射器时x关闭,y处打开; 拉注射器时,x打开进空气,y关闭。 实验步骤:①组装好装置,检查气密性;②反复推拉注射器;③称量B、C、D、E、F的质量;④关闭弹簧夹,加热B处玻璃管直到反应不再进行;⑤打开弹簧夹,再次反复缓缓推拉注射器;⑥再次称量B、C、D、E、F的质量。 问题探究: (3)进行步骤⑤的操作中,注射器活塞要缓缓推动的主要目的是: 。 数据处理: (4)某兴趣小组利用上述方法,测得以下数据:(假定每步反应都完全) B C D E F 反应前 124.0g 250.0g 300.0g 350.0g 360.0g 反应后 116.0g 253.6g 304.3g 350.1g 360.0g E装置质量增加的原因是 ;求该固体的化学式中 a:b:c= 。 【综合4】 1.下图是实验室常用的装置。请回答下列问题: (1)实验室用氯酸钾和二氧化锰混合制取氧气的发生装置是 (填序号),反应的化学方程式为 。 (2)写出实验室用大理石和稀盐酸反应制取二氧化碳的化学方程式 。收集较纯净的CO2应选用的装置是 (填 序号,下同);收集干燥的CO2应选用的装置是 。 (3)若用下图所示装置制H2并测量生成H2的体积,通过分液漏斗加入一定体积的稀硫酸, 与圆底烧瓶中盛放的0.65g锌粒充分反应(稀硫酸足量)。 ①装置接口的连接顺序为: a → →d(填“b→c”或“c→b”)。 ②理论上0.65g锌与足量稀硫酸反应在该条件下应能收集到224mL的H2,但3次实验测量的H2体积的平均值约为239mL。假设实验操作正确、规范,造成该误差的主要原因是 。 2.人类的生存和发展离不开能源和资源。 (1)苏州家用燃料的更新过程如下: ①下列有关家用燃料更新的理由,正确的是 (选填字母)。 A.天然气属于可再生能源 B.气体燃料比固体燃料利用率更高 C.天然气作为燃料可避免温室效应的发生 D.煤仅仅用作燃料烧掉浪费资源 ②已知:同温、同压下,气体体积比等于分子个数比;管道煤气的主要成分是一氧化碳。原本以管道煤气为燃料的家庭若要改用天然气,灶具的改进方法可为 (选填字母)。 A.增大空气的进入量 B.增大天然气的进入量 C.减小空气的进入量 D.减小天然气的进入量 (2)水是生命之源,合理利用和保护水资源是我们义不容辞的责任。 ①设法除去硬水中的 ,可以使硬水软化成软水。 ②公共场所可利用“活性炭+超滤膜+紫外线”组合工艺获得直饮水,其中活性炭主要起 作用。 (3)海水中有大量可以利用的化学资源,其中所含的氯化镁是金属镁的重要来源之一。从海水中提取金属镁,可按下图流程进行: ①下列有关说法正确的是 (选填字母)。 A.步骤Ⅰ通过一步反应即可实现 B.步骤Ⅱ、Ⅲ、Ⅳ的目的是从海水中提纯氯化镁 C.步骤Ⅴ中化学能转化为电能 D.在此流程中涉及的基本反应类型有4种 ②在此流程中可以循环利用的物质是 。 3.A、B、C、D、E、F六种物质均由非金属元素组成。C、E是单质, 其余四种都是化合物;A、B组成元素相同,D、F组成元素也相同。 常温下C、D、F都是气体;E为黑色固体。它们存在如右图的转化关 系,“→”表示可以向箭头所指方向一步转化,“—”表示两种物质间可以 发生反应。(反应条件与其他物质均已略去) 请回答下列问题: (1)写出下列物质的化学式。E: ;D: 。 (2)写出实现下列转化的化学方程式。 ①A→B: ; ②D→F: 。 4.右图是初中化学中常见化合物间的转化关系,其中 A在常温下是液体,F是人体胃液中助消化的酸,A和B 在不同的条件下会发生不同的化学反应。图中“—”表示两 端的物质能发生化学反应,“→”表示物质间存在转化关系, 反应条件、部分反应物和生成物已略去。 (1)写出物质的化学式:A , B , D 。 (2)E和F之间发生反应的化学方程式为 。 B C D F A E (3)G和F之间的反应属于基本反应类型中的 反应。 (4) C物质的一种用途是 。 5.已知A—F六种物质均为初中化学常见物质,其中B、D为氧化物, A、B、E、F为不同类别的化合物,A、B、E放入水中能使酚酞变红,下图是它们之间的关系(部分反应物和产物已省略;“→”表示转化,“—”表示相互反应),请回答: (1)写出下列物质的化学式:B是 ; F可能是 。 (2)写出A和E反应的化学方程式: ; 写出B和D反应的化学方程式: 。 6.钢铁是使用最多的金属材料。 (1)铁制品锈蚀的过程,实际上是铁与 发生化学反应的过程。铝比铁活泼,但铝具有很好的抗腐蚀性能,其原因是 。 (2)将磁铁矿(主要成分是Fe3O4)冶炼成铁的化学方程式是 。生铁冶炼成钢的过程中,含碳量适当 (选填“升高”或“降低”)。 (3)实验室模拟炼铁原理进行实验, 得到的尾气是CO和CO2的混合气体。 现欲利用右图装置将该混合气体进行 分离,图中a、b、c、d均为活塞。 ①检查装置的气密性。 甲、乙、丙装置内放入一定量水,使长导管口浸没在水面以下,关闭b、c,打开a、d,并在最右端导管口接注射器。当向外缓慢拉动注射器活塞时,如果整套装置气密性良好,则能观察到的现象是 。 ②分离CO和CO2的混合气体。 可供选择的试剂有:稀硫酸、浓硫酸、氢氧化钠溶液、澄清石灰水。 步骤Ⅰ:关闭b、c,打开a、d,缓缓通入混合气体,甲中发生反应的化学方程式为 ;若乙装置中的现象是 ,说明甲装置中的反应是充分的;丙中试剂为 。通过此步实验,分离出的气体是 。 步骤Ⅱ:关闭 ,打开 ,让分液漏斗中的稀硫酸缓缓流下至不再产生气泡时,关闭b。通过此步实验,即可分离出另一种气体。 (4)铁元素可以形成3种氧化物,分别是FeO、Fe2O3 和Fe3O4 。取29g由铁和氧两种元素组成的固体样品,在高温时与足量CO充分反应,生成的气体被足量澄清石灰水吸收,得到50g沉淀。由此分析,原样品可能是 (选填字母)。 A.Fe2O3 B.Fe3O4 C.FeO和Fe3O4的混合物 D.Fe2O3和FeO的混合物 7.已知氯化镁样品中含有杂质氯化钠,某化学兴趣小组的同学通过以下实验测定其中氯化镁的质量分数:称取该样品15g溶于水得到溶液,然后将一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡(实验数据见下表)。 第1次 第2次 第3次 第4次 加入氢氧化钠溶液的质量/g 25 25 25 25 生成沉淀的质量/g 2.9 x 8.7 8.7 (1)表中x = 。 (2)样品中氯化镁的质量分数是 。 (3)若实验室中只有80g质量分数为30%的氢氧化钠溶液,要想配成本实验所需溶质质量 分数的氢氧化钠溶液,还需加入水的质量是多少? 参考答案 【综合3】 1(1)E是甲烷,D是氢氧化钠,故填:CH4,NaOH; (2)①:CO2+Ca(OH)2=CaCO3↓+H2O; ②CaCO3+2HCl=CaCl2+CO2↑+H2O. 2 ② 3Fe+4H2O(气)=Fe3O4+4H2 置换 FeSO4、ZnSO4 BD. 3. 甲→乙→戊→丁→丙 产生CO气体,排尽装置内的空气,防止加热爆炸 防止加热爆炸;除去CO中的甲酸气体 红色的氧化铁粉末逐渐变为黑色; 略 不正确,未反应的氧化铁与盐酸反应生成氯化铁溶液,氯化铁溶液与生成的铁反应,溶液也可变为浅绿色 4. [进行猜想]CaO+H2O═Ca(OH)2(或2NaOH+CO2═Na2CO3+H2O等,答案合理即给分) [实验过程](1)过滤 OH— (2)碳酸钠 Na2CO3+CaCl2═2NaCl+CaCO3↓ (3)取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成,说明CaCl2溶液已过量(合理即给分) [实验结论](1)②③ [拓展延伸] (1)4.4 (2)解:设所取样品中含有Na2CO3的质量为x。 Na2CO3+H2SO4===Na2 SO4+H2O+CO2↑ 106 44 x 4.4g (3)氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸 5 【综合4】 1 (1)A 2KClO32KCl+3O2↑ (2)CaCO3+2HCl==CaCl2+H2O+CO2↑ D (3)①c→b ②测量结果包含了所加稀硫酸的体积 2 (1)①BD; ②AD; (2)①钙、镁化合物; ②吸附; (3)①B; ②HCl. 3 C CO2 略 略 4 (1)H2O CO2 CaO (2)CaCO3+2HCl=CaCl2+H2O+CO2 (3)复分解 (4) 建筑材料 摩擦剂 补钙剂 5 CaO H2SO4 Ca(OH)2+Na2CO3═CaCO3↓+2NaOH; CaO+H2O═Ca(OH)2 6 (1)氧气、水;铝与空气中的氧气反应,表面形成致密的氧化铝薄膜 (2)4CO+Fe3O4=3Fe+4CO2.降低 (3)①甲、乙、丙装置内长导管口均有气泡冒出. ②步骤Ⅰ:2NaOH+CO2=Na2CO3+H2O; 石灰水未变浑浊,浓硫酸. CO. 步骤Ⅱ:a、d,b、c, (4)BD 7 (1)5.8 (2)95% (3)70g查看更多