- 2021-05-13 发布 |
- 37.5 KB |
- 21页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2011中考化学试题汇编 金属与金属材料
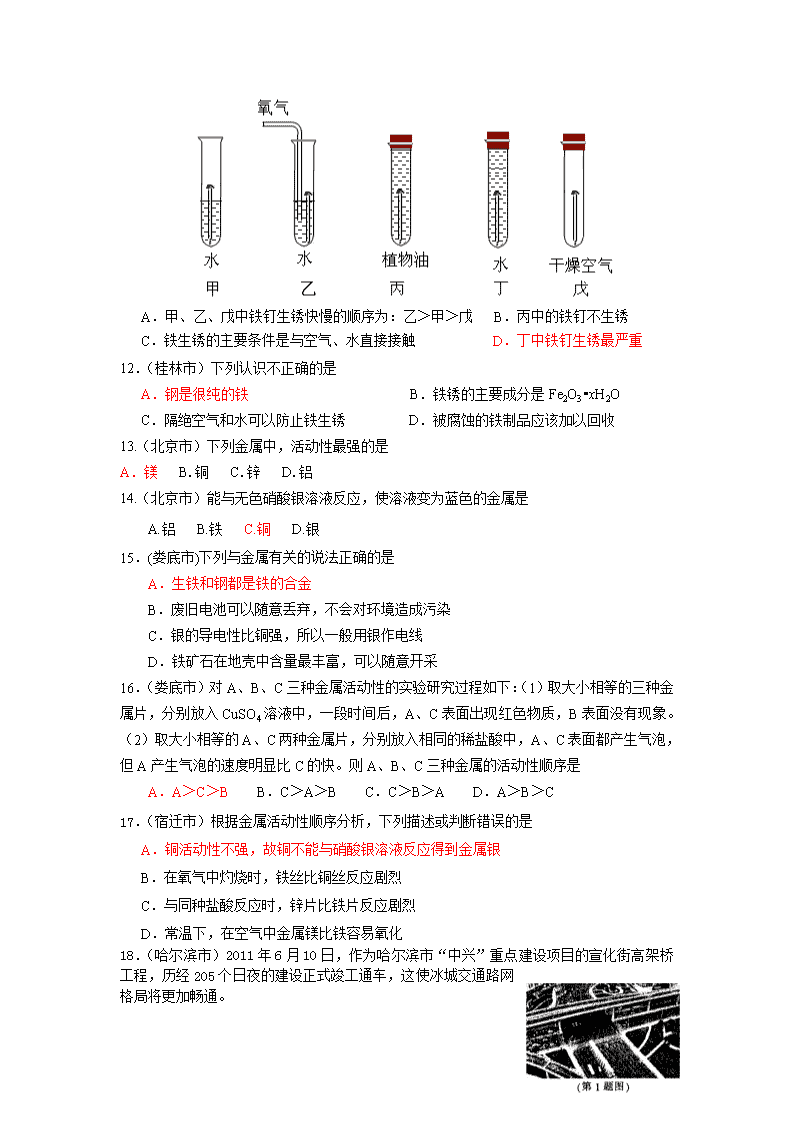
2011中考化学试题汇编--第八单元 金属与金属材料 湖北省孝感汉川市实验中学王必刚 一、选择题: 1.(烟台市)铁及其合金在生产、生活中应用广泛。下列关于铁及其合金的说法中正确的是 (A)铁是地壳中含量最丰富的金属元素 (B)不锈钢的抗腐蚀性好,可用于制造医疗器械 (C)铁丝能在氧气中剧烈燃烧、火星四射,生成氧化铁 (D)铁生锈是铁与空气中的氧气、水发生缓慢氧化的过程 2.(烟台市)下列比较金属活动性强弱的实验设计、现象和结论均正确的是 选项 实验设计 现象 结论(金属的活动性) A 将铝丝放人硫酸铜溶液中 无现象 Cu>Al B 分别将相同形状的镁条和铝条点燃放入盛氧气的集气瓶中 镁条燃烧得更剧烈 Mg>Al C 分别将锌粉与铁丝放入相同浓度的稀盐酸中 锌粉产生气泡的速率比铁丝快 Zn>Fe D 分别将铁丝与铜丝放入相同浓度的稀盐酸中 铁丝表面产生气泡,铜丝无现象 Fe>Cu 3. (福州市)常见金属活动性顺序如图4: 下列各组物质间能发生反应的是 A. 铜和硝酸钠溶液 B.铁和稀盐酸 C.锌和氯化钾溶液 D.银和稀硫酸 3.(雅安市)下列金属中,活动性最弱的是 A.铝 B.铜 C.镁 D.铁 4.(巢湖市)芜湖铁画是中国工艺美术百花园中的一朵奇葩。它以钢材为主料,经锻打、焊接、酸洗、上漆等多道工艺制成。下列关于铁画的叙述不正确的是【 】 A.铁画应悬挂在干燥的环境中 B.所用材料上的铁锈可用稀盐酸清洗掉 C.给打制成型的铁画喷漆既美观又可以防锈蚀 D.所用的主要材料──低碳钢,有较好的锻轧性能,它不属于铁的合金 5.(泰安市)材料的应用和发展与人类文明的进步紧密相关。下列属于金属材料的是 A. 塑料 B.铝合金 C.玻璃 D.玻璃钢 6.(泰安市)下列关于铁的叙述正确的是 A.铁在潮湿的空气中易生锈 B.铁与稀硫酸反应,生成Fe2(SO4)3和H2 C.能用铁桶盛农药波尔多液 D.用稀盐酸除铁锈,生成FeCl2和H2O 7.(泰安市)有X、Y、Z三种金属,将三种金属分别浸入稀硫酸中,Y溶解并放出氢气,X、Z不溶解;将X浸入Z的硫酸盐溶液中,在X的表面有Z析出。则三种金属的活动性由强到弱排列顺序正确的是 A.X>Y>Z B.Y>X>Z C.Y>Z>X D.X>Z>Y 8.(内江市)鞍钢集团全力支持上海世博会,为上海虹桥交通枢纽建设提供了4.7万吨精品钢材。下列关于钢的说法错误的是[ ] A.钢是一种铁合金 B.钢的许多性能优于生铁 C.钢的含碳量高于生铁 D.钢是一种混合物 9.(武汉市)实验室里,用如右图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质。关于该实验,下列说法错误的是( ) A.实验时,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成 B.实验结束时,玻璃管中红色的氧化铁粉末变成黑色,该产物不一定是铁 C.反应后,玻璃管中的固体物质的质量比反应前减少了,证明一定有铁生成 D.为了减少空气污染,应增加尾气处理装置 10.(荆门市)铁钉在下列情况中,最容易生锈的是: ( ) A.在干燥的空气中 B.在潮湿的空气中 C.浸没在自来水中 D.浸没在植物油中 11.(日照市)下图是探究铁制品锈蚀的条件时做的五个实验(铁钉在不同环境中),实验一段时间后,得出的结论错误的是 A.甲、乙、戊中铁钉生锈快慢的顺序为:乙>甲>戊 B.丙中的铁钉不生锈 C.铁生锈的主要条件是与空气、水直接接触 D.丁中铁钉生锈最严重 12.(桂林市)下列认识不正确的是 A.钢是很纯的铁 B.铁锈的主要成分是Fe2O3•xH2O C.隔绝空气和水可以防止铁生锈 D.被腐蚀的铁制品应该加以回收 13.(北京市)下列金属中,活动性最强的是 A.镁 B.铜 C.锌 D.铝 14.(北京市)能与无色硝酸银溶液反应,使溶液变为蓝色的金属是 A.铝 B.铁 C.铜 D.银 15.(娄底市)下列与金属有关的说法正确的是 A.生铁和钢都是铁的合金 B.废旧电池可以随意丢弃,不会对环境造成污染 C.银的导电性比铜强,所以一般用银作电线 D.铁矿石在地壳中含量最丰富,可以随意开采 16.(娄底市)对A、B、C三种金属活动性的实验研究过程如下:(1)取大小相等的三种金属片,分别放入CuSO4溶液中,一段时间后,A、C表面出现红色物质,B表面没有现象。(2)取大小相等的A、C两种金属片,分别放入相同的稀盐酸中,A、C表面都产生气泡,但A产生气泡的速度明显比C的快。则A、B、C三种金属的活动性顺序是 A.A>C>B B.C>A>B C.C>B>A D.A>B>C 17.(宿迁市)根据金属活动性顺序分析,下列描述或判断错误的是 A.铜活动性不强,故铜不能与硝酸银溶液反应得到金属银 B.在氧气中灼烧时,铁丝比铜丝反应剧烈 C.与同种盐酸反应时,锌片比铁片反应剧烈 D.常温下,在空气中金属镁比铁容易氧化 18.(哈尔滨市)2011年6月10日,作为哈尔滨市“中兴”重点建设项目的宣化街高架桥工程,历经205个日夜的建设正式竣工通车,这使冰城交通路网格局将更加畅通。 下列叙述错误的是( ) A.高架桥建设时应注意保证质量和安全 B.高架桥上的灯饰外壳是由塑料制成的,塑料属于天然材料 C.高架桥路面使用的沥青是石油炼制得到的产品之一 D.高架桥建设时使用了大量的钢材,钢材属于金属材料 19.(天津市)有X、Y、2三种金属,X在常温下就能与氧气反应,Y、2在常温下几乎不与氧气反应;如果把Y和2分别放入稀硫酸中,Y溶解并产生氢气, Z不反应。根据以上实验事实判断,X、Y、2三种金属的活动性由强至弱的顺序正确的是( ) A.X Z Y B.X Y Z C.Y Z X D.Z Y X 20(百色市)铁是生产和生活中使用最多的金属材料,下列关于铁的叙述不正确的是 A.铁生锈时生成四氧化三铁 B.表面涂漆以防止铁生锈 C.铁制品应放置于干燥的环境中 D.经常清扫铁器表面灰尘可以防止铁生锈 21.(百色市)某金属R与硝酸银溶液反应的化学方程式为:R + 2AgNO3 R(NO3)2 + 2Ag R与硝酸铜溶液不发生反应,关于R的推断正确的是 A. R的活泼性介于铜、银之间 B. R能置换出酸中的氢 C. R的活泼性比铜强 D. R的活泼性比铜强、银都弱 22.(绥化市)把金属X放入Cu(NO3)2溶液中,X表面有红色固体析出;若放入Mg(NO3)2溶液中, 无明显现象。则X、Cu、Mg三种金属活动性由强到弱的顺序正确的是 ( ) A.Mg、X、Cu B.X、Mg、Cu C.Mg、Cu、X D.Cu、X、Mg 23.(重庆市江津区)向CuCl2溶液加入少量的铁粉充分反应后,溶液中的阳离子是 A.Cu2+ B.Fe2+ C. Cu2+ Fe2+ D.Fe3+ 24.(南昌市)南昌市地铁轨道1号线建成将极大改善市区交通状况。地铁轨道通常是由锰钢制成的,锰钢属于 A.金属材料 B.复合材料 C.合成材料 D.无机非金属材料物 25.(南昌市)有等质量的A、B两金属,相对原子质量Ar(A)<Ar(B),将A放入质量分数为15%的稀硫酸中,B放入质量分数为15%的稀盐酸中,在反应中A、B均为正二价,产生氢气的质量随反应时间变化曲线如右图。下列说法正确的是 A.产生氢气的速率A<B B.反应后A、B一定都有剩余 C.消耗的稀硫酸和稀盐酸质量一定不相等 D.消耗B的质量一定小于A的质量 26.(绵阳市)镍氢充电电池有着广泛应用,镍及其化合物能发生下列反应 ①Ni+2HCl=NiCl2+H2↑ ②NiO+2HCl=NiCl2+H2O ③NiO2+4HCl=NiCl2+Cl2↑+2H2O 对上述反应的分析判断错误的是(C) A.镍能与氯化铜溶液发生置换反应 B.NiCl2能与NaOH溶液发生复分解反应 C.反应②和③都是复分解反应 D.反应中Ni①、③的化合价都发生了变化 27.(绵阳市)相同质量的Mg、Fe分别与稀盐酸作用,产生H2的质量m(H2)与加入稀盐酸的体积V(稀盐酸)关系如下图所示,其中正确的是(D)21世纪教育网 28.(成都市)将洁净光亮的铁钉在潮湿的棉花中比放在空气中更易生锈,主要原因是 A.铁钉附近湿度增大,溶氧量增多 B.隔绝了氧气 C.温度更低 D.更易与二氧化碳反应 29、(眉山市)在天平两盘上的烧杯中,各放入质量相同的稀硫酸,调节天平至平衡。分别向两边烧杯各加入5g镁和5g铁,镁和铁全部反应而消失后,天平的指针( ) A、偏向加铁的一边 B、偏向加镁的一边 C、仍停留在原来的位置 D、无法确定 30. (南京市)某合金6g与足量的稀硫酸充分反应后,如果生成0.2g氢气,该合金中的元素可能是 A. Zn和Fe B. Cu和Au C. Zn和Cu D. Mg和Al 31.(沈阳市)把相同质量、相同溶质质量分数的稀盐酸分别加入盛有X、Y、Z三种金属的试管中,只有Z始终无明显变化们X、Y表面都有气泡产生,但是Y产生气泡的速度明显比X的快。这三种金属的活动性顺序是 A. X>Y>Z B. X>Z>Y C. Z>Y>X D. Y>X>Z[来源:Zxxk.Com] 32.(揭阳市)废旧手机的某些部件中含有Mg、Al、Cu、Ag等金属,为了回收重金属,将旧手机的部件粉碎并浸入足量稀硫酸中充分反应过滤,所得固体中含有的金属是 A. Mg和Al B.Cu和Ag C. Al和Cu D.Mg和Ag 33.(乌鲁木齐市)往AgNO3和Cu(NO3)2的混合液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,你得出的结论是( ) A.滤渣中一定有Fe粉 B. 滤渣中一定有Cu粉 C.滤液中一定有Fe2+ D. 滤液中一定有Ag+、Cu2+ 34.(德州市)某学生为了验证锌、银、铜三种金属的活动性顺序,设计了五个实验:①将Zn、Cu分别放入稀盐酸中; ②将Ag放入Cu(NO3)2溶液中;③将Cu放入AgNO3溶液中;④将Cu放入ZnSO4溶液中;⑤将Zn放入AgNO3溶液中。下列实验组合不能验证锌、银、铜三种金属活动性顺序的是 A.①② B.①③ C.②④ D.①⑤ 35.(呼伦贝尔盟)根据金属活动性顺序分析,下列描述或判断正确的是 A.金属钾能与硫酸锌溶液发生化学反应得到金属锌 B.金属铁与硫酸溶液反应后所得溶液的质量比原溶液的质量增大 C.在常温下,铝比镁更容易与氧气发生化学反应 D.金属铜与氯化银反应得到金属银 36.(资阳市)有X、Y、Z三种金属,将X、Y、Z分别加入到相同的稀盐酸溶液中,只有Y表面产生气泡;另将X加入到Z的硝酸盐溶液中,无明显现象产生。由此判断金属活动性顺序正确的是 A.X>Y>Z B.Y>Z>X C.Y> Cu>Z>X D.Y>X>Z 二、填空与简答: 37.(烟台市)美丽的烟台,以红(苹果、樱桃之都)、金(黄金之都)、绿(生态之都)、紫(葡萄酒之都)、蓝(魅力港城)五种颜色来展现自身的个性魅力。 (1)苹果、樱桃等水果可以为人体提供 ,以预防坏血病。 (2)金的构成微粒是 。 (3)近几年来,我市空气质量状况基本达到优或良。优、良是指空气质量级别 (填“≥”或“≤”)Ⅱ级。 (4)葡萄树受到病菌的侵害时,常喷洒波尔多液。配制波尔多液时,不能用铁制容器,请用化学方程式表示其原因 。 (5)青烟威荣城际铁路的建成,将使得魅力港城的出行更为方便。铁路建设需要大量的钢铁,在炼铁高炉中将赤铁矿还原为铁的主要化学方程式是 。 (1)维生素C (2)金原子(或原子、Au) (3)≤ (4)Fe+CuSO4=FeSO4+Cu (5)3CO+Fe2O3高温2Fe+3CO2 38.(雅安市)下列物质或用品均为生活中常见物质: ①钙片、②不锈钢锅、③活性炭、④汽油、⑤食盐、⑥塑料水杯 请用序号回答下列问题: (1)为防止骨质疏松,人体可以摄入的物质是 。 (2)常用作调味品的是____ __,能除去冰箱内异味的是__ _____。 (3)所使用的主要材料中,属于有机合成材料的是 ,属于金属材料的是______。 (1)①;(2)⑤;③;(3)⑥;② 39.(雅安市)“垃圾是放错地方的资源”。请你应用学到的化学知识参与有关废品收购的实践活动。 (1)假如你在打扫卫生,清理出下列物品: A.废纸、 B.矿泉水瓶、 C.易拉罐、 D.霉变的蛋糕、 E.生锈的铁钉 其中应放入“可回收垃圾箱”的是 (填字母);废品收购人员发现金属铝做的易拉罐“不生锈”,而铁生锈最厉害,便认为金属铁比铝性质活泼。你认为易拉罐“不生锈”原因是___________ ______________________________。 (2)废旧电池中含有汞,如果随意丢弃,会造成污染,威胁人类健康。汞的元素符号是______,它在常温下的状态是__________。常用的干电池内部填有氯化铵和二氧化锰等物质,若通过分离得到氯化铵,在实验室需进行的操作是:溶解、过滤和______________;得到的氯化铵在农业上又可用作_____ _。 (1)ABCE;铝性质活泼,表面生成致密的氧化膜(答出:“氧化膜”或“保护膜即可给分) (2)Hg;液态;蒸发结晶(或“降温结晶”共2分,分“蒸发(降温)”和“结晶”两点各1分);化肥(氮肥) 40.(重庆市)铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关。 (1)按人类开始使用这三种金属的先后排序为 (用元素符号表示)。 (2)在空气中 制品(填“铝”或“铁”)更耐腐蚀。 (3)用下列试剂验证这三种金属的活动性顺序,能达到目的的是 (填序号)。 A.硫酸铝溶液 B.硫酸亚铁溶液 C.硫酸铜溶液 (4)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如钢比纯铁 硬度 (填“大”或“小”)。 (1)Cu Fe Al(1分) (2)铝(1分)(3)B(1分)(4)大(1分) 41. (重庆市)2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”。某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1,K2是活塞): (1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物。 ①这是关于气体的实验,实验前必须对装置进行 ② CO还原Fe2O3的化学方程式为 ③在e处点燃气体的目的是 (2)关闭K2,开启K1,可以将d口出来的气体再从a通人装置而循环使用。 ① c瓶中应装 (填序号)。 A.澄清石灰水 B.水C.石蕊溶液 D.浓硫酸 ②反应完后(假设b瓶中NaOH全部转化为纯碱),要从b瓶中溶液得到纯碱固体,必要的实验操作为转移、 结晶。 ③该实验这样改进的主要优点是 (1)①气密性检查(1分)②3CO+Fe2O3 2Fe+3CO2(1分) ③防止污染空气(1分) (2)① D(1分)②蒸发(1分) ③减少碳的排放,提高原料利用率(2分,合理给分) 42.(巢湖市)右图所示是液态二氧化碳灭火器,请回答下列问题。 (1)图中所标物质中属于金属材料的是 (只写一种), 属于有机材料的是________________(只写一种)。 (2)加压在小钢瓶中液态二氧化碳喷出后能灭火。其原理是 _____ ______和______ ________。 (3)在钢瓶表而涂油漆的作用是____________ _______。 (4)比较铁和铜的金属活动性强弱可采用 的方法。 ⑴铜(或铁或钢) 塑料(或油漆)⑵降温 隔绝空气 ⑶防锈(其他合理答案均给分) ⑷把铁片插入到硫酸铜溶液中(其他合理答案均给分) 43、(临沂市)相同质量的M、N两种活泼金属,分别与足量的稀盐酸在室温下发生反应(M、N在生成物中的化合价为均为+2价),生成H2的质量m和反应时间t的关系如右下图所示。 (1)金属活动顺序是M比N (填“强”或“弱”);相对原的相对原子质量是M比N的 (填“大”或“小”)。 (2)M与稀盐酸反应结束后,消耗稀盐酸中溶质的质量为 g。 (1)强 小 (2)36.5 44.(南充市)化学和我们的日常生活息息相关,化学科学的发展促进了人类社会文明的进步,提高了人们的生活质量。请你用化学方程式解释下列问题: ①用盐酸除去铁制品表面的铁锈 ,该反应的基本类型是 ②生活中铝制器皿在空气中形成具有保护作用的薄膜 ,该反应的基本类型是 45.(内江市)铁路上铺设钢轨常利用铝热反应:2Al + Fe2O3 =高温= 2Fe + Al2O3,该反应说明铝的活动性比铁 (填“强”或“弱” );黄金是一种贵重金属,各种黄金首饰易于保存,具有收藏价值的主要原因是 。 强 金属活动性强弱(或化学性质不活泼或性质稳定或难与其它物质反应等等) 46.(武汉市)探究活动一:在室温条件下进行如图所示实验。已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等。 (1) 该实验的目的是________、________。两支长颈漏斗中产生的现象的不同之处是________。 (2)若实验所用的金属均过量,则甲装置中产生的H2比乙装置中产生的H2质量________(填“多”、“少”或“相等”)。 (可能用到的相对原子质量:H-1O-16Mg-24Cl-35.5Fe-56) 探究活动二:为除去铜屑中混有的少量铁屑,并测定该混合物中铁的质量分数,现有如下A、B两组实验方案。 A:称取一定质量的样品 加入足量的稀盐酸 过滤、洗涤、干燥、称量所得固体质量 搅拌 B:称取一定质量的样品 加入足量的硫酸铜溶液 过滤、洗涤、干燥、称量所得固体质量 搅拌 (3)两种方案,你认为不能达到目的的是________(填“A”或“B”),理由是________。 (4)在你所选取的方案中,若采用加热烘干的方式干燥滤渣,会导致测定的铁的质量分数________(填“偏大”、“偏小”、“不变”或“无法判断”)。 (1)比较镁、铁与稀盐酸反应的剧烈程度 比较相同时间内镁、铁与稀盐酸反应放出热量的多少 甲装置长颈漏斗中的液面比乙装置中的高(2)相等 (3)B铁未被完全除尽 (4)偏小 47.(盐城市)小明发现家中一枚戒指生满了铜绿,他和同学利用这枚戒指展开了研究性学习。 [查阅资料]真金在空气中不会生锈,生满铜绿的“金戒指”材质为铜锌合金; 铜长期露置在潮湿的空气中能生成铜绿,其主要成分是碱式碳酸铜,碱式碳酸铜受热易分解生成CuO、H2O和CO2 。 据上述资料可推知,碱式碳酸铜由 ▲ 种元素组成。 [实验探究]将该枚戒指加入过量稀盐酸中,有气泡产生,溶液由无色逐渐变为蓝绿色。 (1)小明认为:气体中除了含有CO2,还可能含有少量 ▲ 。实验室常用 ▲ 的方法检验这种可能含有的气体。 (2)小红认为蓝绿色溶液中的溶质只有氯化锌。小华认为溶液中的溶质除了氯化锌外, 还应该含有 ▲ 、 ▲ 。他取适量上述蓝绿色溶液,加入光亮的铁片,观察到了现象:① ▲ ,② ▲ ,证实了自己的观点。 (3)小娟取适量新制的FeCl2溶液,加入锌粒,一段时间后,溶液颜色变浅。结合小华的实验可推知:铁、锌、铜三种金属的活动性由弱到强的顺序是 ▲ 。 (4)小明想进一步探究“金戒指”中铜元素的含量,取一枚同材质的“金戒指”,称得质量为3.8g。在老师的指导下,将“金戒指”经浓硝酸氧化、碱化等步骤处理后,最终得到纯净的氧化铜,称得质量仍然为3.8g(实验过程中铜元素损失忽略不计)。则“金戒指”中铜元素的质量分数是多少?(写出计算过程) 4(或四等) ⑴H2 点燃 ⑵CuCl2 HCl(答案可互换) ①有气泡产生 ②有红色物质析出(溶液颜色变浅)(答案可互换) (各1分) ⑶Cu、Fe、Zn(或Cu<Fe<Zn) (2分) ⑷CuO中Cu%=64/(64+16)×100%=80% (1分) 3.8gCuO中mCu=3.8g×80%=3.04g (1分) 据Cu元素守恒知:3.8g“金戒指”中mCu=3.04g “金戒指”中Cu%=3.04g/3.8g×100%=80% (1分) Fe2O3 CO CO2 黑色 粉末A FeSO4溶液 CuSO4溶液 黑色粉末B 和红色固体 加入足量CuSO4溶液 过滤 高温 48.(徐州市)某活动小组根据下图所示进行模拟炼铁的实验,并对产物的成分进行探究。 【提出问题】黑色粉末A可能是什么呢? 【进行猜想】(1)小明认为黑色粉末A全部是铁粉。请写出铁粉与CuSO4溶液反应的化学方程式 ▲ 。实验过程中采取了过滤,该操作中用到的玻璃仪器有 ▲ , ▲ 和玻璃棒,其中玻璃棒的作用是 ▲ 。 (2)小华认为小明的猜想是错误的,理由是 ▲ 。 (3)小华提出了猜想①和猜想②,请结合所学知识补充余下的一个猜想。 猜想①;黑色粉末A由铁粉和四氧化三铁(Fe3O4)组成 猜想②;黑色粉末A由铁粉和氧化亚铁(FeO)组成; 猜想③; ▲ 。 【查阅资料】铁的氧化物都能与稀盐酸,稀硫酸反应,其中氧化铁为红棕色,其余都为黑色,并且只有四氧化三铁能被磁铁吸引。 【实验探究】 方案 实验操作 可能的现象 结论 ① 取适量黑色粉末A 用磁铁吸引 黑色粉末全部被吸引 猜想①正确 ② 取适量黑色粉末A 用磁铁吸引 黑色粉末部分被吸引 猜想②正确 ③ 取适量黑色粉末B加入足量稀盐酸 黑色粉末全部溶解 猜想②正确 ④ ▲ ▲ 猜想③正确 【反思评价】小娟认为方案②和方案③中得出的结论都不正确,其理由是 ▲ 。 【得出结论】在高温下,一氧化碳和二氧化碳可生成铁,氧化亚铁,四氧化三铁。请写出只生成氧化亚铁的方程式 ▲ 。 【进行猜想】 (1)Fe + CuSO4 == FeSO4 + Cu;烧杯、漏斗;引流 (2)加入足量硫酸铜溶液反应后过滤,还有黑色粉末存在 (3)黑色粉末A由铁粉、氧化亚铁和四氧化三铁组成 【实验探究】取适量黑色粉末B用磁铁吸引;黑色粉末部分被吸引。 【反思评价】含有四氧化三铁时,也发生同样的现象 高温 【得出结论】CO + Fe2O3 ==== 2FeO + CO2 49.(北京市)人类的生产和生活都离不开金属。 (1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是____________。金属以矿物形式存在,下列矿石的主要成分属于氧化物的是___________(填化学式)。 (2)铁是应用最广泛的金属。 ①工业常用赤铁矿和一氧化碳在高温条件下炼铁,该反应的化学方程式为__________________。 ②使用过的菜刀、铁锅等铁制品,清洗后需要及时擦干放置,可以减少___________对铁锈蚀的影响。 (3)将一定量的锌加入到稀硫酸、硫酸亚铁和硫酸铜的混合液中,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生。滤渣和滤液中一定含有的物质是____________。 (1)铝 Fe2O3 Al2O3 (2)①3CO+Fe2O33CO2+2Fe ②空气 (3)铁和硫酸锌 50、(淄博市)金属材料被广泛的应用于我们的生活中,不仅是因为其物理性能优良,还与它们的化学性质密切相关。下面是小明同学设计测定金属铁、铜和镁的活动性的探究实验过程和实验记录,请你一起探究。 【实验目的】 测定金属铁、铜和镁的活动性强弱 【所用试剂】 稀硫酸、硝酸银溶液、光亮的薄铁片、薄铜片、薄镁片 【实验过程】 步骤Ⅰ 将铁片、铜片、镁片分别在空气中点燃片刻,观察燃烧现象; 步骤Ⅱ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的稀硫酸的试管中; 实验现象记录表 金属 空气 稀硫酸 硝酸银溶液 铁 — √ √ 铜 — — √ 镁 √ √ √ 步骤Ⅲ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的硝酸银溶液的试管中。[来源:学科网] 【实验记录】用“√”表示能观察到实验现象,用“—”表示观察不到实验现象(见右表)。 ⑴通过步骤Ⅰ可以得出三种金属中镁的金属活动性最强,判断依据是 ⑵运用“控制变量法”设计实验方案是化学研究的重要方法。步骤Ⅱ和步骤Ⅲ中,需要控制的实验条件除了金属的体积、溶液的体积、溶质质量分数以外,还需要控制的条件是 。写出镁和稀硫酸反应的化学方程式 ,此反应属于 。 【实验结论】金属铁、铜和镁的活动性由强到弱的顺序是 (用元素符号表示) 【反思交流】 若利用上述试剂制取氢气,小明认为应该选择金属铁和稀硫酸反应,而不选择金属镁和稀硫酸反应,他的理由是 。 ⑴在空气中,镁能和氧气反应的最剧烈 ⑵溶液的种类 Mg+H2SO4=MgSO4+H2↑ 置换反应 Mg Fe Cu Mg和H2SO4反应速度太快,不易控制 51.(陕西省) 铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。 【提出问题】这是不是因为铁、铝、铜三种金属中铁的活动性最强呢? 【实验探究】同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。 将粗细相同的铁丝、铝丝、铜丝分别插人体积相同、溶质质量分数也相同的稀盐酸中: 【讨论交流】为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。 【反思评价】做金属性质实验时需将金属进行打磨,打磨的目的是 除去金属表面的氧化物 (或污物) 。 【实验验证】为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中: 写出铁与硫酸铜溶液反应的化学方程式 Fe+CuSO4==FeSO4+Cu (化学式错误扣2分) 。 【拓展迁移】(1)若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插人顺序(能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。金属丝的插入顺序为 Cu Fe Al(或铜 铁 铝)或Fe Cu Al(或铁 铜 铝) 。 (2)金属被人类大规模开发利用的大致年限也与金属活动性顺序有关,请写出铁、铝、铜三种金属材料被人类利用的先后顺序 Cu Fe Al(或铜 铁 铝) 。 52.(河南省)在Cu(NO3) 2、A1(NO3) 3和AgNO3伍的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体上滴加稀硫酸时有气泡产生。则反应后所得溶液中含有的金属离子有 ;反应后溶液的质量比原混合溶液的质量 (填“大”或“小”);有关反应的化学方程式为 (写出一个即可)。 Al3+ 和Fe2+ 小 Fe十2AgNO3=Fe(NO3) 2+2Ag [或Pe十Cu(NO3) 2=Fe(NO3) 2+Cu或Fe+H2SO4=FeSO4十H2↑] 53.(河南省)金属是一类重要的材料,其应用十分厂—泛。 (1)铝的利用比铜和铁晚。金属大规模开发和利用的先后顺序与下列 有关。 甲.金属的活动性 乙.金属的导电性 丙.金屑在地壳中的含量 (2)相同的铁栏杆,为什么安装在南方沿诲地区比安装在北方更容易生锈? (3)写出用盐酸清洗铁锈(主要成分是Fe2O3)的化学方程式。 (1)甲 (2)铁在潮湿的空气中容易生锈,南方沿海地区的空气湿度较大且温度要高一些。 (3)Fe2O3+6HCl=2FeCl3十3H2O 54.(大连市)铝、铜、铁是生活中常见的金属。 (1)铝在空气中具有很好的抗腐蚀性能的原因是 。 (2)用铜制电线主要是利用铜具有良好的 性。 (3)铁制品锈蚀,实际上是铁跟空气中的 发生了化学反应。焊接铁制品时,通常先用稀盐酸除去其表面的铁锈,反应的化学方程式为 。防止铁制栏杆锈蚀的一种方法是 。 55.(天津市)人类的生产、生活离不开金属。 ⑴地壳中含量最高的金属元素是 。 (2)在建筑工地露天放置的钢铁容易生锈,钢铁生锈实际是铁与空气中的 发生化学反应,所以在钢铁表面涂油、刷漆等,能防止钢铁生锈。 (3)工业生产中常用10%的稀盐酸来除铁制品表面的铁锈,实验室若要配制该盐酸200g,则需用量筒量取溶质质量分数为38%的浓盐酸(密度为1.19g/mL) mL(计算结果保留至0.1);实验室在配制10%的稀盐酸的过程中,除了用到量筒、胶头滴管外,还需要用到的仪器有 。 (1)铝元素 (2)氧气和水蒸气 (3)44.2 烧杯、玻璃棒 56.(咸宁市)某工厂废液中含有氯化钠.氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示, 回答下列问题。 (1)加入过量A溶解后,再进行操作a时玻璃棒的作用是 。 (2)工厂废液中加入过量A反应的化学方程式为 。 (3)溶液甲中的金属离子是 (写离子符号)。 (4)步骤①②③中所发生的化学反应,其中属于置换反应的是 (填序号)。 (5)铁红是炼铁的主要原料,写出用CO和铁红炼铁的化学方程式 。 (1)引流 (2)Fe+CuCl2 = FeCl2+Cu (3)Na+、Fe2+ (4)①② (5)3CO+Fe2O32Fe+3CO2 57. (绥化市)乐乐同学是一个热爱劳动、善于观察的学生,在星期天帮助妈妈擦洗玻璃时,发现厨房 的钢窗比卧室的钢窗锈蚀严重。请回答: (1)产生这一现象的原因。 (2)在不拆掉此钢窗的前提下,如何防止钢窗进一步锈蚀? (3)金属资源储量有限且不能再生,为了保护金属资源,除防止金属的腐蚀外,你还有什 么合理的建议(答一点即可)? (1)厨房中的水蒸气比卧室中的水蒸气含量高。 评分说明:厨房钢窗表面不洁净等合理答案即可。 (2)将铁锈除掉,在清洁和干燥的钢窗上刷上一层油漆。 评分说明:答出除锈和刷油漆等符合实际操作即可(但必须先除锈) (3)回收利用。 评分说明:答有计划、合理地开采矿物;废旧金属的回收利用;寻找金属的替代品等合理答案均可。 58.(南昌市)铝制品在日常生活中应用广泛,但铝制品却不宜长时间盛放腌制食品。资料显示:“铝制品表面虽然有一层致密的氧化膜保护……氯化钠也会破坏氧化膜的结构,加速铝制品的腐蚀。” 【提出问题】氯化钠溶液中的哪一种离子对氧化膜产生了破坏作用? 【实验方案】 实验序号 实验1 实验2 实验3 方 案 现 象 A中铝片表面有红色固体析出;B中铝片五明显现象。 ② 与A中的现象相同 结 论 溶液中对氧化膜产生了破坏作用的离子可能是 ① 。 除去表面氧化膜的铝片会与CuSO4溶液反应。该反应的化学方程式 ③ 。 验证了实验1的结论。 【反思】针对实验3,莹莹认为还应增做一个对比实验,她的方案是向B试管中再加入Na2SO4溶液,结构无明显现象。该实验可这么溶液中对氧化膜不产生破坏作用的离子是 ⑤ 。 ①Cl—(氯离子) ②铝片表面有红色固体析出 ③2Al + 3CuSO4 === Al2(SO4)3 + 3Cu ④氯化钠(NaCl)⑤ 钠离子(Na+) 59.(成都市)常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉。脱氧中的一步主要反应为:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 (红褐色固体) (1)Fe(OH)2读作 ;此反应的基本类型是 。 (2)某同学自制脱氧剂(2g铁粉、0.5g活性炭、0.5g食盐)进行如下两个实验: 实验Ⅰ: 请回答:操作Ⅰ的名称是 ,乙在净水中用作 ; 溶液丙中含有的溶质是 (写化学式) 实验Ⅱ:将乙烘干后进行如下实验,物质之间的转化关系如下图(部分产物略去)。 ①反应①的条件是 ; ②金属A与B的活动性:A B(填“﹥”“﹤”或“﹦”); ③区别溶液C与溶液D物质的方法是 ; ④反应③的化学方程式为: ,向溶液C中加入BaCl2溶液,有白色沉淀产生。其化学方程式为 。 (1)氢氧化亚铁(1分) 化合反应(1分) (2)实验Ⅰ:过滤(1分) 吸附剂(1分) FeSO4 NaCl H2SO4(1分,无H2SO4不扣分,其它不全对不得分) 实验Ⅱ:①高温(1分) ② > (1分) ③观察溶液颜色,浅绿色为FeSO4溶液,蓝色为CuSO4溶液(或分别取两种溶液,分别加入NaOH溶液,最后有红褐色沉淀的是FeSO4溶液,有蓝色沉淀的是CuSO4溶液) (1分,若区别的是FeCl2和CuCl2,方法正确也给分) ④CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 (2分) CuSO4 + BaCl2 = BaSO4↓ + CuCl2 (2分) 60.(泸州市)根据金属活动顺序表的的有关知识,回答下列问题: (1)用Mg、Zn、Cu三种金属分别于稀盐酸反应,根据金属与稀盐酸反应的 速率 ,可以判断金属活动性强弱的顺序。 (2)用Zn分别与MgCl2、CuCl2溶液反应,也能判断金属活动性顺序,其反应的化学方程式为Zn+CuCl2=Cu+ZnCl2,三种金属活动性由强到弱的顺序为 Mg>Zn>Cu 。若将一定质量的Zn放入CuCl2和MgCl2的混合溶液中,充分反应后过滤,所得固体中一定含有的物质是 Cu 。 61.(上海市)实验室废液中含有硝酸银、硝酸铜,实验小组利用稀硝酸和铁粉分离回收银和铜,设计如下方案。 先在废液中加入过量的铁粉,充分反应后过滤得到滤渣A,其成分为银、铜和铁。再对滤渣A按如下流程图处理: ①先再废液中加入过量的铁粉,过量的目的是______________。 Ⅰ.加快反应速度 Ⅱ.铁的金属活动性较强 Ⅲ.使反应充分进行 ②写出CuO与H2SO4反应的化学方程式___________________________________。 ③滤液D中溶质的成分有________(填化学式)。 ④含有硫酸亚铁的滤液有_________(填框图中字母)。 ⑤如果在过滤操作中发现滤液浑浊,在仪器洁净、滤纸为破损的前提下,你认为滤液的浑浊的原因可能是___________。 Ⅲ,CuO+H2SO4→CuSO4+H2O, CuSO4、H2SO4, C、E, 过滤时漏斗中液面高于滤纸边缘,导致液体直接进入烧杯。 62. (南京市)钢铁是使用最多的金属材料。 (1)钢是含碳量为0.03%~2%的铁 。如碳素钢(主要成分为铁和碳)等。 (2)【查阅资料】一般情况下,两种活动性不同的金属在潮湿的环境中接触时,活动性强的金属首先被腐蚀。 造船工业为了避免轮船的钢铁外壳被腐蚀,通常在轮船外壳镶嵌的金属是 (填编号)A.银块 B.铜块 C.锡块 D.锌块 (1)合金 (2)D 63(南京市)某兴趣小组的同学探究浓硫酸与铁定(碳素钢)反应后产生气体的成分。 【查阅资料】①Fe与浓H2SO4反应,加热,有SO2生成 ②C与浓H2SO4反应,加热,有CO2和SO2生成 ③SO2可使澄清石灰水变浑浊 ④SO2可使品红溶液的红色褪去,而CO2不能 ⑤SO2可与酸性KMnO4溶液反应使其褪色,而CO2不能 ⑥碱石灰的主要成分为NaOH和Cao 【实验探究】 (1)称取24.0g铁钉放入60.0mL浓硫酸中,加热,充分反应后得到的溶液X并收集到气体Y。甲同学通过实验测定并推知气体Y中SO2气体的体积分数为66.7%。同学们认为气体Y中还可能还有H2和Z气体,则Z气体可能是 。探究实验的主要装置如下图所示: (2)装置A中试剂的作用是 。[来源:学_科_网Z_X_X_K] (3)为确认Z的存在,需要将装置甲(如右图所示)接入上述装置的(填编号) 之间。装置甲中的液体名称是 。 (4)实验中,如果观察到装置D中 ,且装置E中 ,则可确认Y中还有H2气体。 (5)如果需要测定限定体积气体Y中H2的含量(H2约为0.01g)。除可用测量H2体积方法外, (选填:“能”或“不能”)用称量上图中装置D、装置E的质量变化的方法,通过计算说明你判断的理由。 (1)CO2 (2)除去SO2 (3)BC 澄清石灰水 (4)黑色固体出现红色 白色固体出现蓝色 (5)能(或不能)(回答“能”与“不能”只要与理由匹配均可给分) 解:设0.01g的H2与D中的CuO充分反应后可生成的水的质量为x 2 18 0.01g x x=0.09g 由生成的水的质量可知: 水中含有的氧元素质量为0.09g-0.01g=0.08g,则参加反应的CuO中氧元素的质量为0.08g; 反应前后,装置D中的质量变化为参加反应的CuO中氧元素的质量,装置E的质量变化为生成水的质量,装置D、装置E的质量变化分别为0.08g和0.09g。 能。可用电子天平称量出装置D或装置E的差量。(或不能,因为实验室中托盘天平只能称准0.1g。) (本题中的计算如不通过化学方程式进行,过程合理均可给分) 64.(沈阳市)右图是关于铜及其化合物的知识网络图,“→”表示一种物质转化成另一种物质。A、B、C分别是不同类别的铜的化合物,其中A物质为黑色粉末,B物质易溶于水。 (1)写出下列物质的化学式: A ,C ; (2)写出①的基本反应类型 ; 写出②的化学方程式 。 (1)A. CuO C. Cu(OH)2 (2)化合反应 CuSO4+BaCl===BaSO4↓+CuCl2(或CuSO4+Ba(NO3)2===BaSO4↓+Cu(NO3)2) 65.(攀枝花市)小强同学分别取溶质质量分数相同的稀盐酸,大小、形状都相同的某种金属X、Al、Cu 进行实验,实验现象记录如下 Al X Cu 现象 开始时 几乎无气泡产生 产生气泡速度慢 无气泡产生 一段时间后 产生气泡速度快 产生气泡速度慢 无气泡产生 回答下列问题: (1)实验开始时,铝表面几乎无气泡产生的原因是_____________ _____ ____。 (2)Cu表面始终无气泡产生的原因是___________ _______。 (3)三种金属的活动性由强到弱的顺序是______ ____________。 (4)如果金属X的活动性比铁弱,且金属X与稀盐酸反应后生成易溶于水的XCl2。向只含有XCl2、CuCl2两种溶质的溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中加入稀盐酸,没有气泡产生。则滤液中一定含有的金属阳离子是 (用离子符号表示)。 (1)铝表面有一层氧化铝薄膜(1分) (2)铜不能与稀盐酸发生反应(1分) (3)Al>X>Cu(1分) (4) Fe2+ 、X2+(2分,少选给1分,但有错不给分) 66.(德州市)用质量相等的锌粉和铁粉,分别与溶质质量分数相同且等质量的稀盐酸充分发生反应,产生氢气的质量与时间的关系如右图所示。 请回答下列问题: ①表示锌粉与稀盐酸反应的曲线为 (填a或b) ②对于a曲线表示的反应,物质 (填名称)有剩余。 ① a ②盐酸 67、(河北省)A~G表示初中化学常见的物质,它们之间的转化关系如图14所示(部分生成物已略去),其中A为金属氧化物,E、F为金属单质,且F为紫红色,化学反应②和③的基本反应类型相同。 请按要求填空: (1)物质C的化学式为 。 (2)写出反应②的一个化学方程式 。 (3)反应③的基本反应类型是 。 (4)E、F和氢由强到弱的金属活动性顺序为 。 (1)H2O (2)Fe + CuSO4 = FeSO4 + Cu (3)置换反应 (4)E 氢 F 68.(资阳市)下图为某些物质间的转化关系,其中A是白色固体,甲是黑色固体,B为气体单质、C和乙在常温下均为无色液体,E为最常用的金属单质之一,H是一种红褐色沉淀。(部分反应物、生成物、反应条件已略去) (1)物质D的化学式___________; (2)甲在反应①中所起的作用是______________________; (3)举出防止E的制品锈蚀的一种方法____________________________________________; (4)写出下列反应的化学方程式 ①__________________________________________________________________; ⑤__________________________________________________________________; ⑦__________________________________________________________________。 MnO2 △ (1)CO (2)催化作用(3)在铁制品表面涂油;刷漆;镀耐磨和耐腐蚀的铬;制造耐腐蚀的合金(任填一种即可得分或其它合理答案也给分) (4)①2KClO3 = 3O2 ↑+ 2KCl ⑤CaO + H2O =Ca(OH)2 ⑦ 2FeCl3 + 3Ca(OH)2= 2Fe(OH)3 ↓+3CaCl2查看更多