- 2021-05-13 发布 |
- 37.5 KB |
- 7页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017年度中考化学(图像、图表分析题)一轮专题测试卷
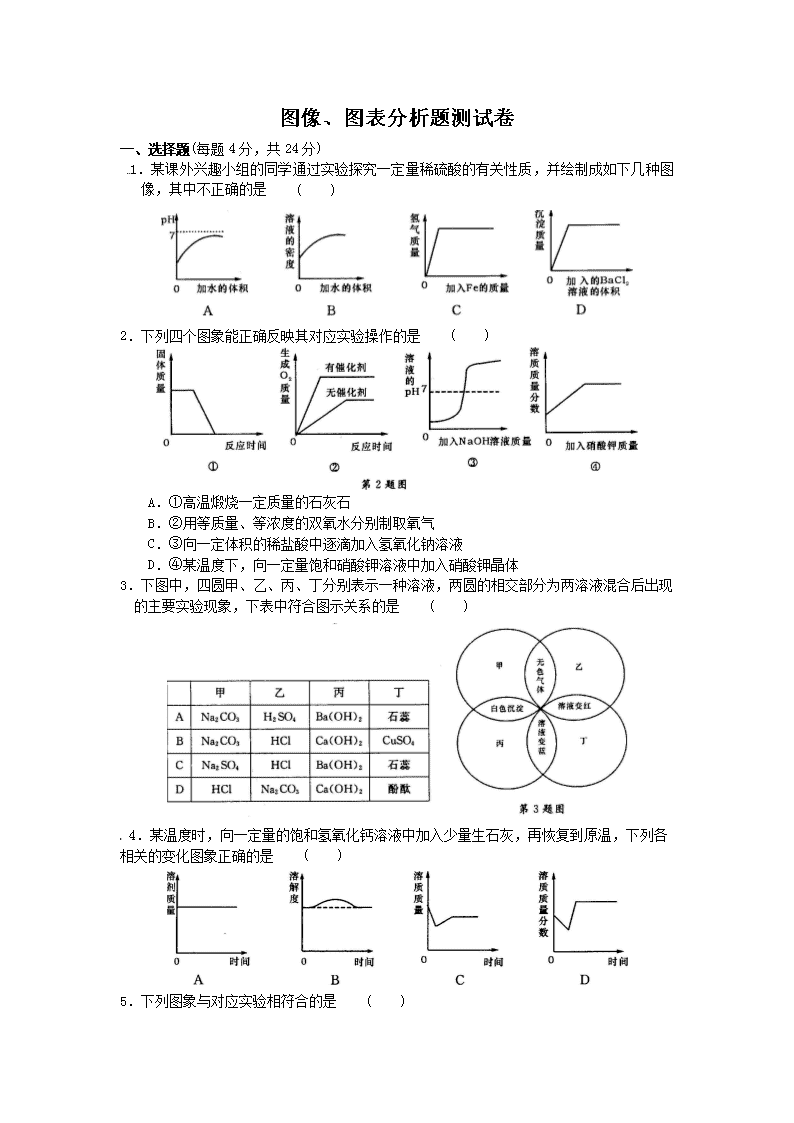
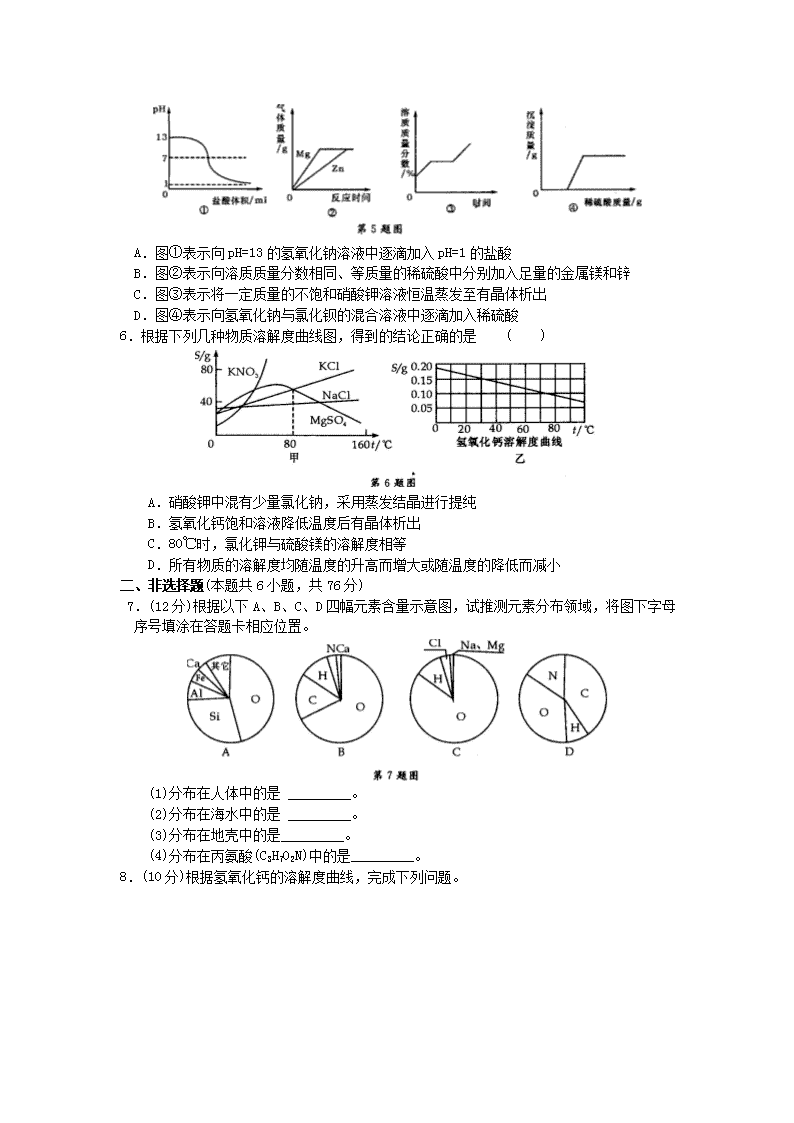
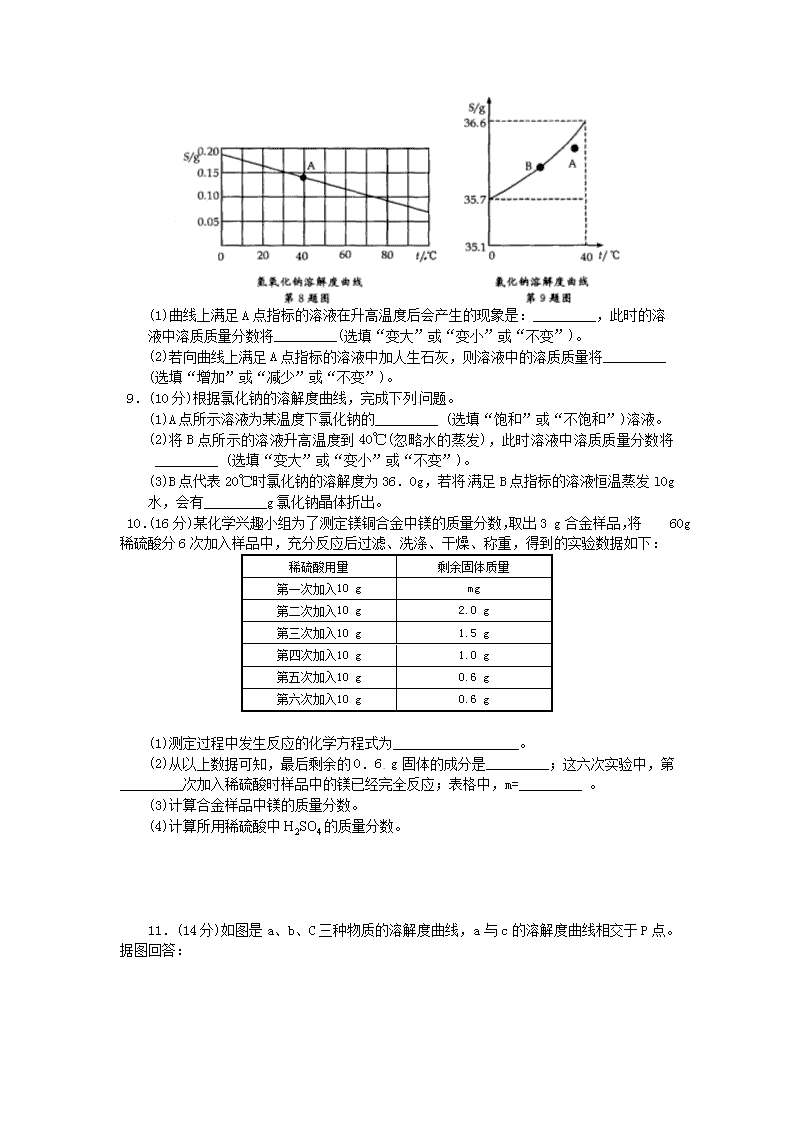
图像、图表分析题测试卷 一、选择题(每题4分,共24分) 1.某课外兴趣小组的同学通过实验探究一定量稀硫酸的有关性质,并绘制成如下几种图像,其中不正确的是 ( ) 2.下列四个图象能正确反映其对应实验操作的是 ( ) A.①高温煅烧一定质量的石灰石 B.②用等质量、等浓度的双氧水分别制取氧气 C.③向一定体积的稀盐酸中逐滴加入氢氧化钠溶液 D.④某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体 3.下图中,四圆甲、乙、丙、丁分别表示一种溶液,两圆的相交部分为两溶液混合后出现 的主要实验现象,下表中符合图示关系的是 ( ) 4.某温度时,向一定量的饱和氢氧化钙溶液中加入少量生石灰,再恢复到原温,下列各 相关的变化图象正确的是 ( ) 5.下列图象与对应实验相符合的是 ( ) A.图①表示向pH=13的氢氧化钠溶液中逐滴加入pH=1的盐酸 B.图②表示向溶质质量分数相同、等质量的稀硫酸中分别加入足量的金属镁和锌 C.图③表示将一定质量的不饱和硝酸钾溶液恒温蒸发至有晶体析出 D.图④表示向氢氧化钠与氯化钡的混合溶液中逐滴加入稀硫酸 6.根据下列几种物质溶解度曲线图,得到的结论正确的是 ( ) A.硝酸钾中混有少量氯化钠,采用蒸发结晶进行提纯 B.氢氧化钙饱和溶液降低温度后有晶体析出 C.80℃时,氯化钾与硫酸镁的溶解度相等 D.所有物质的溶解度均随温度的升高而增大或随温度的降低而减小 二、非选择题(本题共6小题,共76分) 7.(12分)根据以下A、B、C、D四幅元素含量示意图,试推测元素分布领域,将图下字母序号填涂在答题卡相应位置。 (1)分布在人体中的是 _________。 (2)分布在海水中的是 _________。 (3)分布在地壳中的是_________。 (4)分布在丙氨酸(C3H7O2N)中的是_________。 8.(10分)根据氢氧化钙的溶解度曲线,完成下列问题。 (1)曲线上满足A点指标的溶液在升高温度后会产生的现象是:_________,此时的溶 液中溶质质量分数将_________(选填“变大”或“变小”或“不变”)。 (2)若向曲线上满足A点指标的溶液中加人生石灰,则溶液中的溶质质量将_________ (选填“增加”或“减少”或“不变”)。 9.(10分)根据氯化钠的溶解度曲线,完成下列问题。 (1)A点所示溶液为某温度下氯化钠的_________ (选填“饱和”或“不饱和”)溶液。 (2)将B点所示的溶液升高温度到40℃(忽略水的蒸发),此时溶液中溶质质量分数将_________ (选填“变大”或“变小”或“不变”)。 (3)B点代表20℃时氯化钠的溶解度为36.0g,若将满足B点指标的溶液恒温蒸发l0g 水,会有_________g氯化钠晶体折出。 10.(16分)某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3 g合金样品,将 60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下: 稀硫酸用量 剩余固体质量 第一次加入10 g mg 第二次加入10 g 2.0 g 第三次加入10 g 1.5 g 第四次加入10 g 1.0 g 第五次加入10 g 0.6 g 第六次加入10 g 0.6 g (1)测定过程中发生反应的化学方程式为__________________。 (2)从以上数据可知,最后剩余的0.6 g固体的成分是_________;这六次实验中,第_________次加入稀硫酸时样品中的镁已经完全反应;表格中,m=_________ 。 (3)计算合金样品中镁的质量分数。 (4)计算所用稀硫酸中H2SO4的质量分数。 11.(14分)如图是a、b、C三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答: (1)P点的含义是______________________________________________________。 (2)t1℃时30ga物质加入到50g水中不断搅拌,能形成80g溶液吗? _________ (填 “能”或“不能”)。 (3)t1℃时,a、b、C三种物质的溶解度按由小到大的顺序排列:_________ (填物质序 号)。 12.(14分)在学习酸的性质时,同学们发现实验室的工业盐酸呈黄色,老师解释说是因为里面含有氯化铁。为测定这瓶工业盐酸中氯化铁的含量(假设不舍其他杂质),小霞做了如下实验:取20g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10%的氢氧化钠溶液,同时用电子pH计不断读取反应时的pH,得出如图所示的关系。求该工业盐酸中氯化铁的溶质质量分数。(结果保留至0.1%) 图象、图表分析题测试卷 一、单项选择题 1.B【解析】 随着加水的体积的增多,溶液的pH逐渐升高并接近于7,A正确;随着水的体积逐渐增大,溶液的密度逐渐减小,B不正确;因稀硫酸是定量的,加入Fe后生成氢气,随着Fe的增多,稀硫酸反应完后氢气的质量保持恒定,C正确;在定量稀硫酸中加入BaCl2溶液,产生沉淀,随着BaCl2的增加,BaCl2溶液过量。随着的的进行,稀硫酸反应完后不再产生沉淀即沉淀的质量先增加后保持不变,D正确。所以符号题意的答案为B。 2.C【解析】①高温煅烧一定质量的石灰石时,分解生成氧化钙和二氧化碳,而氧化钙为固体物质,图象显示反应后固体质量为零,故A不正确;②用 等质量、等浓度的双氧水分别制取氧气,加不加催化剂,只是改变化学反应速率,最终产生氧气一样多,而图示显示加催化剂与不加生成的氧气不一样,故B不正确;③向一定体积的稀盐酸中逐滴加入氢氧化钠溶液发生反应,溶液酸性减弱至完全反应后碱性又逐渐增强,pH逐渐增大,题意与图示相符,故C正确;④某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体时,原溶液及原溶液溶质量不变,其溶质质量分数不变;而图象显示其溶质质量分数开始逐渐增加,与题意不符,故D不正确。 3.A【解析】碳酸钠能与硫酸反应生成二氧化碳,有气体产生,碳酸钠能与氢氧化钡反应生成碳酸钡白色沉淀,石蕊遇氢氧化钡变蓝,遇硫酸变红,符合图象的现象,故A正确;丙为氢氧化钙,丁为硫酸铜,反应生成的蓝色沉淀,不是溶液变蓝,不符合图象,故B错误;甲为硫酸钠乙为盐酸,二者不能发生反应,无明显现象,故C错误;甲为盐酸,丙为氢氧化钙,二者反应生成易溶于水的氯化钙和水,无明显现象,不符合图象现象,故D错误。 4.C【解析】 因为生石灰与水反应生成氢氧化钙,所以溶剂质量减少,故A错;固体的溶解度影响因素是温度,由于最后恢复到原来温度,所以最后的溶解度与开始时相等,但由于生石灰与水反应放热,使温度升高,因为氢氧化钙的溶解度随温度的升高而减小,故B错;因为开始生石灰与水反应生成氢氧化钙,所以溶剂质量减少,对于饱和氢氧化钙溶液来说,溶剂减少就会析出溶质,所以溶质减少,由于生石灰与水反应生成氢氧化钙时放出热量,在反应过程中温度升高,溶解度减小,但冷却后温度降低,溶解度又增大了,又溶解了一部分,温度不变后溶质也不变了,故C正确;因为饱和溶液的质量分数计算公式是溶解度/(100+溶解度)×l00%,所以饱和溶液的溶质质量分数影响因素是溶解度,固体的溶解度影响因素 是温度,由于最后恢复到原来温度,所以最后的溶解度与开始时相等,溶质质量分数不变,故D错。 5.A【解析】A项pH=13的氢氧化钠溶液中逐滴加入pH一1的盐酸发生中和反应,生成中性物质,碱性不断减弱至恰好反应时pH=7,再滴加盐酸酸性会不断增强,但不可能达到pH=1,故此选项正确;B项镁与锌是镁的活动性较强一些,加入盐酸时应该是镁反应较快,而图象是体现锌的速度快一些,故此选项错误;C项一定质量的不饱和硝酸钾溶液 恒温蒸发至有晶体析出的过程,是溶液由不饱和变成饱和的过程,溶质质量分数不断变大,达到饱和时再恒温蒸发时溶液一直是这一温度下的饱和溶液,溶质质量分数不变,而图象上反映的最后图象上升,故此答案错误;D项向氢氧化钠与氯化钡的混合溶液中逐滴加入稀硫酸,一开始就会有沉淀生成,而图象反映的是一开始滴加时无沉淀生成,故此选项错误。 6.C【解析】A项中采用蒸发结晶不能进行提纯,故A错;B项中对氢氧化钙饱和溶液随温度的降低溶解度变大,所以不会有晶体析出;C项正确;D项错误,如MgS04的溶解度先随温度的升高而增大,然后随温度的升高而减小。 二、非选择题 7.(1)B (2)C (3)A (4)D 【解析】 由题知(4)题中含有C、H、O、N4种元素计算百分含量知(4)题应选D ;人体中含量最多的是H20,其次是C,所以(2)题应选B;地壳中元素含量从多到少为0、Si、Al、Fe等,所以(3)中应选A;海水中含量最多的是O,其次是H、a等,所以(1)中应 选B。 8.(1)出现浑浊变小(2)减小 【解析】(1)氢氧化钙的溶解度随温度的升高而减小,所以升高温度会有氢氧化钙析出,即出现浑浊,此时溶液中溶质的质量分数变小。(2)向曲线上满足A点指标的溶液中加入生石灰,则生石灰与水反应生成氢氧化钙,消耗了水,溶质质量减小,同时生石灰与水反应放热,也会使氢氧化钙的溶解度降低,从而导致溶质质量减小,所以溶液中的溶质质量将减小。 9.(1)不饱和 (2)不变 (3)3.6 【解析】(1)由图知A点在溶解度曲线的下方,所以A点为此温度下的不饱和溶液;(2)B点所示的溶液升高温度到40℃,此时氯化钠的溶解度增大,但此时溶剂和溶质的质量均不变,所以溶液中溶质质量分数不变;(3)B点代表20℃时氯化钠的溶解度为36.0g,即在100g水中能溶解36.0g氯化钠,若在此溶解度下恒温蒸发l0g水,则会有36.0g/100g×10g=3.6g,氯化钠晶体析出。 10.(1)Mg + H2SO4==== MgSO4+H2↑ (2)铜 五 2.5 (3)80% (4)20.4% 【解析】(1)在金属活动性顺序表中,Mg位于氢的前面,能与稀硫酸发生置换反应。 (2)在金属活动性顺序表中,Cu位于氢的后面,不能与稀硫酸发生置换反应,故最后剩余的0.6g固体是铜;分析表中数据,第五次实验镁已完全反应,每次反应消耗镁的质量为0.5g,故m=2.0+0.5=2.5。 (3)3g舍金中铜的质量是0.6g,那么镁的质量为3g-0.6g=2.4g,样品中镁的质量分数为2.4g/3g×100%=80%。 (4)计算稀硫酸中硫酸的质量,可用第一次至第四次镁的质量,不能用第五次镁的质量和镁的总质量2.4g,原因是第五次反应时硫酸有剩余。 设与0.5g镁完全反应的硫酸的质量为2。 Mg + H2SO4==== MgSO4+H2↑ 24 98 0.5g x 24/98 0.5g/x x≈2.04g 所以硫酸质量分数为2.04g/10g*l00%=20.4% 11.(1)在tl℃是时,a与c的溶解度相等 (2)不能 (3)c查看更多
相关文章
- 当前文档收益归属上传用户