- 2021-05-13 发布 |
- 37.5 KB |
- 26页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017年四川省绵阳市中考化学试卷(含详细答案)
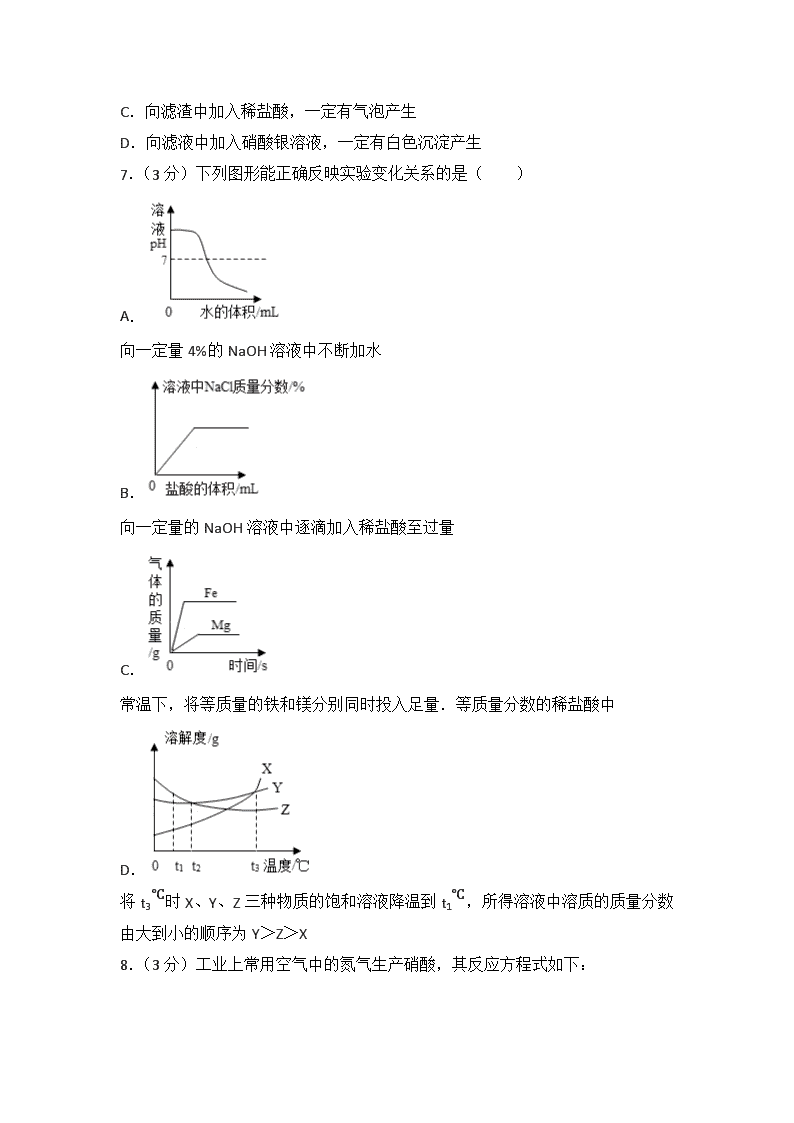
2017年四川省绵阳市中考化学试卷 一、选择题(每小题3分,每个小题只有一个选项最符合题目要求) 1.(3分)化学与生活密切相关.下列说法正确的是( ) A.合成纤维、塑料、棉花都属于合成有机高分子材料 B.用肥皂水可鉴别硬水和软水;用明矾净水即得软水 C.福尔马林能杀菌消毒,干冰可作制冷剂,都可用于对食品保鲜 D.碳酸氢钠俗称小苏打,是焙制糕点所用的发酵粉的主要成分之一 2.(3分)“分类”可以使人们有序地研究物质.以下分类正确的是( ) A.碱:苛性钠、纯碱、熟石灰 B.合金:硬铝、青铜、18K金 C.酸:硝酸、硫酸、碳酸氢钠 D.糖类:蔗糖、纤维素、蛋白质 3.(3分)铜在电气工业中有非常重要的用途.结合图中信息,下列叙述正确的是( ) A.黄铜片的硬度比纯铜片大 B.铜是人体内的一种微量元素,摄入越多越好 C.铜的原子序数为29,其相对原子质量为63.55 g D.铜原子的最外层只有1个电子,所以它在化合物中只能形成+1价 4.(3分)下列实验操作正确且能达到实验目的是( ) A. 探究NaOH固体溶于水的能量变化 B. 排水法收集氧气 C. 稀释浓硫酸 D. 铁在氧气中燃烧 5.(3分)下列除杂或鉴别方法正确的是( ) 选项 实验目的 实验操作 A 除去NaCl溶液中的CaCl2 通入适量CO2 B 除CO2中的HCl气体 将气体通过足量NaOH溶液中 C 鉴别NH4Cl和KCl固体 分别取少许固体于研钵中,加熟石灰研磨 D 鉴别H2和CH4 点燃后分别在火焰上方罩一个冷而干燥的小烧杯 A.A B.B C.C D.D 6.(3分)向FeCl2、CuCl2、MgCl2的混合溶液中加入一定量的锌粉,当反应停止后过滤,得滤渣和滤液.下列说法错误的是( ) A.滤渣的组成有三种情况 B.滤液中一定存在MgCl2和ZnCl2 C.向滤渣中加入稀盐酸,一定有气泡产生 D.向滤液中加入硝酸银溶液,一定有白色沉淀产生 7.(3分)下列图形能正确反映实验变化关系的是( ) A. 向一定量4%的NaOH溶液中不断加水 B. 向一定量的NaOH溶液中逐滴加入稀盐酸至过量 C. 常温下,将等质量的铁和镁分别同时投入足量.等质量分数的稀盐酸中 D. 将t3℃时X、Y、Z三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序为Y>Z>X 8.(3分)工业上常用空气中的氮气生产硝酸,其反应方程式如下: ①N2+3H2 2NH3②4NH3+5O24NO+6H2O ③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO(NO难溶于水) 下列说法错误的是( ) A.上述①②③④中反应前后均有元素化合价的变化 B.用H2O吸收NO2的过程中通入过量的O2可以提高硝酸的产量 C.反应②④都不属于四种基本反应类型中的任何一种,反应①③均属于化合反应 D.在密闭容器中,将46g NO2溶于64g H2O中形成HNO3溶液,其溶质的质量分数约为38.2% 9.(3分)120℃时,取3g有机物R在氧气中完全燃烧,产物只有CO2和H2O.将其燃烧产物依次通过足量的浓硫酸和足量的澄清石灰水中,最终浓硫酸增重1.8g;澄清石灰水中产生10g沉淀.下列判断正确的是( ) A.R的化学式一定是CH2O B.6g R完全燃烧消耗氧气6.4g C.R中碳元素的质量分数约为85.7% D.R仅由C、H两种元素组成,其质量比为6:1 二、解答题 10.(7分)X、Y、Z、W是初中化学常见的四种非金属元素.X的一种原子没有中子,Y的一种单质可用于制铅笔芯,Z是地壳中含量最高的元素,W2是空气中含量最高的单质.回答下列问题: ①Y的另一种单质是天然存在的最硬的物质,该单质的名称为 ,Z2﹣的离子结构示意图为 . ②X、Z、W三种元素可形成一种盐,该盐是一种常见的化肥,其化学式为 . ③实验室检验YZ2时发生反应的化学方程式为 . ④钠与Z形成的化合物Na2Z2常用作潜水艇中的供氧剂,因为Na2Z2与YZ2反应生成Na2YZ3和Z2,写出其反应的化学方程式 . ⑤X、Y、W三种元素可按质量比2:6:7形成一种的火箭燃料偏二甲肼,其相对分子质量为60,偏二甲肼在空气中完全燃烧的产物均无污染,其化学方程式为 . 11.(8分)初中化学几种常见物质的相互转化关系如图所示,其中A为无色无味的有毒气体,B是赤铁矿的主要成分,F常用于改良酸性土壤,H为常见的液态化合物,K是一种紫红色单质.根据推断回答下列问题: ①E溶液的颜色为 ,反应Ⅰ~Ⅲ中属于置换反应的是 (填编号),化合物Na2DO4中D的化合价为 . ②写出反应Ⅰ的化学方程式 ,该反应在工业上的用途是 . ③写出一个由G制取C的化学方程式 . ④D与K的混合物7 g与足量的E溶液充分反应后,固体质量增加0.8g,则该混合物中D的质量分数为 . 12.(8分)小吴对化学实验有浓厚的兴趣,设计了如下实验装置进行实验,按要求填空. ①仪器a的名称 ;可用于实验室制取O2的发生装置有 (填装置编号,下同);实验室制取CO2的发生装置有 ;用C装置收集CO2时,气体应从C装置的 端进入(填“b”或“c”). ②实验室制取H2的化学方程式为 . ③小吴D装置的溶液中滴入石蕊试液,发现溶液显蓝色,由此可知碳酸钠溶液呈 性(填“酸”、“碱”或“中”). ④小吴用E装置探究CO2能否与碳酸钠溶液反应,他做了两组对比实验:第一组用胶头滴管向广口瓶中加入2 mL水,发现气球鼓起不明显;第二组用胶头滴管广口瓶中加入2 mL一定质量分数的碳酸钠溶液,发现气球迅速鼓起.他得出的结论是:CO2能与碳酸钠溶液反应,该反应的化学方程式为 . 13.(8分)化学兴趣小组的同学发现实验台上有一瓶标签残缺的试剂(如图),同学们对此进行了如下探究. 【提出问题】这是一瓶什么溶液? 【猜想与假设】海天同学的猜想是Na2SO3溶液;刘浩同学的猜想是Na2SO4溶液;你的猜想是 (写一种). 【查阅资料】 Ⅰ白色沉淀BaSO3不溶于水,但要溶于稀盐酸. Ⅱ硝酸具有强氧化性,能将BaSO3氧化成BaSO4. ⅢNa2SO3与稀盐酸反应产生SO2,SO2能使石灰水变浑浊,也能使品红溶液褪色. 【进行实验】 Ⅰ海天同学取适量的该溶液于试管中,滴加稀盐酸,产生无色气体,他认为自己的猜想成立,而刘浩同学认为他的结论不合理,原因是 . Ⅱ刘浩同学为了验证自己的猜想,做了如下实验: 取适量的该溶液于试管中,先滴加足量的BaCl2溶液,再滴加过量稀硝酸,现象为 ,刘浩同学认为自己的猜想成立. Ⅲ卓玛同学对刘浩同学的猜想又提出了质疑,她认为加BaCl2和稀硝酸,Na2SO3也会产生沉淀,为了验证自己的观点,做了如下实验: 步骤 操作 实验现象 实验结论 步骤1 取少量该溶液于试管中,滴加足量的BaCl2溶液 无 向步骤1的试管中滴加足量的稀盐酸 步骤2 此溶液不是Na2SO4 步骤3 将步骤2中产生的气体通入品红溶液 品红溶液褪色 写出卓玛同学实验过程中的化学方程式: , . 14.(7分)已知:Al(OH)3沉淀可溶于NaOH溶液,其反应方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,现向100 g HCl和AlCl3的混合溶液中逐滴加入质量分数为20%的NaOH溶液,产生沉淀的质量与所加NaOH溶液的质量关系如图所示.回答下列问题: (1)原混合溶液中HCl的质量分数是 . (2)当沉淀达到最大值时生成NaCl的质量是多少? (3)m2= . 2017年四川省绵阳市中考化学试卷 参考答案与试题解析 一、选择题(每小题3分,每个小题只有一个选项最符合题目要求) 1.(3分)化学与生活密切相关.下列说法正确的是( ) A.合成纤维、塑料、棉花都属于合成有机高分子材料 B.用肥皂水可鉴别硬水和软水;用明矾净水即得软水 C.福尔马林能杀菌消毒,干冰可作制冷剂,都可用于对食品保鲜 D.碳酸氢钠俗称小苏打,是焙制糕点所用的发酵粉的主要成分之一 【分析】A.根据材料的分类来分析; B.根据硬水的软化方法来分析; C.根据福尔马林有毒来分析; D.根据碳酸氢钠的性质与用途来分析. 【解答】解:A.棉花属于天然材料,故错误; B.明矾可以使水中的悬浮杂质沉降,但不能除去水中的可溶性钙镁离子,故错误; C.福尔马林有毒,不能保存食物,故错误; D.碳酸氢钠俗称小苏打,受热时会分解产生二氧化碳,所以是焙制糕点所用的发酵粉的主要成分之一,故正确. 故选D. 【点评】本题考查了化学与生活的知识,完成此题,可以依据已有的知识进行. 2.(3分)“分类”可以使人们有序地研究物质.以下分类正确的是( ) A.碱:苛性钠、纯碱、熟石灰 B.合金:硬铝、青铜、18K金 C.酸:硝酸、硫酸、碳酸氢钠 D.糖类:蔗糖、纤维素、蛋白质 【分析】A.根据碱的概念来分析; B.根据合金的概念来分析; C.根据酸的概念来分析; D.根据糖类的概念来分析. 【解答】解:A.纯碱是碳酸钠的俗称,碳酸钠是由钠离子与碳酸根离子构成的化合物,属于盐,故错误; B.合金,是由两种或两种以上的金属与非金属经一定方法所合成的具有金属特性的物质,硬铝、青铜、18K金都属于合金.故正确; C.碳酸氢钠是由金属离子和酸根离子构成的化合物,属于盐,故错误; D.蔗糖属于糖类,纤维素、蛋白质不属于糖类,故错误. 故选B. 【点评】物质的分类是重点的基础化学知识,但却是学习难点之一,要能正确地、合理地对物质作出正确分类,首先要理解物质分类的有关概念,抓住概念间的相互关系和本质区别. 3.(3分)铜在电气工业中有非常重要的用途.结合图中信息,下列叙述正确的是( ) A.黄铜片的硬度比纯铜片大 B.铜是人体内的一种微量元素,摄入越多越好 C.铜的原子序数为29,其相对原子质量为63.55 g D.铜原子的最外层只有1个电子,所以它在化合物中只能形成+1价 【分析】A.根据合金的特点来分析; B.根据人体对微量元素的需求来分析; C.根据元素周期表的信息来分析; D.根据铜元素的化合价来分析. 【解答】解: A.黄铜是铜的合金,合金的硬度比组成金属的硬度大,所以黄铜片的硬度比纯铜片大,故正确; B.铜是人体内的一种微量元素,但是摄入过多也会对人体健康造成危害,故错误; C.由元素周期表的信息可知,铜的原子序数为29,相对原子质量为63.55,没有单位g,故错误; D.在化合物中,铜元素有+1和+2价两种化合价,故错误. 故选A. 【点评】本题难度不大,考查学生灵活运用元素周期表中元素的信息(原子序数、元素符号、元素名称、相对原子质量)进行分析解题的能力. 4.(3分)下列实验操作正确且能达到实验目的是( ) A. 探究NaOH固体溶于水的能量变化 B. 排水法收集氧气 C. 稀释浓硫酸 D. 铁在氧气中燃烧 【分析】A、根据红墨水的变化,进行分析判断. B、根据图中装置用排水法收集气体时,长导管是出水管,进行分析判断. C、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断. D、根据铁丝在氧气中燃烧的实验注意事项,进行分析判断. 【解答】解:A、氢氧化钠固体溶于水放出大量的热,使装置内空气受热膨胀,U型管内的红墨水会出现左低右高的现象,故选项实验操作正确且能达到实验目的. B、氧气不易溶于水,用图中装置收集氧气时,长导管是出水管,短导管是进气管,故选项实验操作错误. C、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;故选项实验操作错误. D、铁丝在O2中燃烧时,为防止生成物熔化溅落下来使瓶底炸裂,集气瓶的底部应放少量的水或铺一层细沙,图中集气瓶的底部没有放少量的水或铺一层细沙,故选项实验操作错误. 故选:A. 【点评】本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体解题时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断. 5.(3分)下列除杂或鉴别方法正确的是( ) 选项 实验目的 实验操作 A 通入适量CO2 除去NaCl溶液中的CaCl2 B 除CO2中的HCl气体 将气体通过足量NaOH溶液中 C 鉴别NH4Cl和KCl固体 分别取少许固体于研钵中,加熟石灰研磨 D 鉴别H2和CH4 点燃后分别在火焰上方罩一个冷而干燥的小烧杯 A.A B.B C.C D.D 【分析】A、除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质. B、除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质. C、根据两种物质与同种试剂反应产生的不同现象来鉴别它们,若两种物质与同种物质反应的现象相同,则无法鉴别它们. D、根据氢气和甲烷的燃烧产物,进行分析判断. 【解答】解:A、二氧化碳不能与CaCl2溶液反应,不能除去杂质,不符合除杂原则,故选项除杂或鉴别方法错误. B、CO2和HCl气体均能与NaOH溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项除杂或鉴别方法错误. C、NH4Cl能与熟石灰研磨产生有刺激性气味的气体,KCl固体不能,可以鉴别,故选项除杂或鉴别方法正确. D、氢气和甲烷燃烧分别生成水、水和二氧化碳,点燃后分别在火焰上方罩一个冷而干燥的小烧杯,均会出现水雾,不能鉴别,故选项除杂或鉴别方法错误. 故选:C. 【点评】本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体解题时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断. 6.(3分)向FeCl2、CuCl2、MgCl2的混合溶液中加入一定量的锌粉,当反应停止后过滤,得滤渣和滤液.下列说法错误的是( ) A.滤渣的组成有三种情况 B.滤液中一定存在MgCl2和ZnCl2 C.向滤渣中加入稀盐酸,一定有气泡产生 D.向滤液中加入硝酸银溶液,一定有白色沉淀产生 【分析】镁比锌活泼,锌比铁活泼,铁比铜活泼,向FeCl2、CuCl2、MgCl2的混合溶液中加入一定量的锌粉时,锌不能和氯化镁反应,先和氯化铜反应生成氯化锌和铜,如果锌足量,再和氯化亚铁反应生成氯化锌和铁. 【解答】解:A、当锌和氯化铜恰好完全反应时,滤渣中只有铜,如果锌和氯化铜、氯化亚铁恰好完全反应时,滤渣中含有铜和铁,如果锌完全反应有剩余,则滤渣中含有铜、铁和锌,该选项说法正确; B、滤液中一定存在没有反应的氯化镁和反应生成的氯化锌,该选项说法正确; C、向滤渣中加入稀盐酸,不一定有气泡产生,例如当锌恰好和氯化铜完全反应,会锌不足以和氯化铜反应时,滤渣中只含有铜,铜不能和稀盐酸反应,该选项说法不正确; D、滤液中一定氯化镁和氯化锌,因此向滤液中加入硝酸银溶液,一定有白色沉淀产生,即一定生成氯化银沉淀,该选项说法正确. 故选:C. 【点评】要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来. 7.(3分)下列图形能正确反映实验变化关系的是( ) A. 向一定量4%的NaOH溶液中不断加水 B. 向一定量的NaOH溶液中逐滴加入稀盐酸至过量 C. 常温下,将等质量的铁和镁分别同时投入足量.等质量分数的稀盐酸中 D. 将t3℃时X、Y、Z三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序为Y>Z>X 【分析】A、稀释氢氧化钠溶液时,溶液碱性减弱,pH减小; B、氢氧化钠和稀盐酸反应生成氯化钠和水; C、镁比铁活泼,和稀盐酸反应时镁的反应速率较快; D、饱和溶液溶质质量分数=×100%. 【解答】解:A、稀释氢氧化钠溶液时,溶液碱性减弱,pH减小,但是不能减小到7,更不能小于7,该选项对应关系不正确; B、向一定量的NaOH溶液中逐滴加入稀盐酸至过量时,氢氧化钠和稀盐酸反应生成氯化钠和水,随着反应进行,氯化钠质量分数增大,当完全反应后,继续加入稀盐酸时,氯化钠质量分数减小,该选项对应关系不正确; C、常温下,将等质量的铁和镁分别同时投入足量.等质量分数的稀盐酸中时,镁和稀盐酸的反应速率较快,反应需要时间短,并且最终镁和稀盐酸反应生成的氢气多,该选项对应关系不正确; D、降温到t1℃时,X、Y仍然是饱和溶液,Y的溶解度大于X的溶解度,因此Y的质量分数大于X的质量分数,由于X在t1℃时的溶解度小于Z在t3℃时的溶解度,因此降温到t1℃时,Z的质量分数大于X的质量分数,所得溶液中溶质的质量分数由大到小的顺序为Y>Z>X,该选项说法正确. 故选:D. 【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论. 8.(3分)工业上常用空气中的氮气生产硝酸,其反应方程式如下: ①N2+3H2 2NH3②4NH3+5O24NO+6H2O ③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO(NO难溶于水) 下列说法错误的是( ) A.上述①②③④中反应前后均有元素化合价的变化 B.用H2O吸收NO2的过程中通入过量的O2可以提高硝酸的产量 C.反应②④都不属于四种基本反应类型中的任何一种,反应①③均属于化合反应 D.在密闭容器中,将46g NO2溶于64g H2O中形成HNO3溶液,其溶质的质量分数约为38.2% 【分析】A、根据单质中元素化合价规定为零,化合物中元素化合价代数和为零分析元素的化合价; B、一氧化氮能和氧气反应生成二氧化氮; C、根据反应物、生成物种类可以判断反应类型; D、根据提供的数据可以进行计算. 【解答】解:A、①中,反应前氮元素和氢元素的化合价都是0,反应后都不是0,②中,反应前氮元素化合价是﹣3,反应后是+2,氧元素反应前化合价是0,反应后是﹣2,③中,氮元素化合价是+2,反应后是+ 4,氧元素化合价反应前是0和﹣2,反应后是﹣2,④中,反应前氮元素化合价是+4,反应后是+5和+2,该选项说法正确; B、用H2O吸收NO2的过程中通入过量的氧气时,能够把反应生成的一氧化氮氧化成二氧化氮,可以提高硝酸的产量,该选项说法正确; C、反应②④都不属于四种基本反应类型中的任何一种,反应①③均属于化合反应,该选项说法正确; D、设反应生成硝酸的质量为x,生成一氧化氮质量为y, 3NO2+H2O═2HNO3+NO, 138 126 30 46g x y 解得:x=42g,y=10g, 其溶质的质量分数为:×100%=42%,该选项说法不正确. 故选:D. 【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论. 9.(3分)120℃时,取3g有机物R在氧气中完全燃烧,产物只有CO2和H2O.将其燃烧产物依次通过足量的浓硫酸和足量的澄清石灰水中,最终浓硫酸增重1.8g;澄清石灰水中产生10g沉淀.下列判断正确的是( ) A.R的化学式一定是CH2O B.6g R完全燃烧消耗氧气6.4g C.R中碳元素的质量分数约为85.7% D.R仅由C、H两种元素组成,其质量比为6:1 【分析】根据质量守恒定律进行解答,浓硫酸增重的质量即为生成水的质量,利用澄清的石灰水中生成的沉淀的质量可以计算出R燃烧生成的二氧化碳质量,结合相关选项进行分析解答. 【解答】解:由提供信息可知,3gR在氧气中完全燃烧,生成的水的质量为1.8g,设生成二氧化碳的质量为x,则 CO2+Ca(OH)2=CaCO3↓+H2O, 44 100 x 10g x=4.4g 由质量守恒定律可知,参加反应的氧气质量为:1.8g+4.4g﹣3g=3.2g 1.8g水中氢元素的质量与3gR中氢元素的质量相等,即为:1.8g×=0.2g 4.4g二氧化碳中碳元素的质量与3gR中碳元素的质量相等,即为:4.4g×=1.2g 所以R中还含有氧元素,其质量为:3g﹣0.2g﹣1.2g=1.6g,即R是由碳、氢、氧三种元素组成的. A.R中含有碳元素、氢元素与氧元素,其分子中碳、氢、氧的原子个数比为:::=1:2:1,其化学式为:CnH2nOn,可能为CH2O,故错误; B.由以上分析可知,3gR完全燃烧需要3.2g氧气,那么6 gR完全燃烧消耗氧气6.4g,故正确; C.R中碳元素的质量分数为=40%,故错误; D.由以上分析可知,R是由碳、氢、氧三种元素组成的,故错误. 故选B. 【点评】本题考查有机物化学式的确定及相关计算,侧重于学生分析能力和计算能力的考查,题目难度不大. 二、解答题 10.(7分)X、Y、Z、W是初中化学常见的四种非金属元素.X的一种原子没有中子,Y的一种单质可用于制铅笔芯,Z是地壳中含量最高的元素,W2是空气中含量最高的单质.回答下列问题: ①Y的另一种单质是天然存在的最硬的物质,该单质的名称为 金刚石 ,Z2﹣ 的离子结构示意图为 . ②X、Z、W三种元素可形成一种盐,该盐是一种常见的化肥,其化学式为 NH4NO3 . ③实验室检验YZ2时发生反应的化学方程式为 CO2+Ca(OH)2═CaCO3↓+H2O . ④钠与Z形成的化合物Na2Z2常用作潜水艇中的供氧剂,因为Na2Z2与YZ2反应生成Na2YZ3和Z2,写出其反应的化学方程式 2Na2O2+2CO2═2Na2CO3+O2 . ⑤X、Y、W三种元素可按质量比2:6:7形成一种的火箭燃料偏二甲肼,其相对分子质量为60,偏二甲肼在空气中完全燃烧的产物均无污染,其化学方程式为 C2H8N2+4O22CO2+N2+4H2O . 【分析】根据X、Y、Z、W是初中化学常见的四种非金属元素,X的一种原子没有中子,所以X是氢元素,Y的一种单质可用于制铅笔芯,Y是碳元素,Z是地壳中含量最高的元素,所以Z是氧元素,W2是空气中含量最高的单质,所以W是氮元素,然后将推出的元素进行验证即可. 【解答】解:X、Y、Z、W是初中化学常见的四种非金属元素,X的一种原子没有中子,所以X是氢元素,Y的一种单质可用于制铅笔芯,Y是碳元素,Z是地壳中含量最高的元素,所以Z是氧元素,W2是空气中含量最高的单质,所以W是氮元素,经过验证,推导正确,所以 ①碳元素的另一种单质是天然存在的最硬的物质,该单质的名称为金刚石,O2﹣的离子结构示意图为:; ②X、Z、W三种元素可形成一种盐,该盐是一种常见的化肥,其化学式为NH4NO3; ③实验室检验CO2时发生的反应是氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O; ④过氧化钠和二氧化碳反应生成碳酸钠和氧气,化学方程式为:2Na2O2+2CO2═2Na2CO3+O2; ⑤偏二甲肼和氧气在点燃的条件下生成二氧化碳、氮气和水,化学方程式为:C2H8N2+4O2 2CO2+N2+4H2O. 故答案为:①金刚石,; ②NH4NO3; ③CO2+Ca(OH)2═CaCO3↓+H2O; ④2Na2O2+2CO2═2Na2CO3+O2; ⑤C2H8N2+4O2 2CO2+N2+4H2O. 【点评】在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可. 11.(8分)初中化学几种常见物质的相互转化关系如图所示,其中A为无色无味的有毒气体,B是赤铁矿的主要成分,F常用于改良酸性土壤,H为常见的液态化合物,K是一种紫红色单质.根据推断回答下列问题: ①E溶液的颜色为 蓝色 ,反应Ⅰ~Ⅲ中属于置换反应的是 Ⅲ (填编号),化合物Na2DO4中D的化合价为 +6 . ②写出反应Ⅰ的化学方程式 Fe2O3+3CO2Fe+3CO2 ,该反应在工业上的用途是 炼铁 . ③写出一个由G制取C的化学方程式 CaCO3CaO+CO2↑ . ④D与K的混合物7 g与足量的E溶液充分反应后,固体质量增加0.8g,则该混合物中D的质量分数为 80% . 【分析】根据初中化学几种常见物质,A为无色无味的有毒气体,所以A是一氧化碳,B是赤铁矿的主要成分,所以B是氧化铁,F常用于改良酸性土壤,所以F是氢氧化钙,H为常见的液态化合物,所以H是水,K是一种紫红色单质,所以K是铜,一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,D和E会生成铜,所以D是铁,E可以是硫酸铜,铁和硫酸铜反应生成硫酸亚铁和铜,所以J是硫酸亚铁,所以C是二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,所以G是碳酸钙,然后将推出的物质进行验证即可. 【解答】解:初中化学几种常见物质,A为无色无味的有毒气体,所以A是一氧化碳,B是赤铁矿的主要成分,所以B是氧化铁,F常用于改良酸性土壤,所以F是氢氧化钙,H为常见的液态化合物,所以H是水,K是一种紫红色单质,所以K是铜,一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,D和E会生成铜,所以D是铁,E可以是硫酸铜,铁和硫酸铜反应生成硫酸亚铁和铜,所以J是硫酸亚铁,所以C是二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,所以G是碳酸钙,经过验证,推导正确,所以 ①E溶液的颜色为蓝色,Ⅰ是一氧化碳和氧化铁的反应,不属于反应基本类型,Ⅱ是二氧化碳和氢氧化钙的反应,不属于反应基本类型,Ⅲ是铁和硫酸铜反应生成硫酸亚铁和铜,属于置换反应,反应Ⅰ~Ⅲ中属于置换反应的是Ⅲ,化合物Na2DO4中,钠元素是+1,氧元素显示﹣2价,所以D的化合价为+6; ②反应Ⅰ是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式:Fe2O3+3CO2Fe+3CO2,该反应在工业上的用途是炼铁; ③由G制取C的反应是碳酸钙在高温的条件下生成氧化钙和二氧化碳,化学方程式为:CaCO3CaO+CO2↑; ④设该混合物中D的质量为x CuSO4+Fe=FeSO4+Cu 固体质量增大 56 64 8 x 0.8g = x=5.6g 所以该混合物中D的质量分数为×100%=80%. 故答案为:①蓝色,Ⅲ,+6; ②Fe2O3+3CO2Fe+3CO2,炼铁; ③CaCO3+2HCl═CaCl2+CO2↑+H2O或CaCO3CaO+CO2↑; ④80%. 【点评】在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可. 12.(8分)小吴对化学实验有浓厚的兴趣,设计了如下实验装置进行实验,按要求填空. ①仪器a的名称 长颈漏斗 ;可用于实验室制取O2的发生装置有 AB (填装置编号,下同);实验室制取CO2的发生装置有 B ;用C装置收集CO2时,气体应从C装置的 c 端进入(填“b”或“c”). ②实验室制取H2的化学方程式为 Zn+H2SO4═ZnSO4+H2↑ . ③小吴D装置的溶液中滴入石蕊试液,发现溶液显蓝色,由此可知碳酸钠溶液呈 碱 性(填“酸”、“碱”或“中”). ④小吴用E装置探究CO2能否与碳酸钠溶液反应,他做了两组对比实验:第一组用胶头滴管向广口瓶中加入2 mL水,发现气球鼓起不明显;第二组用胶头滴管广口瓶中加入2 mL一定质量分数的碳酸钠溶液,发现气球迅速鼓起.他得出的结论是:CO2能与碳酸钠溶液反应,该反应的化学方程式为 CO2+Na2CO3+H2O═2NaHCO3 . 【分析】长颈漏斗方便加液体药品,制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集.D装置的溶液中滴入石蕊试液,发现溶液显蓝色,由此可知碳酸钠溶液呈碱性;CO2能与碳酸钠溶液反应反应生成碳酸氢钠,配平即可. 【解答】解:(1)长颈漏斗方便加液体药品,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热;实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;用C装置收集CO2时,气体应从C装置的长管进入,因为二氧化碳的密度比空气的密度大;故答案为:①长颈漏斗; AB; B; c; ②锌和硫酸反应生成硫酸锌和氢气,故答案为:Zn+H2SO4═ZnSO4+H2↑; ③D装置的溶液中滴入石蕊试液,发现溶液显蓝色,由此可知碳酸钠溶液呈碱性;故答案为:碱; ④CO2能与碳酸钠溶液反应反应生成碳酸氢钠,配平即可;故答案为:CO2+Na2CO3+H2O═2NaHCO3; 【点评】 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、溶液的酸碱性和气体的性质等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中. 13.(8分)化学兴趣小组的同学发现实验台上有一瓶标签残缺的试剂(如图),同学们对此进行了如下探究. 【提出问题】这是一瓶什么溶液? 【猜想与假设】海天同学的猜想是Na2SO3溶液;刘浩同学的猜想是Na2SO4溶液;你的猜想是 Na2CO3 (写一种). 【查阅资料】 Ⅰ白色沉淀BaSO3不溶于水,但要溶于稀盐酸. Ⅱ硝酸具有强氧化性,能将BaSO3氧化成BaSO4. ⅢNa2SO3与稀盐酸反应产生SO2,SO2能使石灰水变浑浊,也能使品红溶液褪色. 【进行实验】 Ⅰ海天同学取适量的该溶液于试管中,滴加稀盐酸,产生无色气体,他认为自己的猜想成立,而刘浩同学认为他的结论不合理,原因是 与稀盐酸反应产生无色气体的并非只有Na2SO3 . Ⅱ刘浩同学为了验证自己的猜想,做了如下实验: 取适量的该溶液于试管中,先滴加足量的BaCl2溶液,再滴加过量稀硝酸,现象为 先产生白色沉淀,加入稀硝酸沉淀不溶解 ,刘浩同学认为自己的猜想成立. Ⅲ卓玛同学对刘浩同学的猜想又提出了质疑,她认为加BaCl2和稀硝酸,Na2SO3也会产生沉淀,为了验证自己的观点,做了如下实验: 步骤 操作 实验现象 实验结论 步骤1 取少量该溶液于试管中,滴加足量的BaCl2溶液 产生白色沉淀 无 步骤2 向步骤1的试管中滴加足量的稀盐酸 白色沉淀溶解,有气泡产生 此溶液不是Na2SO4 步骤3 将步骤2中产生的气体通入品红溶液 品红溶液褪色 此溶液是Na2SO3 写出卓玛同学实验过程中的化学方程式: Na2SO3+BaCl2=BaSO3↓+2NaCl , BaSO3+2HCl=BaCl2+H2O+SO2↑ . 【分析】根据标签中钠元素符号的角标是2结合物质的化学式分析解答,根据物质的性质、物质间的反应以及化学方程式书写的知识解答即可. 【解答】解:【猜想与假设】标签中钠元素符号的角标是2,故还有可能是碳酸钠溶液,故填:Na2CO3; 【进行实验】Ⅰ、取适量的该溶液于试管中,滴加稀盐酸,产生无色气体,还有可能是碳酸钠与盐酸反应产生二氧化碳气体,故填:与稀盐酸反应产生无色气体的并非只有Na2SO3; Ⅱ:刘浩认为自己的猜想正确,则是硫酸钠与氯化钡反应产生硫酸钡沉淀,该沉淀不溶于稀硝酸,故填:先产生白色沉淀,加入稀硝酸沉淀不溶解; Ⅲ:根据本表格提供的信息可以看出,产生的气体通入品红溶液,溶液褪色,说明生成了二氧化硫,故加入氯化钡产生白色沉淀,沉淀等于盐酸反应产生气泡,故填:产生白色沉淀;白色沉淀溶解,有气泡产生; 此溶液是Na2SO3; 氯化钡与亚硫酸钠反应产生亚硫酸钡沉淀和氯化钠,亚硫酸钡沉淀与盐酸反应产生氯化钡、水和二氧化硫,故填:BaCl2+Na2SO3═BaSO3↓+2NaCl(1分) BaSO3+2HCl═BaCl2+SO2↑+H2O. 【点评】本题考查的是常见的物质的成分的推断,完成此题,可以依据物质的性质进行. 14.(7分)已知:Al(OH)3沉淀可溶于NaOH溶液,其反应方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,现向100 g HCl和AlCl3 的混合溶液中逐滴加入质量分数为20%的NaOH溶液,产生沉淀的质量与所加NaOH溶液的质量关系如图所示.回答下列问题: (1)原混合溶液中HCl的质量分数是 3.65% . (2)当沉淀达到最大值时生成NaCl的质量是多少? (3)m2= 100 . 【分析】根据图中数据可以看出和盐酸反应的氢氧化钠的溶液的质量为20g.氢氧化钠和氯化铝反应生成的沉淀的质量为7.8g.根据以上数据和对应的化学方程式求算对应的数据. 【解答】解: 由图可以看出和盐酸反应的氢氧化钠溶液的质量为20g,其溶质的质量为20%×20g=4g 设混合溶液中HCl的质量为x,生成的氯化钠的质量为y HCl+NaOH=NaCl+H2O 36.5 40 58.5 x 4g y == x=3.65g y=5.85g 原混合溶液中HCl的质量分数为×100%=3.65% 由于生成的氢氧化铝的质量为7.8g,设生成的氯化钠的质量为z,消耗的氢氧化钠的质量为a AlCl3+3NaOH=Al(OH)3↓+3NaCl 120 78 175.5 a 7.8g z == a=12g z=17.55g 当沉淀达到最大值时生成NaCl的质量是5.85g+17.55g=23.4g 设和氢氧化铝的氢氧化钠的质量为b Al(OH)3+NaOH═NaAlO2+2H2O 78 40 7.8g b = b=4g 到沉淀完全溶解消耗的氢氧化钠的质量为4g+12g+4g=20g 对应的氢氧化钠溶液的质量为=100g. 答: (1)原混合溶液中HCl的质量分数是3.65%. (2)当沉淀达到最大值时生成NaCl的质量是23.4g. (3)m2=100. 【点评】根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整. 查看更多