- 2021-05-10 发布 |
- 37.5 KB |
- 23页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖北省黄冈市中考化学试卷
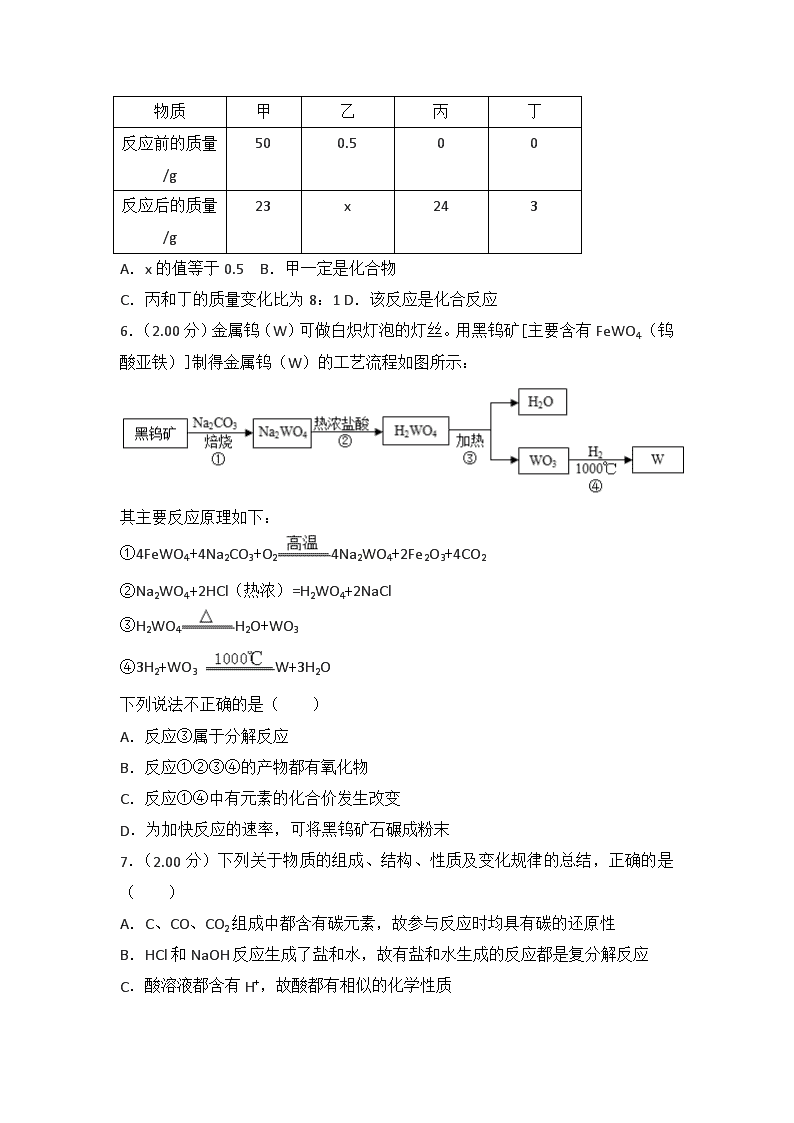
2018年湖北省黄冈市中考化学试卷 一、选择题(每小题只有一个选项符合题意.每小题2分,共16分) 1.(2.00分)下列四个事例中一定发生了化学变化的是( ) A.①② B.②③ C.③④ D.①④ 2.(2.00分)下列实验操作错误的是( ) A. 滴加液体 B. 点燃酒精灯 C. 称量反应物质量 D. 稀释浓硫酸 3.(2.00分)下列说法: ①二氧化硫和臭氧都是空气污染物; ②洁净的空气和水都是纯净物; ③因为水体有自净能力,所以生活污水可任意排放; ④降低可燃物的着火点是灭火的途径之一; ⑤烧碱和熟石灰的溶液都显碱性; ⑥复合肥中一定要含有氮、磷、钾三种元素;⑦如果将化合物按有机化合物和无机化合物两大类划分,则葡萄糖和尿素应属于有机化合物。 其中正确的是( ) A.①⑤⑦ B.①②④⑥ C.④⑤⑦ D.①②⑤⑥ 4.(2.00分)小雨同学依据描述书写的化学符号: ①3个锌原子;3ZN; ②两个氢分子:2H2; ③两个氢氧根离子:2OH﹣; ④原子结构示意图对应的粒子:Mg2+; ⑤氯化亚铁的化学式:FeCl2; ⑥﹣2价的氧元素:O2﹣。 其中正确的有( ) A.②③⑤ B.①⑤⑥ C.②③④ D.①③⑤ 5.(2.00分)一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是( ) 物质 甲 乙 丙 丁 反应前的质量/g 50 0.5 0 0 反应后的质量/g 23 x 24 3 A.x的值等于0.5 B.甲一定是化合物 C.丙和丁的质量变化比为8:1 D.该反应是化合反应 6.(2.00分)金属钨(W)可做白炽灯泡的灯丝。用黑钨矿[主要含有FeWO4(钨酸亚铁)]制得金属钨(W)的工艺流程如图所示: 其主要反应原理如下: ①4FeWO4+4Na2CO3+O24Na2WO4+2Fe2O3+4CO2 ②Na2WO4+2HCl(热浓)=H2WO4+2NaCl ③H2WO4H2O+WO3 ④3H2+WO3 W+3H2O 下列说法不正确的是( ) A.反应③属于分解反应 B.反应①②③④的产物都有氧化物 C.反应①④中有元素的化合价发生改变 D.为加快反应的速率,可将黑钨矿石碾成粉末 7.(2.00分)下列关于物质的组成、结构、性质及变化规律的总结,正确的是( ) A.C、CO、CO2组成中都含有碳元素,故参与反应时均具有碳的还原性 B.HCl和NaOH反应生成了盐和水,故有盐和水生成的反应都是复分解反应 C.酸溶液都含有H+,故酸都有相似的化学性质 D.浓H2SO4、NaOH都具有吸水性,故它们都能用来干燥二氧化碳气体 8.(2.00分)一定质量的甲烷在不充足的氧气中燃烧,甲烷完全反应,生成物只有CO、CO2和H2O,且总质量为20.8g,其中H2O的质量为10.8g,则CO2的质量为( ) A.5.6g B.8.8g C.4.4g D.4.8g 二、填空简答题(本题包括3小题,共13分) 9.(4.00分)化学基础与常识 (1)图1金属应用的实例,主要利用金属的导热性的是 (填序号); (2)向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,反应前后溶液中存在的离子种类如图2所示(其中其中表示不同离子)。则“”与“”反应生成了 (填物质名称)。 (3)氢氟酸(HF)能刻画玻璃,其中有一个化学反应的化学方程式是:CaSiO3+6HF=X+SiF4↑+3H2O,则X的化学式为 (4)氢能是一种极具发展潜力的清洁能。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图3所示。写出反应I中,发生反应的化学方程式: 。 10.(5.00分)化学就在我们身边,请用所学化学知识回答下列问题。 (1)金刚石和石墨都是由碳元素组成的单质,但是由于 ,因此它们的物理性质存在着较大差异; (2)用一氧化碳和磁铁矿石(主要成分是Fe3O4)炼铁,其反应的化学方程式是 ; (3)用盐酸除去自行车钢圈上的铁锈,其反应的化学方程式是 ; (4)铝制品形成致密保护膜的化学方程式是 ; (5)氢化镁(MgH2)是一种贮氢合金,当它与H2O混合时释放出氢气,同时生成一种碱,该反应的化学方程式是 。 11.(4.00分)甲、乙、丙三种物质的转化关系如图所示(“→”表示反应能一步实现,部分反应物、生成物和反应条件均已略去),请回答下列问题。 (1)若乙是最常用的溶剂,丙是单质,则甲可能是 (填化学式); (2)若甲是一种黑色固体,乙和丙是组成元素相同的两种气体,写出丙→乙转化的化学方程式 ; (3)若甲是纯碱,乙是一种常见的温室气体,则丙可能是 (填化学式),写出乙→丙转化的化学方程式 。 三、计算题(本题包括1小题,共3分) 12.(3.00分)为测定某石灰石矿中碳酸钙的含量,现称取12.5g石灰石矿样品与足量的稀盐酸反应(杂质不溶于水,也不参与反应),得到二氧化碳气体4.4g(假设生成的气体全部逸出)。请计算:该石灰石样品含CaCO3的质量分数? 四、探究与实验题(本题包括2小题,共8分) 13.(3.00分)如图是实验室制取气体的发生装置和气体收集装置。 回答下列问题: (1)用装置B和E制取氧气,其反应的化学方程式是 。 (2)现需要制取并收集一瓶氢气,在装置A、B、C、D、E中,应选择的装置组合是 。 (3)C、D、E、F都是实验室制取气体的收集装置,其中装置C和装置E不能用来收集二氧化碳,则不能用装置E的原因是 。 14.(5.00分)对比实验是化学研究中经常采用的方法。化学兴趣小组的同学在研究CO2通入NaOH溶液是否发生了反应,设计了下列二组实验。请和化学兴趣小组的同学一起探究并回答问题: 【设计与实验】 实验 序号 实验步骤一 实验步骤二 实验 序号 实验步骤一 实验步骤二 实验I 实验II 【探究与结论】 (1)实验I中步骤一看不到明显现象,步骤二产生的现象是 。 (2)实验Ⅱ中步骤二看到有白色沉淀析出,则发生反应的化学方程式是 。 (3)在实验Ⅱ的步骤一中CO2和NaOH溶液一定发生了化学反应,但却看不到明显的现象,原因是 。 【拓展延伸】现有下列信息: 请你和化学兴趣小组的同学一起利用以上料信息再设计实验Ⅲ,证明CO2确实与NaOH发生了化学反应。 实验Ⅲ的操作为: 。 看到的现象是 。 2018年湖北省黄冈市中考化学试卷 参考答案与试题解析 一、选择题(每小题只有一个选项符合题意.每小题2分,共16分) 1.(2.00分)下列四个事例中一定发生了化学变化的是( ) A.①② B.②③ C.③④ D.①④ 【分析】化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;据此分析判断。 【解答】解:①玻璃片上出现水珠过程中只是状态发生改变,没有新物质生成,属于物理变化。 ②大理石投入到稀盐酸中有新物质二氧化碳生成,属于化学变化。 ③自制汽水过程中有新物质碳酸生成,属于化学变化。 ④品红在水中扩散过程中没有新物质生成,属于物理变化。 故选:B。 【点评】本题难度不大,解答时要分析变化过程中是否有新物质生成,若没有新物质生成属于物理变化,若有新物质生成属于化学变化。 2.(2.00分)下列实验操作错误的是( ) A. 滴加液体 B. 点燃酒精灯 C. 称量反应物质量 D. 稀释浓硫酸 【分析】A、根据使用胶头滴管滴加少量液体的方法进行分析判断。 B、使用酒精灯时要注意“两查、两禁、一不可”。 C、根据托盘天平的使用要遵循“左物右码”的原则进行分析判断。 D、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断。 【解答】解:A、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作正确。 B、使用酒精灯时要注意“两查、两禁、一不可”,可用火柴点燃酒精灯,图中所示操作正确。 C、托盘天平的使用要遵循“左物右码”的原则,图中所示操作正确。 D、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;图中所示操作错误。 故选:D。 【点评】 本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键。 3.(2.00分)下列说法: ①二氧化硫和臭氧都是空气污染物; ②洁净的空气和水都是纯净物; ③因为水体有自净能力,所以生活污水可任意排放; ④降低可燃物的着火点是灭火的途径之一; ⑤烧碱和熟石灰的溶液都显碱性; ⑥复合肥中一定要含有氮、磷、钾三种元素;⑦如果将化合物按有机化合物和无机化合物两大类划分,则葡萄糖和尿素应属于有机化合物。 其中正确的是( ) A.①⑤⑦ B.①②④⑥ C.④⑤⑦ D.①②⑤⑥ 【分析】①根据空气的污染物解答,空气的污染物包括有害气体和粉尘,有害气体为二氧化硫、二氧化氮、一氧化、臭氧等进行分析; ②根据洁净的空气的成分进行分析; ③根据水体的自净能力时是有限的进行分析; ④根据着火点是物质的属性,不能降低或升高进行分析; ⑤根据氢氧化钠、氢氧化钙溶液含有的离子进行分析; ⑥根据复合肥的定义进行分析; ⑦根据有机化合物的概念进行分析。 【解答】解:①空气的污染物包括有害气体和粉尘,有害气体为二氧化硫、二氧化氮、一氧化、臭氧等,故说法正确; ②空气中含有氮气、氧气、稀有气体等,属于混合物,故说法错误; ③水体虽然有自净能力,但生活污水的任意排放,会严重污染水体,根本无法达到自净,故说法错误; ④着火点是物质的一种属性,一般不变,故说法错误; ⑤氢氧化钠、氢氧化钙在水溶液中会解离出氢氧根离子,所以,氢氧化钠、氢氧化钙溶液都显碱性,故说法正确; ⑥ 复合肥是含氮、磷、钾三种元素中的两种或两种以上的元素的肥料,故说法错误; ⑦葡萄糖和尿素都是含碳元素的化合物,属于有机化合物,故说法正确。 故选:A。 【点评】物质的分类最基础的化学知识之一,但却是学生学习的难点。学习时应正确理解概念,了解概念间的本质区别和联系。 4.(2.00分)小雨同学依据描述书写的化学符号: ①3个锌原子;3ZN; ②两个氢分子:2H2; ③两个氢氧根离子:2OH﹣; ④原子结构示意图对应的粒子:Mg2+; ⑤氯化亚铁的化学式:FeCl2; ⑥﹣2价的氧元素:O2﹣。 其中正确的有( ) A.②③⑤ B.①⑤⑥ C.②③④ D.①③⑤ 【分析】①原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字。 ②分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其分子符号前加上相应的数字。 ③离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。若表示多个该离子,就在其离子符号前加上相应的数字。 ④质子数=核外电子数=12,为原子,进行分析判断。 ⑤氯化亚铁中铁元素显+2价,氯元素显﹣1价,进行分析判断。 ⑥ 化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后。 【解答】解:①由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故3个锌原子表示为:3Zn,故书写错误。 ②由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其分子符号前加上相应的数字,则2个氢分子可表示为:2H2,故书写正确。 ③由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。若表示多个该离子,就在其离子符号前加上相应的数字,故2个氢氧根离子可表示为:2OH﹣,故书写正确。 ④质子数=核外电子数=12,为原子,其原子符号为Mg,故书写错误。 ⑤氯化亚铁中铁元素显+2价,氯元素显﹣1价,其化学式为FeCl2,故书写正确。 ⑥由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,﹣2价的氧元素可表示为,故书写错误。 故②③⑤书写正确。 故选:A。 【点评】本题难度不大,掌握常见化学用语(原子符号、分子符号、化学式、化合价、离子符号等)的书写方法、离子符号与化合价表示方法的区别等是正确解答此类题的关键。 5.(2.00分)一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是( ) 物质 甲 乙 丙 丁 反应前的质量/g 50 0.5 0 0 反应后的质量/g 23 x 24 3 A.x的值等于0.5 B.甲一定是化合物 C.丙和丁的质量变化比为8:1 D.该反应是化合反应 【分析】根据反应后质量增加的属于生成物,反应后质量减少的属于反应物,反应后质量不变可能属于催化剂,进行分析判断。 【解答】解:由表中数据分析可知,反应前后甲的质量减少了50g﹣23g=27g,故是生成物,生成的甲的质量为27g;同理可以确定丙是生成物,生成的丙的质量为24g﹣0g=24g;丁是生成物,生成的丁的质量为3g﹣0g=3g;由质量守恒定律,乙的质量不变,可能作该反应的催化剂,也可能没有参加反应。 A、乙的质量不变,则x的值等于0.5,故选项说法正确。 B、该反应的反应物为甲,生成物是丙和丁,符合“一变多”的特征,属于分解反应,甲是分解反应的反应物,一定是化合物,故选项说法正确。 C、丙和丁的质量变化比为24g:3g=8:1,故选项说法正确。 D、由B选项的分析,该反应是分解反应,故选项说法错误。 故选:D。 【点评】本题难度不大,考查的是质量守恒定律的应用,解题的关键是分析表中数据(反应后质量增加的属于生成物、质量减少的属于反应物),灵活运用质量守恒定律。 6.(2.00分)金属钨(W)可做白炽灯泡的灯丝。用黑钨矿[主要含有FeWO4(钨酸亚铁)]制得金属钨(W)的工艺流程如图所示: 其主要反应原理如下: ①4FeWO4+4Na2CO3+O24Na2WO4+2Fe2O3+4CO2 ②Na2WO4+2HCl(热浓)=H2WO4+2NaCl ③H2WO4H2O+WO3 ④3H2+WO3 W+3H2O 下列说法不正确的是( ) A.反应③属于分解反应 B.反应①②③④的产物都有氧化物 C.反应①④中有元素的化合价发生改变 D.为加快反应的速率,可将黑钨矿石碾成粉末 【分析】A、分解反应:一种物质反应后生成两种或两种以上的物质,其特点可总结为“一变多”。 B、氧化物是只含有两种元素且其中一种元素是氧元素的化合物。 C、根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,进行分析判断。 D、根据加快反应的速率,可以采用的增大接触面积方法,进行分析判断。 【解答】解:A、反应③是符合“一变多”的特征,属于分解反应,故选项说法正确。 B、反应①②③④的产物中,Na2WO4、H2WO4、W均属于氧化物,故选项说法错误。 C、反应①④,均有单质与化合物的转化,均有元素的化合价发生改变,故选项说法正确。 D、加快反应的速率,可以采用的增大接触面积方法,可将黑钨矿石碾成粉末,故选项说法正确。 故选:B。 【点评】本题难度不大,理解题意,掌握分解反应、氧化物的特征、化合价的原则等是正确解答本题的关键。 7.(2.00分)下列关于物质的组成、结构、性质及变化规律的总结,正确的是( ) A.C、CO、CO2组成中都含有碳元素,故参与反应时均具有碳的还原性 B.HCl和NaOH反应生成了盐和水,故有盐和水生成的反应都是复分解反应 C.酸溶液都含有H+,故酸都有相似的化学性质 D.浓H2SO4、NaOH都具有吸水性,故它们都能用来干燥二氧化碳气体 【分析】A.根据物质的性质来分析; B.根据复分解反应的概念来分析; C.根据酸具有通性的原因来分析; D.根据二氧化碳的性质来分析。 【解答】解:A.二氧化碳没有还原性,故错误; B.二氧化碳与氢氧化钠反应生成碳酸钠和水,虽然生成了盐和水,但并不符合“由两种化合物相互交换成分生成了两种新的化合物”的特点,不属于复分解反应,故错误; C.酸都有相似的化学性质是因为酸溶液中都含有H+,故正确; D.二氧化碳能与氢氧化钠反应生成碳酸钠和水,所以不能用氢氧化钠固体来干燥二氧化碳,故错误。 故选:C。 【点评】本考点考查的知识点较多,要加强记忆有关的知识点,并能够区分应用。本考点的基础性比较强,主要出现在选择题和填空题中。 8.(2.00分)一定质量的甲烷在不充足的氧气中燃烧,甲烷完全反应,生成物只有CO、CO2和H2O,且总质量为20.8g,其中H2O的质量为10.8g,则CO2的质量为( ) A.5.6g B.8.8g C.4.4g D.4.8g 【分析】化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。 【解答】解:甲烷中碳和氢元素的质量之比是12:4=3:1;所以甲烷的质量应该是氢元素质量的4倍, 则生成物中氧元素的质量为:20.8g﹣10.8g××4=16g, 设二氧化碳的质量是x, 根据题意有:x×+(20.8g﹣10.8g﹣x)×+10.8g×=16g, x=4.4g, 故选:C。 【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。 二、填空简答题(本题包括3小题,共13分) 9.(4.00分)化学基础与常识 (1)图1金属应用的实例,主要利用金属的导热性的是 B (填序号); (2)向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,反应前后溶液中存在的离子种类如图2所示(其中其中表示不同离子)。则“”与“”反应生成了 水 (填物质名称)。 (3)氢氟酸(HF)能刻画玻璃,其中有一个化学反应的化学方程式是:CaSiO3+6HF=X+SiF4↑+3H2O,则X的化学式为 CaF2 (4)氢能是一种极具发展潜力的清洁能。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图3所示。写出反应I中,发生反应的化学方程式: SO2+I2+2H2O=H2SO4+2HI 。 【分析】(1)根据金属的性质与用途来分析; (2)根据题意,向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,氢氧化钠与稀盐酸反应生成氯化钠和水,反应的实质是氢离子结合氢氧根离子生成水分子,进行分析解答; (3)根据质量守恒定律来分析; (4)根据反应I为二氧化硫、水与碘发生反应生成硫酸和HI进行分析。 【解答】解:(1)A.金属制成电缆主要是利用了金属的导电性; B.电热壶主要是利用了金属的导热性; C.金属丝主要是利用了金属的延展性; D.金属乐器主要是利用了金属的耐腐性和特殊光泽; 故选:B; (2)氢氧化钠与稀盐酸反应生成氯化钠和水,中和反应的实质是氢离子和氢氧根离子结合生成水分子,由反应前后溶液中存在的离子种类图,此反应的实质是和结合生成水分子,故填:水; (3)由质量守恒定律可知,化学反应前后,原子的种类与数目保持不变,反应前:1个钙原子、1个硅原子、3个氧原子、6个氢原子、6个氟原子;反应后:1个硅原子、4个氟原子、6个氢原子、3个氧原子,所以X中含有1个钙原子和2个氟原子,其化学式为CaF2;故填:CaF2; (4)由图可知,反应I为二氧化硫、水与碘发生反应生成硫酸和HI,化学方程式为:SO2+2H2O+I2=H2SO4+2HI;故填:SO2+I2+2H2O=H2SO4+2HI。 【点评】本题难度不大,掌握中和反应的实质(氢离子结合氢氧根离子生成水分子)并能灵活运用是正确解答本题的关键。 10.(5.00分)化学就在我们身边,请用所学化学知识回答下列问题。 (1)金刚石和石墨都是由碳元素组成的单质,但是由于 它们碳原子的排列方式不同 ,因此它们的物理性质存在着较大差异; (2)用一氧化碳和磁铁矿石(主要成分是Fe3O4)炼铁,其反应的化学方程式是 Fe3O4+4CO3Fe+4CO2 ; (3)用盐酸除去自行车钢圈上的铁锈,其反应的化学方程式是 6HCl+Fe2O3=2FeCl3+3H2O ; (4)铝制品形成致密保护膜的化学方程式是 4Al+3O2=2Al2O3 ; (5)氢化镁(MgH2)是一种贮氢合金,当它与H2 O混合时释放出氢气,同时生成一种碱,该反应的化学方程式是 MgH2+2H2O=Mg(OH)2+2H2↑ 。 【分析】(1)根据金刚石和石墨的碳原子的排列方式不同解答; (2)根据反应原理,写出反应的化学方程式解答; (3)根据金属氧化物和酸反应会生成盐和水进行分析; (4)根据铝与氧气作用生成氧化铝解答; (5)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可。 【解答】解: (1)金刚石和石墨都是由碳元素组成的单质,但是由于它们碳原子的排列方式不同,因此它们的物理性质存在着较大差异; (2)用一氧化碳和磁铁矿石(主要成分是Fe3O4)炼铁,其反应的化学方程式是Fe3O4+4CO 3Fe+4CO2; (3)铁锈的主要成分是氧化铁,氧化铁和酸反应会生成盐和水,用盐酸除去自行车钢圈上的铁锈,其反应的化学方程式是:6HCl+Fe2O3=2FeCl3+3H2O; (4)铝与氧气作用生成氧化铝,其反应的化学方程式是:4Al+3O2=2Al2O3。 (5)氢化镁(MgH2)是一种贮氢合金,当它与H2O混合时释放出氢气,同时生成一种碱,该反应的化学方程式是:MgH2+2H2O=Mg(OH)2+2H2↑ 答案: (1)它们碳原子的排列方式不同; (2)Fe3O4+4CO 3Fe+4CO2 (3)6HCl+Fe2O3=2FeCl3+3H2O; (4)4Al+3O2=2Al2O3。 (5)MgH2+2H2O=Mg(OH)2+2H2↑ 【点评】本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等。 11.(4.00分)甲、乙、丙三种物质的转化关系如图所示(“→”表示反应能一步实现,部分反应物、生成物和反应条件均已略去),请回答下列问题。 (1)若乙是最常用的溶剂,丙是单质,则甲可能是 H2O2 (填化学式); (2)若甲是一种黑色固体,乙和丙是组成元素相同的两种气体,写出丙→乙转化的化学方程式 CO2+C2CO ; (3)若甲是纯碱,乙是一种常见的温室气体,则丙可能是 CaCO3 (填化学式),写出乙→丙转化的化学方程式 Ca(OH)2+CO2═CaCO3↓+H2O 。 【分析】根据题干提供的信息进行结合题目要求分析解答,常用的溶剂是水,黑色固体碳能生成两种组成元素相同的气体,二氧化碳是常见的温室气体,据此解答。 【解答】解:(1)乙是最常用的溶剂,丙是单质,则甲可以是过氧化氢,故填:H2O2; (2)黑色固体碳能生成两种组成元素相同的气体一氧化碳和二氧化碳,丙→乙可以是二氧化碳和碳高温反应生成一氧化碳,故填:CO2+C 2CO; (3)甲是纯碱,乙是一种常见的温室气体,则乙是二氧化碳,丙可以是碳酸钙,氢氧化钙能与二氧化碳反应生成碳酸钙沉淀和水,故填:CaCO3;Ca(OH)2+CO2═CaCO3↓+H2O。 【点评】在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。 三、计算题(本题包括1小题,共3分) 12.(3.00分)为测定某石灰石矿中碳酸钙的含量,现称取12.5g石灰石矿样品与足量的稀盐酸反应(杂质不溶于水,也不参与反应),得到二氧化碳气体4.4g(假设生成的气体全部逸出)。请计算:该石灰石样品含CaCO3的质量分数? 【分析】碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,根据二氧化碳质量可以计算碳酸钙质量,进一步可以计算该石灰石样品中碳酸钙的质量分数。 【解答】解:设该石灰石样品含CaCO3的质量为x。 CaCO3+2HCl=CaCl2+H2O+CO2↑ 100 44 x 4.4g x=10g 该石灰石样品含CaCO3的质量分数==80% 答:该石灰石样品含CaCO3的质量分数为80%。 【点评】本题主要考查了化学方程式的计算,难度不大,注意解题的规范性。 四、探究与实验题(本题包括2小题,共8分) 13.(3.00分)如图是实验室制取气体的发生装置和气体收集装置。 回答下列问题: (1)用装置B和E制取氧气,其反应的化学方程式是 2KC1O32KC1+3O2↑ 。 (2)现需要制取并收集一瓶氢气,在装置A、B、C、D、E中,应选择的装置组合是 AC(或AE) 。 (3)C、D、E、F都是实验室制取气体的收集装置,其中装置C和装置E不能用来收集二氧化碳,则不能用装置E的原因是 二氧化碳能溶于水且可与水反应 。 【分析】(1)根据装置的特点来分析解答; (2)根据反应物的状态与反应条件来确定制取装置,根据气体的性质来确定收集方法; (3)根据二氧化碳的性质来分析。 【解答】解:(1)装置B适用于固体加热制取氧气,因为试管口没有棉花团,所以是加热氯酸钾与二氧化锰的混合物来制取氧气,同时生成氯化钾;故填:2KC1O32KC1+3O2↑; (2)在实验室中常用锌粒与稀硫酸反应来制取气体,属于固液常温型,所以选择装置A来制取;氢气的密度比空气小,难溶于水,所以可用向下排空气法来收集氢气,也可以用排水法来收集;故填:AC(或AE); (3)二氧化碳能溶于水,并与水反应,所以不能用排水法来收集二氧化碳;故填:二氧化碳能溶于水且可与水反应。 【点评】本题考查了常见气体的制取装置、收集方法等的选择,并在此基础上进行拓展,难度不大,关键是明确发生装置、收集方法选择的依据,并熟练书写反应的方程式。 14.(5.00分)对比实验是化学研究中经常采用的方法。化学兴趣小组的同学在研究CO2通入NaOH溶液是否发生了反应,设计了下列二组实验。请和化学兴趣小组的同学一起探究并回答问题: 【设计与实验】 实验 序号 实验步骤一 实验步骤二 实验 序号 实验步骤一 实验步骤二 实验I 实验II 【探究与结论】 (1)实验I中步骤一看不到明显现象,步骤二产生的现象是 有气泡冒出 。 (2)实验Ⅱ中步骤二看到有白色沉淀析出,则发生反应的化学方程式是 CaCl2+Na2CO3=CaCO3↓+2NaCl 。 (3)在实验Ⅱ的步骤一中CO2和NaOH溶液一定发生了化学反应,但却看不到明显的现象,原因是 CO2与NaOH溶液反应生成易溶于水的Na2CO3 。 【拓展延伸】现有下列信息: 请你和化学兴趣小组的同学一起利用以上料信息再设计实验Ⅲ,证明CO2确实与NaOH发生了化学反应。 实验Ⅲ的操作为: 把二氧化碳通入氢氧化钠的酒精溶液中 。 看到的现象是 有白色沉淀生成 。 【分析】由题目的信息可知,【探究与结论】(1)实验I中步骤一看不到明显现象,步骤二产生的现象是:有气泡冒出; (2)实验Ⅱ中步骤二看到有白色沉淀析出,是因为碳酸钠与氯化钙反应生成碳酸钙白色沉淀和氯化钠,配平即可; (3)在实验Ⅱ的步骤一中CO2和NaOH溶液一定发生了化学反应,但却看不到明显的现象,原因是:CO2与NaOH溶液反应生成易溶于水的Na2CO3; 【拓展延伸】实验Ⅲ的操作为:把二氧化碳通入氢氧化钠的酒精溶液中,有白色沉淀生成,证明CO2确实与NaOH发生了化学反应; 【解答】解:【探究与结论】(1)实验I中步骤一看不到明显现象,步骤二产生的现象是:有气泡冒出,因为碳酸钠和盐酸反应生成了二氧化碳;故答案为:有气泡冒出; (2)实验Ⅱ中步骤二看到有白色沉淀析出,是因为碳酸钠与氯化钙反应生成碳酸钙白色沉淀和氯化钠,配平即可;故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl; (3)在实验Ⅱ的步骤一中CO2和NaOH溶液一定发生了化学反应,但却看不到明显的现象,原因是:CO2与NaOH溶液反应生成易溶于水的Na2CO3;故答案为:CO2与NaOH溶液反应生成易溶于水的Na2CO3; 【拓展延伸】实验Ⅲ的操作为:把二氧化碳通入氢氧化钠的酒精溶液中,有白色沉淀生成,证明CO2确实与NaOH发生了化学反应;故答案为:把二氧化碳通入氢氧化钠的酒精溶液中;有白色沉淀生成; 【点评】实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等。本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究。同学们要具体分析,综合掌握。 查看更多