- 2021-05-10 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考科学知识点总结化学部分
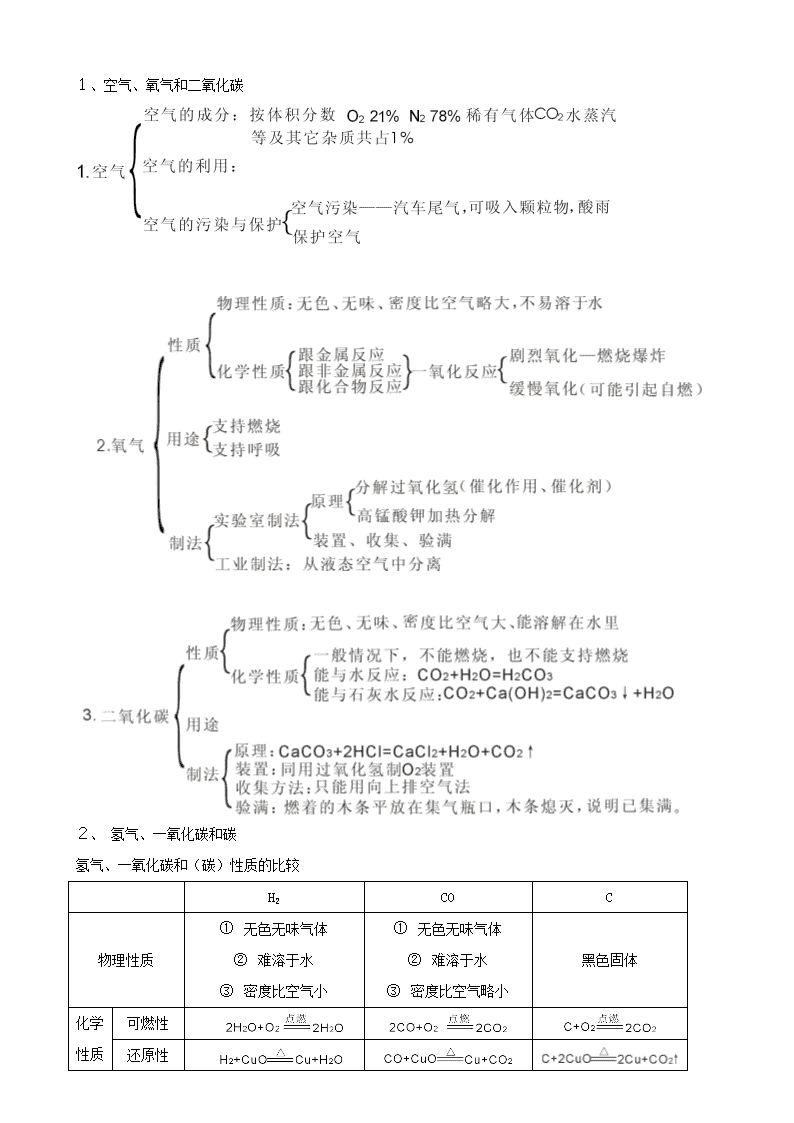
中考科学化学部分知识点复习 第三册第一章 1、 溶液、悬浊液、乳浊液及其特征 (1)联系:溶液,悬浊液,乳浊液都是混合物。 (2)区别:溶液是一种或一种以上的物质分散到另一种物体中形成均一、稳定的混合物。 悬浊液是不溶性固体分散到液体中形成的,过后会分层,不均一,不稳定。 乳浊液是互不相溶的液体混合而成,会分层,不稳定,不均一。 2、溶液的电离 (1)电离:物质涉于水或受热熔化而离解成自由移动离子的过程 (2)电离方程式:1.书写 2.电荷守恒 3、溶解度 (1)物质溶解性的大小用溶解度来量度。 (2)固体物质的溶解度:在一定温度下,溶质在100克溶剂里达到饱和状态时所溶解的质量(克).完整理解此概念要抓住四要素: ① 条件——“在一定温度下”.因为温度不同,溶解度大小不同. ② 标准——“在100克溶剂里(一般指水)”.因为一定温度下,物质溶解的多少与溶剂的量成正比. ③ 状态——“达到饱和状态”.指溶质溶解达到了最大值. ④ 单位——“溶解的质量(克)”.溶解度的单位是克,不是度(°)或千克等. (3)影响固体溶解度大小的因素 ① 溶质、溶剂本身的性质.同一温度下溶质、溶剂不同,溶解度不同. ② 温度:大多数固态物质的溶解度随温度升高而增大,如KNO3;有些物质的溶解度受温度影响不大,如NaCL;极少数物质的溶解度随温度升高而减小,如熟石灰。 (4)溶解性等级:易溶、可溶、微溶、难溶 根据物质在室温(20℃)时的溶解度,将它们在水中的溶解性(S表示溶解度)分成四个等级。 20℃,S 大于10克 10~1克 1~0.01克 小于0.01克 溶解性等级 易溶 可溶 微溶 难溶 溶解度表(会查看). 溶解度曲线代表的意义: ①点 曲线上的点:表示某物质在对应温度下的溶解度. 两曲线的交点:表示两物质在交点所示的温度下的溶解度相等. ②线:表示物质在不同温度下的溶解度或溶解度随着温度改变而变化的情况. 曲线上面:表示溶液为饱和溶液. ③ 面: 曲线下面:表示溶液为不饱和溶液. 4、溶质的质量分数 (1)基本公式 (a)溶质的质量分数 (b)饱和溶液中溶质的质量分数 (2)常见计算类型 (a0溶液的稀释和浓缩 ——浓溶液质量 ——稀溶液质量 ——浓溶液质量分数 ——稀溶液质量分数 (b)相同溶质不同质量分数的两种溶液混合 (c)溶液体积、质量、密度三者之间的关系:溶液质量=溶液体积×溶液密度 (3)配制一定溶质质量分数的溶液 (a)实验仪器:天平、玻璃棒、量筒、药匙、烧杯(胶头滴管) (b)实验步骤:①计算 ②称重 ③溶解 第四册第一章 1、分子、原子、离子、元素、物质之间的联系和比较: 1、 物质的构成 (1)原子的构成 夸克 (2)在原子中有如下关系: ① 核电荷数=质子数=核外电子数 ② 相对原子质量≈质子数+中子数 ③ 元素的种类由原子核内质子数目决定 ④ 元素的化学性质由最外层电子数决定 ⑤ 元素的化合价由最外层电子数决定 第四册第二章 1、空气、氧气和二氧化碳 2、 氢气、一氧化碳和碳 氢气、一氧化碳和(碳)性质的比较 H2 CO C 物理性质 ① 无色无味气体 ② 难溶于水 ③ 密度比空气小 ① 无色无味气体 ② 难溶于水 ③ 密度比空气略小 黑色固体 化学性质 可燃性 还原性 有无毒性 无毒性 有剧毒 无毒性 3、 化学用语 1.表示某一种元素 (1)元素符号表达的意义 2.表示该种元素的一个原子 (2)分子式的意义 (a)表示一种物质; (b)表示这种物质的一个分子; (c)表示组成物质的各种元素; (d)表示每个分子里各元素的原子个数. 常见元素、原子团的化合价 (3)化学式的书写 根据化合价写出化学式 根据化学式判定化合价 (4)质量守恒定律 (a)内容:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。 (b)微观解释:反应前后原子的种类不变,原子的数目没有增减。 (5)根据化学方程式的计算. 第五册第一章 1、 物质分类 2、混合物与纯净物比较 混合物 纯净物 区 别 ①宏观组成:由两种或两种以上物质组成②微观组成:由构成不同物质的微粒构成③无固定组成,无固定性质④各物质保持其原来的性质 ①宏观组成:由同种物质组成②微观组成:由构成同种物质的微粒构成③有固定组成,有固定性质④各成分不保持其原有的性质 联系 3、单质和化合物 单 质 化 合 物 概念 由同种元素组成的纯净物 由不同种元素组成的纯净物 分 类 金属、非金属、稀有气体 无机化合物:酸、碱、盐、氧化物 有机化合物如:CH4、C2H5OH等 联 系 4、酸、碱、盐、氧化物的分类和命名 概念 分类 命名 氧化物 由两种元素组成,其中一种是氧元素的化合物 金属氧化物 按组成元素 非金属氧化物 ① 氧化某 ② 几氧化几某 ③ 氧化亚某 酸 电离时生成的阳离子全部是H+的化合物 含氧酸 ① 按是否含有氧元素 无氧酸 一元酸 ② 按酸分子电离子生成H+个数 二元酸 多元酸 难挥发性酸 ③按挥发性 挥发性 ① 无氧酸:氢酸某 ② 含氧酸:某酸 碱 电离时生成的阴离子全部是OH-的化合物 可溶性碱 按溶解性 不溶性碱 ① 氢氧化某 ② 氢氧化亚某 盐 由金属离子和酸根离子组成的化合物 正盐 含氧酸盐 酸式盐 碱式盐 某酸某或某化某 某酸氢某或酸式某酸某 碱式某酸某或碱式某化某 5、各物质间的相互反应 各物质间相互反应图(找书上的图自己画上去) (1)此关系可归纳为“两纵两边四横线,两组相交对角线,纵向物质可转化,横向作用可成盐。”四条横线和两组交叉线及两条边线表示了十大成盐关系。其中两条边线的成盐是置换反应,四条横线恰好是矛盾的双方,交叉成的反应是酸、碱、盐及氧化物的性质。 (2)各类物质关系图的应用 (a)可以看出各类物质的相互转变关系,此类关系即图中的“两边关系”。 (b)可以看出各类物质的主要化学性质。图中的反应就是从“八圈”出来的箭头。如碱这个圈中有三个指出来的箭头,就说明碱的主要化学性质有三条。 (c)可以推导出制取某物质的可能途径。即“八圈”和“七方”的箭头指入部分。具体可看出碱有两种制法,酸有三种制法,盐有十种制法。 应该注意的是以上三个方向并不是孤立的,而是有着密切联系,如金属氧化物→碱,表示金属氧化物可以转变成碱(可溶性碱);也可以看成是金属氧化物的一种化学性质,而对应于碱来说,则是碱的一种制取途径。另外,各类物质的相互关系是在一定条件下的一般规律,切不可生搬硬套,具体应用时要引起注意。 第五册第二章 1、常见的材料和材料的发展查看更多