- 2021-05-10 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届中考化学复习 第十讲 酸和碱学案
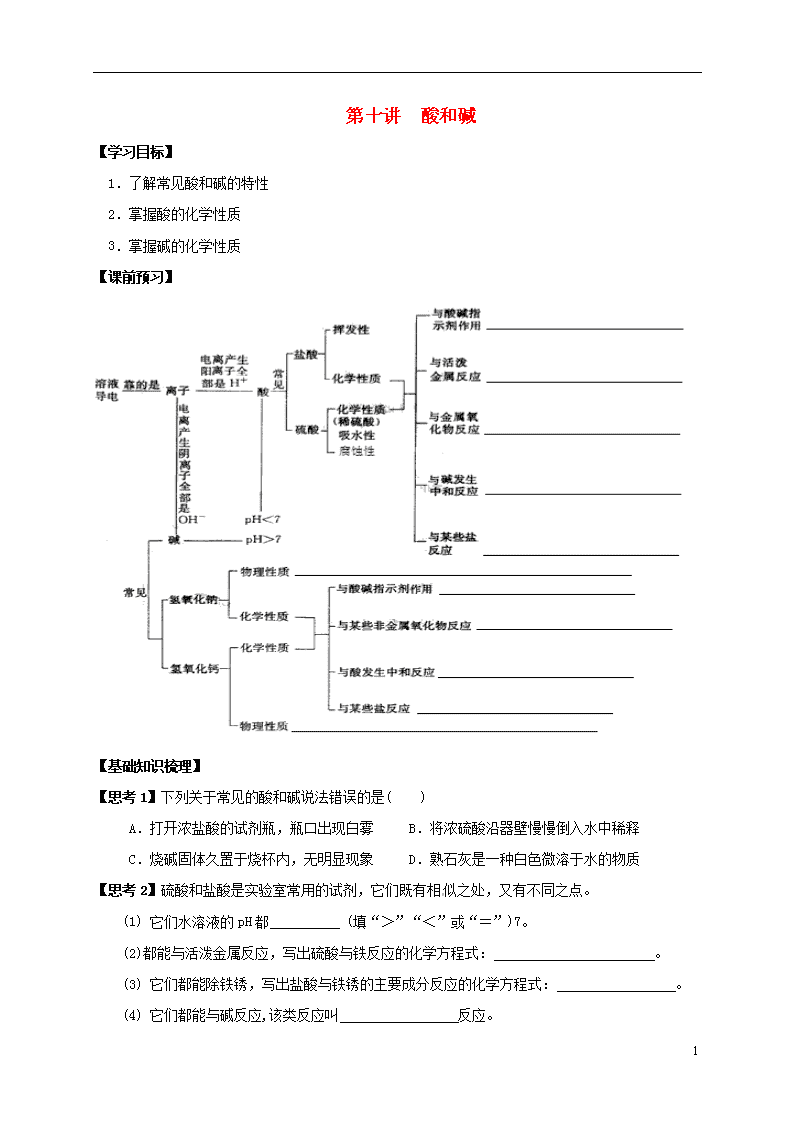
第十讲 酸和碱 【学习目标】 1.了解常见酸和碱的特性 2.掌握酸的化学性质 3.掌握碱的化学性质 【课前预习】 【基础知识梳理】 【思考1】下列关于常见的酸和碱说法错误的是( ) A.打开浓盐酸的试剂瓶,瓶口出现白雾 B.将浓硫酸沿器壁慢慢倒入水中稀释 C.烧碱固体久置于烧杯内,无明显现象 D.熟石灰是一种白色微溶于水的物质 【思考2】硫酸和盐酸是实验室常用的试剂,它们既有相似之处,又有不同之点。 (1) 它们水溶液的pH都 (填“>”“<”或“=”)7。 (2)都能与活泼金属反应,写出硫酸与铁反应的化学方程式: 。 (3) 它们都能除铁锈,写出盐酸与铁锈的主要成分反应的化学方程式: 。 (4) 它们都能与碱反应,该类反应叫 反应。 6 (5) 写出把硫酸转化为盐酸的化学方程式: 。 【思考3】根据学习碱的化学性质,完成下列问题。 (1) 碱溶液能使无色酚酞溶液变 。 (2) 氢氧化钠暴露在空气中变质的化学方程式为 , 所以氢氧化钠必须 保存。 (3) 向烧杯中的硫酸铜溶液中滴加氢氧化钠溶液,反应的现象是 。 (4) 碱溶液有相似的化学性质,是因为碱溶液中都含有 。 【典型问题分析】 例1:如图是物质之间发生化学反应的颜色变化。 (1)请你在编号②、③处各填入一种物质, ②是 ;③是 ; (2)根据上图总结出稀硫酸的五个化学性质, 请写出编号①稀硫酸的化学性质 ; (3)若编号④的物质是碱,请你写出符合编号 ④的一个化学方程式: 。 例2:为验证CO2与NaOH能够发生反应,某同学按图组装实验装置,并进行实验。 (1)观察到的现象是“气球先膨胀,后变瘪”,则加入试剂的顺序应该是 。 A.先加盐酸,再加氢氧化钠溶液 B.先加氢氧化钠溶液,再加盐酸 (2)请解释气球“先膨胀”的原因: _____________________________________________。 (3)写出气球“后变瘪”的化学方程式: ______________________________________________。 例3:利用数字化传感器测得硫酸和氢氧化钾溶液反应时烧杯中溶液pH的变化图像如图。下列说法正确的是( ) A.图中c点所示溶液呈碱性 B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4 C.由b点到c点的变化过程中没有发生化学反应 D.该实验是将氢氧化钾溶液逐滴入盛有硫酸的烧杯中 6 【课堂小结】 【课后作业】 1.物质存放在烧杯中一段时间后,质量变大且变质的是( ) ① 浓盐酸 ② 浓硫酸 ③ 烧碱 ④ 生石灰 ⑤ 澄清石灰水 A.③④⑤ B.②③④⑤ C.①②③④⑤ D.④⑤ 2.下列物质常用于改良酸性土壤的是( ) A.熟石灰 B.烧碱 C.食盐 D.大理石 3.向一定质量的甲中逐渐加入乙至过量,此过程中溶液的溶质总质量与加入乙的质量之间的关系,能用如图曲线表示的是( ) 选 项 甲 乙 A 稀硫酸 氢氧化钠溶液 B 稀盐酸 碳酸钙粉末 C 稀盐酸 锌 粒 D 硝酸银溶液 铜 粉 4.下列食物的近似pH如下,其中酸性最强的是( ) A.柠檬汁:2.2~2.4 B.番茄汁:4.0~4.4 C.牛奶:6.3~6.6 D.鸡蛋清:7.6~8.0 5.厕所清洁剂的主要成分是盐酸,炉具清洁剂的主要成分是氢氧化钠。关于这两种清洁剂的叙述正确的是( ) A.测得厕所清洁剂的pH=13 B.测得炉具清洁剂的pH=1 C.厕所清洁剂能使紫色石蕊溶液变蓝 D.炉具清洁剂能使无色酚酞溶液变红 6.硫酸是工农业生产中使用非常广泛的一种试剂,实验室用质量分数为 98%的浓硫酸(密度为 1.84 g/cm3)配制49 g质量分数为 20%的硫酸。 (1)经计算,所用水的质量为________g,所需 98%的浓硫酸的体积约为________mL。 6 (2) 量取上述体积的浓硫酸所选用的仪器为________(填选项)。 A.10 mL 量筒 B.100 mL 烧杯 C.100 mL 量筒 D.胶头滴管 (3) 稀释浓硫酸时,将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,并___________________。 (4) 如果不慎将浓硫酸沾到皮肤上,应立即_______________,然后涂上 3%的小苏打溶液。 7.化学课上,小亮与老师一起演示了如图所示的实验: 请回答下列问题。 (1) 甲中铜加热时因生成了氧化铜而变黑,该变化属于________(填“物理”或“化学”)变化。 (2) 小亮将变黑的铜丝a伸入试管内的稀硫酸中,再取出时,铜丝表面又变红了,试管内发生反应的化学方程式是 ,该反应属于基本反应类型中的________反应。 (3) 老师将加热变黑的铜丝b趁热迅速伸入试管内的活性炭中,再取出时,铜丝表面也变红了,则试管内活性炭的质量一定会________(填“增大”或“减小”)。 8.氧化钙俗名生石灰,某同学针对氧化钙设计了如下实验方案: (1) A中发生反应的化学方程式为 。分离B中难溶物的操作Ⅰ叫________。 (2) 如果要用实验证明C中不是水而是一种溶液,可以选择下列________(填序号)进行实验。 ① 稀盐酸 ② 酚酞溶液 ③ 二氧化碳 ④ 氯化钠溶液 (3) 操作Ⅱ是加入某种物质使无色澄清液出现白色固体,如果加入的是饱和碳酸钠溶液,白色固体的化学式是________;如果加入的是固体氢氧化钠(全部溶解),白色固体的化学式是 。 9.某植物的花瓣汁液(以下简称X汁液)呈紫色,X汁液分别滴加到盛有下列液体的试管中有如下现象: 液体名称 白醋 稀盐酸 氯化钠溶液 蒸馏水 石灰水 氢氧化钾溶液 6 X汁液 红色 红色 紫色 紫色 绿色 绿色 (1) 据上表推测,X汁液________(填“能”或“不能”)做酸碱指示剂。 (2) 将X汁液滴入肥皂水中溶液呈绿色,则肥皂水显________(填“酸”“碱”或“中”)性,pH_____(填“>”“<”或“=”)7。 (3) 粗略测定雨水的酸碱度可使用________。 10.室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入盐酸的质量变化的曲线如图所示: (1) 由图可知,盐酸与氢氧化钠溶液的中和反应是________(填 “吸热”“放热”或“无热量变化”)反应。 (2) 在A处溶液中加入石蕊,溶液呈________色。 (3) B处溶液的溶质是________(填化学式)。 (4) B到C的过程中溶液的pH逐渐_______(填“增大”“减小”或“无变化”)。 (5) 在C点溶液中加入碳酸钙,现象为_____________,化学方程式为____________________。 11.在学习酸的化学性质后,同学们做了如图所示的两个实验。 (1) A试管中发生反应的化学方程式:__________________________。 向B试管中加入足量的稀硫酸,观察到的现象是_______________。 (2) 实验结束后,小红将A、B两试管中的废液倒入同一洁净的烧杯中, 片刻后发现烧杯中出现了红褐色沉淀,经分析,红褐色沉淀是氢氧化 铁。小红将烧杯中物质进行过滤得到无色滤液,滤液中含有什么溶质? 小红、小军对此进行探究。 【实验讨论】 ① 小红分析了反应物和生成物之后,认为滤液中不可能有H2SO4,因为__________________。 ② 小军认为滤液中不可能有Fe2(SO4)3,理由是______________________________________。 【提出猜想】 猜想Ⅰ:Na2SO4、NaOH;猜想Ⅱ:________________。 【设计实验】 实验操作 实验现象 结 论 取少量滤液于试管中,向其中滴加酚酞溶液 猜想Ⅰ成立 6 1.B;2.A;3.D;4.A;5.D; 6.39g 5.4mL AD 用玻璃棒不断搅拌 用大量水冲洗 7.化学 CuO+H2SO4===CuSO4+H2O 复分解 减小 8.CaO+H2O===Ca(OH)2 过滤 ②③ CaCO3 Ca(OH)2 9.能 碱 > pH试纸 10.放热 蓝色 NaCl 减小 有气泡产生 CaCO3+2HCl===CaCl2+H2O+CO2↑ 11.2NaOH+H2SO4===Na2SO4+2H2O 红棕色固体逐渐溶解至消失,溶液由无色变为黄色 烧杯中生成的氢氧化铁沉淀不能与硫酸共存 过滤得到无色滤液,而Fe2(SO4)3溶液呈黄色 Na2SO4 酚酞溶液由无色变为红色 6查看更多