- 2022-04-09 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高中化学第1章第1节第1课时化学反应的反应热学案(含解析)鲁科版
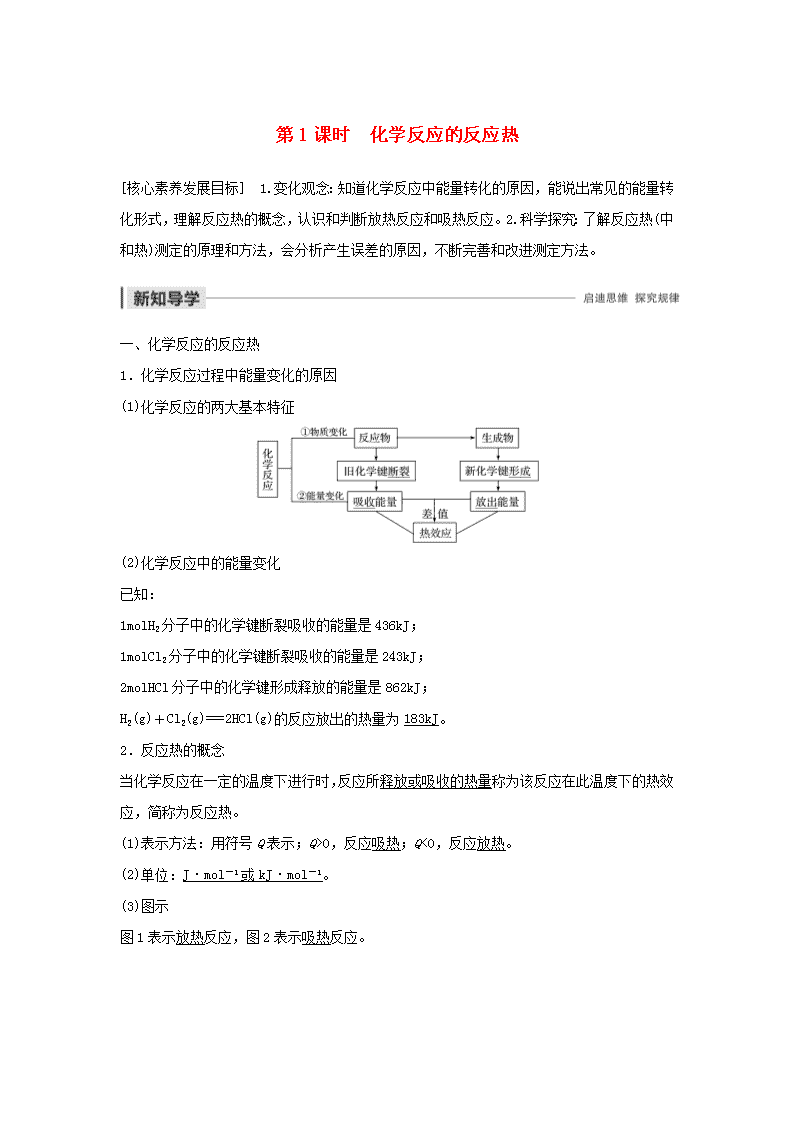
第1课时 化学反应的反应热[核心素养发展目标] 1.变化观念:知道化学反应中能量转化的原因,能说出常见的能量转化形式,理解反应热的概念,认识和判断放热反应和吸热反应。2.科学探究:了解反应热(中和热)测定的原理和方法,会分析产生误差的原因,不断完善和改进测定方法。一、化学反应的反应热1.化学反应过程中能量变化的原因(1)化学反应的两大基本特征(2)化学反应中的能量变化已知:1molH2分子中的化学键断裂吸收的能量是436kJ;1molCl2分子中的化学键断裂吸收的能量是243kJ;2molHCl分子中的化学键形成释放的能量是862kJ;H2(g)+Cl2(g)===2HCl(g)的反应放出的热量为183kJ。2.反应热的概念当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称为反应热。(1)表示方法:用符号Q表示;Q>0,反应吸热;Q<0,反应放热。(2)单位:J·mol-1或kJ·mol-1。(3)图示图1表示放热反应,图2表示吸热反应。n(1)反应热与化学键断裂与形成的关系Q=断裂反应物化学键吸收的总能量(E1)-形成反应产物化学键放出的总能量(E2)①若E1>E2,则Q>0,为吸热反应。②若E1查看更多