2019高中化学第二章化学反应的方向、限度与速率2.2.2反应条件对化学平衡的影响精练鲁科版
反应条件对化学平衡的影响A组 1.对平衡CO2(g)CO2(aq) ΔH=-19.75kJ·mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )A.升高温度、增大压强B.降低温度、减小压强C.升高温度、减小压强D.降低温度、增大压强解析:气体在水中的溶解度随着温度的升高而降低,所以要使CO2在水中的溶解度增大,可以降低温度,同时还可增大压强。答案:D2.下列不同条件下的化学反应:A(aq)+B(aq)C(aq)+D(aq),反应速率由大到小的顺序正确的是( )①常温下20mL溶液含A和B各0.001mol②常温下100mL溶液含A和B各0.01mol③常温下0.05mol·L-1A、B溶液各10mL混合后,再加水20mL④常温下将100mL含A0.001mol和20mL含B0.001mol混合溶液混合A.①②③④B.②③④①C.②①③④D.②④①③解析:A、B的浓度越大,反应速率越大。浓度/(mol·L-1)①②③④A0.050.10.0250.0083B0.050.10.0250.0083答案:C3.COCl2(g)CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施能提高COCl2转化率的是( )①升高温度 ②恒容通入惰性气体 ③增加CO浓度 ④减小压强 ⑤加催化剂 ⑥恒压通入惰性气体A.①②④B.①④⑥C.②③⑤D.③⑤⑥n解析:能提高反应物转化率的方法是在不改变反应物起始量的条件下使化学平衡正向移动,①升高温度向吸热方向即正向移动,②恒容通入惰性气体,各组分浓度不变,平衡不移动,③增加CO浓度使平衡逆向移动,④减小压强使平衡正向移动,⑤催化剂不影响平衡,⑥恒压通入惰性气体,参与反应的各组分分压减小,平衡正向移动,故①④⑥符合题意。答案:B4.碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)WI2(g) ΔH<0(温度T1
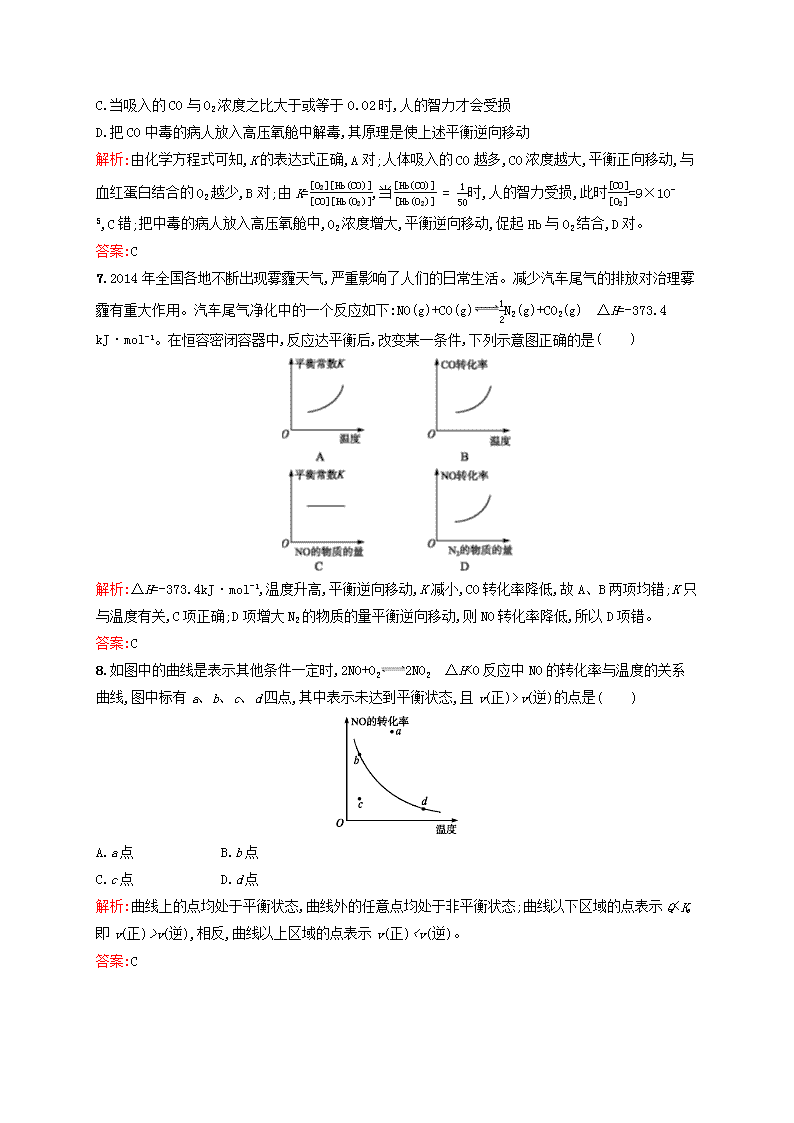
乙B.甲=乙C.甲<乙D.无法确定解析:该反应是气态物质系数减小的反应,建立平衡的过程中气体的物质的量减少,故乙容器建立平衡的过程中活塞向下移动。乙容器建立的平衡可以看作是在甲容器平衡的基础上压缩容器的容积,平衡正向移动,C的体积分数增大,故C项符合题意。答案:C6.人体血液内的血红蛋白(Hb)易与O2结合生成Hb(O2),因此具有输氧能力,CO吸入肺中发生反应:CO+Hb(O2)O2+Hb(CO),37℃时,该反应的平衡常数K=220。Hb(CO)的浓度达到Hb(O2)浓度的150,会使人智力受损。据此,下列结论错误的是( )A.CO与Hb(O2)反应的平衡常数K=[O2][Hb(CO)][CO][Hb(O2)]B.人体吸入的CO越多,与血红蛋白结合的O2越少nC.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损D.把CO中毒的病人放入高压氧舱中解毒,其原理是使上述平衡逆向移动解析:由化学方程式可知,K的表达式正确,A对;人体吸入的CO越多,CO浓度越大,平衡正向移动,与血红蛋白结合的O2越少,B对;由K=[O2][Hb(CO)][CO][Hb(O2)],当[Hb(CO)][Hb(O2)]=150时,人的智力受损,此时[CO][O2]=9×10-5,C错;把中毒的病人放入高压氧舱中,O2浓度增大,平衡逆向移动,促起Hb与O2结合,D对。答案:C7.2014年全国各地不断出现雾霾天气,严重影响了人们的日常生活。减少汽车尾气的排放对治理雾霾有重大作用。汽车尾气净化中的一个反应如下:NO(g)+CO(g)12N2(g)+CO2(g) ΔH=-373.4kJ·mol-1。在恒容密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是( )解析:ΔH=-373.4kJ·mol-1,温度升高,平衡逆向移动,K减小,CO转化率降低,故A、B两项均错;K只与温度有关,C项正确;D项增大N2的物质的量平衡逆向移动,则NO转化率降低,所以D项错。答案:C8.如图中的曲线是表示其他条件一定时,2NO+O22NO2 ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )A.a点B.b点C.c点D.d点解析:曲线上的点均处于平衡状态,曲线外的任意点均处于非平衡状态;曲线以下区域的点表示Qv(逆),相反,曲线以上区域的点表示v(正)”“<”或“无法确定”)实验Ⅰ。 解析:根据题图可知,实验Ⅰ、Ⅱ起始时和达到平衡时A的浓度均相同,可知实验Ⅱ使用了催化剂(若为加压,则A的浓度将增大)。由实验Ⅲ与实验Ⅰ相比,可知升高温度后A的浓度减小,即化学平衡正向移动,故正反应为吸热反应。增加反应物浓度,化学反应速率增大。答案:(1)实验Ⅱ使用了催化剂 (2)正 吸热 (3)<10.铁在高温下可以与CO2或水蒸气反应,化学方程式及对应的平衡常数如下:①Fe(s)+CO2(g)FeO(s)+CO(g) K'②Fe(s)+H2O(g)FeO(s)+H2(g) K″请回答下列各题:(1)反应①的平衡常数K'的表达式为 。 (2)在不同温度下,K'和K″的值如下表所示:T/KK'K″9731.472.3611732.151.67na.反应①的正反应是 (填“吸热”或“放热”,下同)反应,反应②的正反应是 反应。 b.现有可逆反应③:CO2(g)+H2(g)CO(g)+H2O(g),其正反应的焓变ΔH (填“>”或“<”)0。 (3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施为 (填字母)。 A.缩小容器体积B.降低温度C.升高温度D.使用合适的催化剂解析:由表中数据知:反应①随温度升高,K'增大,说明反应①为吸热反应;同理知反应②为放热反应。即有①Fe(s)+CO2(g)FeO(s)+CO(g) ΔH'>0②Fe(s)+H2O(g)FeO(s)+H2(g) ΔH″<0将①式减去②式整理得:CO2(g)+H2(g)CO(g)+H2O(g) ΔH=ΔH'-ΔH″>0。答案:(1)K'=[CO][CO2] (2)吸热 放热 > (3)CB组1.在一容积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)nY(g) ΔH=QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、容器容积的关系如下表所示:c(Y)/(mol·L-1) 容器容积/L温度/℃ 1231001.000.750.532001.200.900.633001.301.000.70下列说法正确的是( )A.m>nB.Q<0C.温度不变,压强增大,Y的质量分数减小D.容积不变,温度升高,平衡逆向移动解析:当温度不变时,随着容器容积的扩大,Y物质的浓度不断减小,若平衡不发生移动,在某温度时,容器容积为2L时Y的浓度应为1L时的12n,但由图表可知事实上容器容积为2L时Y的浓度大于1L时的12,即随着容器容积的扩大,压强的减小,平衡正向移动,故m0,故B、D错。答案:C2.符合下面甲、乙两图的反应是( )A.X(g)+3Y(g)3Z(g) ΔH>0B.X(g)+3Y(g)2Z(g) ΔH<0C.X(g)+2Y(g)3Z(g) ΔH<0D.X(g)+3Y(g)4Z(g) ΔH<0解析:由图甲知,X、Y为反应物,Z为生成物,由反应中速率之比等于系数之比可推知反应为X(g)+3Y(g)2Z(g);由图乙知“先拐先平条件高”可知T2>T1,T1→T2升高温度Z%减小,表明升高温度平衡逆向移动,消耗了Z,逆反应方向为吸热反应,则正反应方向为放热反应,ΔH<0。综合可知B正确。答案:B3.在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)CH3OH(g) ΔH<0。第2min时只改变一个条件,反应情况如下表:时间c(CO)/(mol·L-1)c(H2)/(mol·L-1)c(CH3OH)/(mol·L-1)起始130第2min0.82.60.2第4min0.41.80.60.41.80.6n第6min下列说法不正确的是( )A.第4min至第6min该化学反应处于平衡状态B.第2min时,如果只改变某一条件,则改变的条件可能是降低温度C.第2min时,如果只改变某一条件,则改变的条件可能是使用催化剂D.第6min时,其他条件不变,如果升高温度,正反应速率增大解析:根据表中数据得,第4min后体系中各物质的浓度保持不变,即反应达到平衡状态,A对;该反应在2~4min内的反应速率大于0~2min内的反应速率,即第2min时反应速率增大,因此改变的条件不可能为降低温度,可能为使用催化剂,B错、C对;6min时,升高温度,正、逆反应速率均增大,D对。答案:B4.在密闭容器中发生反应aA(g)cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )A.a
查看更多