- 2022-04-09 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019秋九年级化学上册第三单元物质构成的奥秘知识清单精练(新版)新人教版
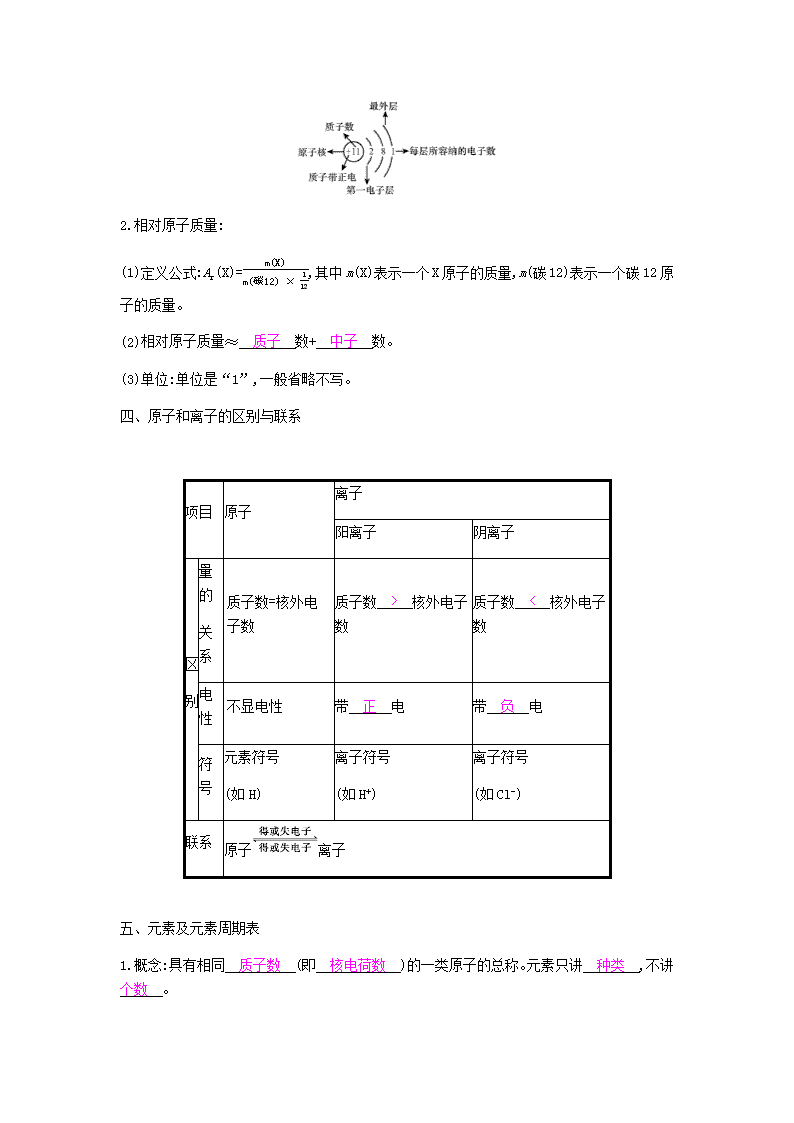
第三单元物质构成的奥秘单元知识清单一、分子及其基本性质1.由分子构成的物质, 分子 是保持其化学性质的最小粒子。 2.分子的基本性质:(1)分子的质量和体积都很小。(2)分子总是在 不断运动着 ,温度升高时分子运动速率 加快 ;温度降低时分子运动速率 减慢 。 (3)分子间存在间隔,温度升高时分子间的间隔 变大 ;压强增大时分子间的间隔 变小 。 (4)同种物质的分子,性质相同;不同种物质的分子,性质不同。二、分子可以分为原子化学变化的过程是构成分子的原子进行 重新组合 的过程。在化学反应中,分子可以分成原子,而原子 不可再分 。 三、原子和相对原子质量1.原子:(1)原子是 化学变化 中的最小粒子。 (2)原子的构成: 原子(不带电)原子核质子:每个质子带1个单位正电荷中子:不带电核外电子:每个电子带1个单位 负 电荷(3)原子中,核电荷数=质子数=核外电子数。(4)原子结构示意图:n2.相对原子质量:(1)定义公式:Ar(X)=m(X)m(碳12)×112,其中m(X)表示一个X原子的质量,m(碳12)表示一个碳12原子的质量。(2)相对原子质量≈ 质子 数+ 中子 数。 (3)单位:单位是“1”,一般省略不写。四、原子和离子的区别与联系项目原子离子阳离子阴离子区别量的关系质子数=核外电子数质子数 > 核外电子数 质子数 < 核外电子数 电性不显电性带 正 电 带 负 电 符号元素符号(如H)离子符号(如H+)离子符号(如Cl-)联系原子离子五、元素及元素周期表1.概念:具有相同 质子数 (即 核电荷数 )的一类原子的总称。元素只讲 种类 ,不讲 个数 。 n2.地壳中含量最多的非金属元素是 O ,金属元素是 Al ;空气中含量最多的元素是 N ;人体中含量最多的元素是 O 。 3.元素符号的意义:(1)宏观意义:①表示一种元素,如Fe表示 铁元素 。 ②由原子直接构成的物质,其元素符号还可表示一种物质,如Fe表示 金属铁 。 (2)微观意义:①表示一种原子,如Fe表示 铁原子 。 ②表示一个原子,如Fe表示 1个铁原子 。 (3)元素符号前加上具体数字,则只能表示微观意义,即表示几个该原子(因稀有气体分子为单原子分子,故稀有气体的元素符号前加数字也能表示几个该分子),如5Fe表示 5个铁原子 。 4.元素周期表单元格中各部分表示的含义(以H为例)。六、物质的组成和构成查看更多