- 2022-04-09 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019高中化学课时达标训练23专题4第一单元第二课时硫酸的制备和性质苏教版
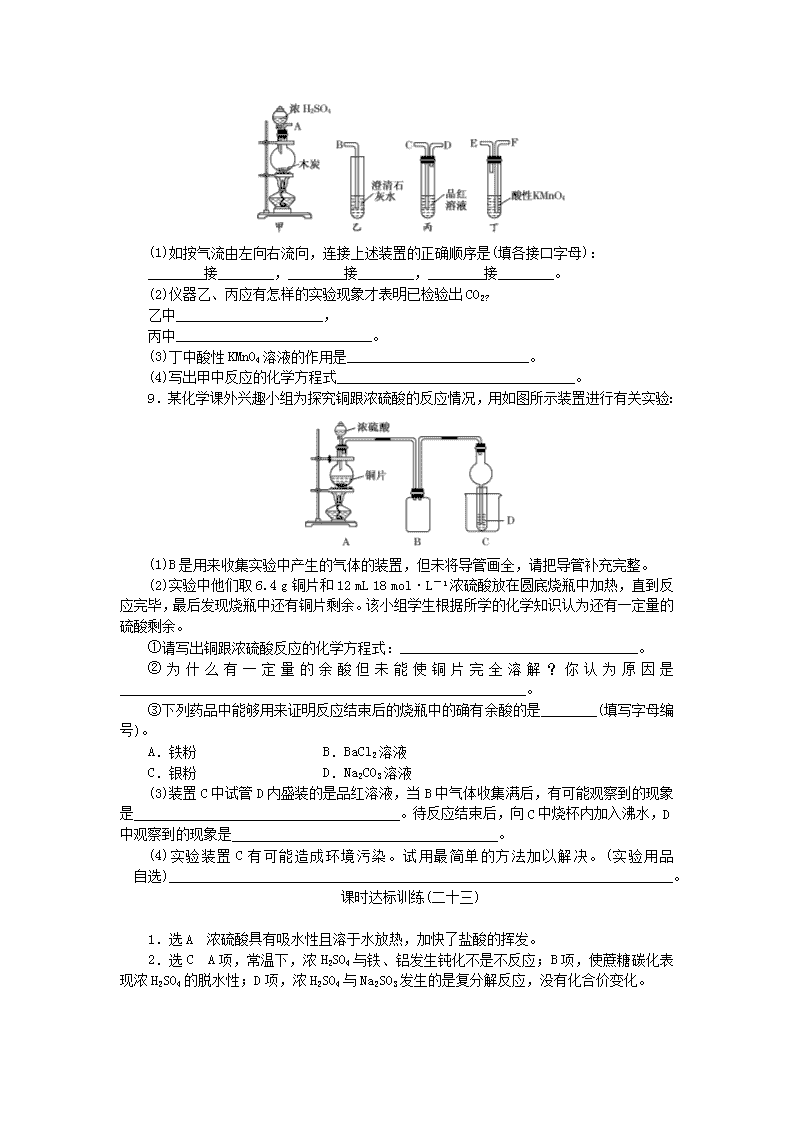
硫酸的制备和性质1.向盐酸中加入浓H2SO4时,会有白雾生成,不是导致产生该现象的原因的是( )A.浓H2SO4具有脱水性B.浓H2SO4具有吸水性C.盐酸具有挥发性D.气态溶质的溶解度随温度的升高而降低2.下列对浓硫酸的叙述正确的是( )A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸B.浓硫酸具有吸水性,故能使蔗糖炭化C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性D.浓硫酸与亚硫酸钠反应制取SO2时,浓硫酸表现出强氧化性3.浓硫酸在使下列物质的转化中,既表现出氧化性,又表现出酸性的是( )A.Cu―→CuSO4 B.C―→CO2C.NaCl―→Na2SO4D.Fe2O3―→Fe2(SO4)34.下列各组气体中,在实验室可用硫酸制取,又能用浓H2SO4干燥的一组是( )A.HCl HI H2B.H2S CO2 H2C.H2 SO2 HClD.NH3 N2 H25.向50mL18mol·L-1硫酸中加入足量的铜片并加热。充分反应后,被还原的硫酸的物质的量( )A.小于0.45molB.等于0.45molC.在0.45mol和0.90mol之间D.大于0.90mol6.在含有2molH2SO4的浓硫酸中加入足量锌粉,使其充分反应,则下列推断中错误的是( )①放出的气体中除SO2外还有H2 ②只放出SO2气体,其物质的量为1mol ③反应结束时转移电子的物质的量可能为4molA.①B.②C.②③D.①②7.在试管中放入一块铜片,注入一定体积的浓硫酸,给试管加热,使之反应。(1)若铜片还有剩余,硫酸__________消耗完毕(填“已”或“没有”)。其理由是__________________________________________________。设计一个实验证明你的结论,写出你所设计实验的反应原理(用化学方程式表示)_______________________________。(2)欲观察生成的CuSO4溶液的颜色,应采取的操作是___________________。(3)用一定量的废铜屑制取胆矾,有两种方法:第一种是取铜与浓硫酸直接反应;第二种是先将铜在空气中加热,使之生成CuO,再与稀硫酸反应,其中________种方法好,理由是________________________________________________________________________。8.为了验证木炭可被浓硫酸氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置:n(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):________接________,________接________,________接________。(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中_____________________,丙中____________________________。(3)丁中酸性KMnO4溶液的作用是__________________________。(4)写出甲中反应的化学方程式__________________________________。9.某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验:(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请把导管补充完整。(2)实验中他们取6.4g铜片和12mL18mol·L-1浓硫酸放在圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有铜片剩余。该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。①请写出铜跟浓硫酸反应的化学方程式:__________________________________。②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是__________________________________________________________。③下列药品中能够用来证明反应结束后的烧瓶中的确有余酸的是________(填写字母编号)。A.铁粉 B.BaCl2溶液C.银粉D.Na2CO3溶液(3)装置C中试管D内盛装的是品红溶液,当B中气体收集满后,有可能观察到的现象是______________________________________。待反应结束后,向C中烧杯内加入沸水,D中观察到的现象是______________________________________。(4)实验装置C有可能造成环境污染。试用最简单的方法加以解决。(实验用品自选)________________________________________________________________________。课时达标训练(二十三)1.选A 浓硫酸具有吸水性且溶于水放热,加快了盐酸的挥发。2.选C A项,常温下,浓H2SO4与铁、铝发生钝化不是不反应;B项,使蔗糖碳化表现浓H2SO4的脱水性;D项,浓H2SO4与Na2SO3发生的是复分解反应,没有化合价变化。n3.选A 反应Cu+2H2SO4(浓)CuSO4+SO2+2H2O中,一部分硫元素化合价降低,一部分硫元素化合价不变,所以浓硫酸既表现了酸性,又表现了氧化性。C+2H2SO4(浓)CO2+2SO2+2H2O中硫元素化合价降低;Fe2O3+3H2SO4(浓)===Fe2(SO4)3+3H2O中硫元素化合价不变。4.选C A中HI、B中H2S都有较强的还原性,不能用浓H2SO4干燥,A、B被排除。D中NH3能与H2SO4反应,不可用浓H2SO4干燥,排除D。SO2不与H2SO4(不论浓、稀)发生反应,可用浓H2SO4干燥。5.选A 根据化学方程式Cu+2H2SO4(浓)CuSO4+SO2+2H2O,若有2mol硫酸参加反应,就有1mol硫酸被还原:2H2SO4~SO2~(被还原)H2SO4。对50mL18mol·L-1的硫酸来说应该有0.45mol硫酸被还原。随反应的进行硫酸的浓度逐渐变小,当浓硫酸变成稀硫酸时,不再与Cu反应,因此被还原的硫酸物质的量小于0.45mol。6.选C 浓硫酸具有强氧化性,与锌反应放出SO2气体;随着硫酸的消耗,浓硫酸变成稀硫酸,与锌反应生成氢气。据Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O可知:每消耗1mol硫酸转移1mol电子;据Zn+H2SO4===ZnSO4+H2↑知:每消耗1mol硫酸转移2mol电子,因此反应结束时转移电子的物质的量小于4mol。7.解析:(1)铜不能与稀硫酸反应,浓硫酸随着反应的进行,浓度变稀,变成稀硫酸。利用稀H2SO4可以与金属活动顺序表中H前金属反应,可用一种较活泼金属投入反应后溶液中,看是否发生反应来证明硫酸是否消耗完毕。(2)要观察CuSO4溶液颜色,可将反应后的液体慢慢注入水中,边加边搅拌即可。(3)第二种方法好。因为既节省了硫酸,又不会产生污染大气的SO2气体。答案:(1)没有 因随反应Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑的进行,硫酸变稀,而稀H2SO4不与Cu反应,故H2SO4不会耗完 Zn+H2SO4===ZnSO4+H2↑(或CuO+H2SO4===CuSO4+H2O)(2)将反应后的液体慢慢注入水中,边加边搅拌,而后观察颜色(3)第二 既节省H2SO4又防止产生SO2造成污染8.解析:本题考查浓硫酸和SO2、CO2的性质。注意用澄清石灰水检验CO2之前必须将其中的SO2除尽。答案:(1)A F E C D B(2)澄清石灰水变浑浊 品红溶液未褪色(3)除去SO2(4)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O9.解析:Cu只与浓硫酸在加热时反应,而不与稀硫酸反应。收集SO2气体用向上排空气法,因此B装置应为长进短出,证明硫酸有剩余,应证明溶液中含H+,而不应证明含SO,因此BaCl2溶液和Ag均不可。对C装置逸出的SO2,用浸有NaOH溶液的棉花团塞在试管口是最简单的方法。答案:(1)n(2)①Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O②随着H2SO4的消耗,浓H2SO4的浓度不断降低,稀H2SO4与Cu不反应 ③AD(3)红色褪去 恢复红色(4)用浸有NaOH溶液的棉团塞在试管口查看更多