2019届高三化学考前周周模拟卷5
2019届高三考前化学周周模拟卷(5)1、化学与生活、社会发展息息相关,下列有关说法不正确的是()A.将海水中的镁转化为氯化镁,再电解熔融氯化镁可制得金属镁B.稻草秸秆和甘蔗渣中富含纤维素,可以用它来制造纸张C.芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下成像,该过程涉及到化学变化D.《新修本草》中有关于“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑙璃……烧之赤色……”这里的赤色是析出了Cu单质2、下列关于有机化合物的说法正确的是()A.分馏汽油和裂化汽油均可使溴水褪色,其原理相同B.可以用碳酸氢钠溶液来鉴别乙酸、乙醇和甲苯C.有机物C4H8Cl2的同分异构体有10种(不考虑立体异构)D.蛋白质在蛋白酶的作用下水解为氨基酸,高温可加速其水解3、把浓盐酸分别滴入点滴板上的各种溶液中,现象如下:实验现象①中溶液变蓝②中溶液产生胶状沉淀③中生成沉淀④中产生黄绿色气体下列分析不正确的是()A.①中溶液变蓝,体现了浓盐酸的氧化性B.②中产生白色胶状沉淀:2H++=H2SiO3↓C.③中产生沉淀的原因可用平衡移动原理解释D.④中产生黄绿色气体:ClO-+Cl-+2H+=Cl2↑+H2O4、是阿伏加德罗常数的值。下列说法正确的是()A.常温下,28g铁片与足量浓硝酸反应转移电子数为B.1L1葡萄糖的水溶液含H-O键数目为C.1mol和3mol反应最多生成的酯基数目为D.在标准状况下,2.24L和的混合气体所含质子数为n5、短周期主族元素X、Y、Z、W的原子序数依次增大,四种元素同周期;X的原子半径在同周期元素中最大;Y元素原子的电子层数与最外层电子数相等;Z元素的单质用于制作计算机芯片;W的最高价氧化物对应水化物的化学式为。下列说法正确的是()A.简单离子半径:X
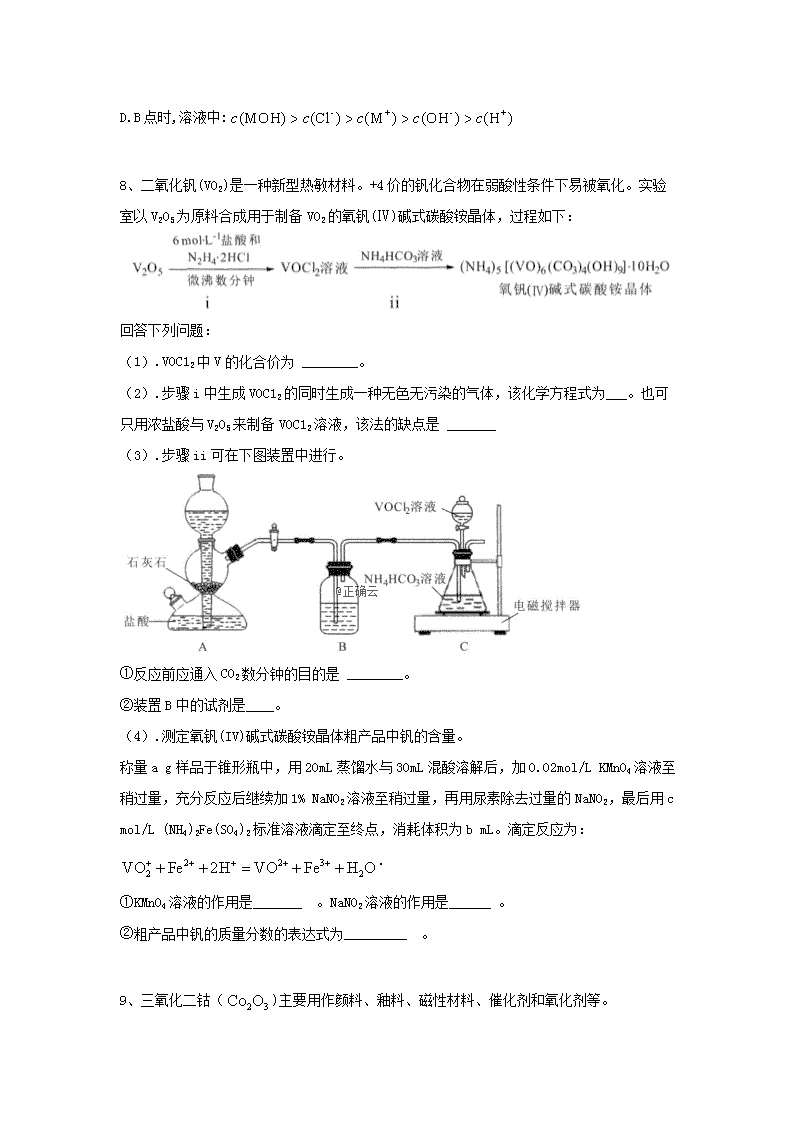
D点nD.B点时,溶液中:8、二氧化钒(VO2)是一种新型热敏材料。+4价的钒化合物在弱酸性条件下易被氧化。实验室以V2O5为原料合成用于制备VO2的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:回答下列问题:(1).VOC12中V的化合价为________。(2).步骤i中生成VOC12的同时生成一种无色无污染的气体,该化学方程式为___。也可只用浓盐酸与V2O5来制备VOC12溶液,该法的缺点是_______(3).步骤ii可在下图装置中进行。①反应前应通入CO2数分钟的目的是________。②装置B中的试剂是____。(4).测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。称量ag样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/LKMnO4溶液至稍过量,充分反应后继续加1%NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,最后用cmol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为bmL。滴定反应为:.①KMnO4溶液的作用是_______。NaNO2溶液的作用是______。②粗产品中钒的质量分数的表达式为_________。9、三氧化二钴()主要用作颜料、釉料、磁性材料、催化剂和氧化剂等。n请回答下列问题:(1).三氧化二钴的制备方法之一是以碳酸钴()为原料,将其置于电炉中,在隔绝空气条件下350~370℃灼烧4~5h,制得的同时生成两种气体,该反应的化学方程式为__________。(2).以含钴废料(主要成分为CoO、,含有少量、NiO、)为原料制备的流程如图1所示。已知:a.“酸浸”后的浸出液中含有的阳离子主要有、、、等。b.部分阳离子以氢氧化物形式沉淀时溶液的pH如表。沉淀物完全沉淀时的pH3.79.09.2c.在酸性条件下的氧化性比强。①“研磨”含钴废料的目的是____________。②“酸浸”时加入的主要作用是__________,加入的量要适当超过理论值的原因是____________,用盐酸代替和硫酸的弊端是____________。③滤渣1的主要成分的化学式为____________。④某萃取剂对金属离子的萃取率与溶液pH的关系如下图所示:n该萃取剂在本流程中是否适用?___________(填“是”或“否”),理由是____________。⑤“沉钴”时发生反应的离子方程式为_____________。⑥有机相提取的再生时可用于制备镍氢电池,该电池充电时的总反应为,则放电时负极的电极反应式为___________。10、CCUS是一种碳捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益。请回答下列问题:(1).以废气中的CO2为原料可制取甲醇。在恒容密闭容器中,298K和101kPa下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。①已知:H2(g)、CH3OH(l)的燃烧热ΔH分别为-285.8kJ·mol-1和-726.5kJ·mol-1;;H2O(l)H2O(g)ΔH=+44kJ·mol-1。则CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH=__________kJ·mol-1。②某温度下,在体积为2L的恒容密闭容器中加入6molH2、4molCO2进行反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),达到平衡时H2的转化率是50%,则平衡时容器内的压强与起始压强之比为__________。③起始温度、容器体积相同(T1℃、2L密闭容器),一定条件下,反应Ⅰ、Ⅱ起始CO2、H2、CH3OH(g)、H2O(g)的物质的量如表:n(CO2)/moln(H2)/moln[CH3OH(g)]/moln[H2O(g)]/mol反应Ⅰ(恒温恒容)2600反应Ⅱ(绝热恒容)0022n对比反应Ⅰ、Ⅱ:平衡常数K(Ⅰ)__________(填">""<"或"=",下同)K(Ⅱ);平衡时CH3OH的浓度c(Ⅰ)__________c(Ⅱ)。(2).CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)CH2=CH2(g)+4H2O(g)ΔH=-127.8kJ·mol-1。在0.1MPa下,CO2和H2以n(CO2):n(H2)=1:3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度下,反应达到平衡时的四种气态物质的量分数如图1所示:①曲线b、c表示的物质分别为__________、__________。(填化学式)②保持某一温度不变,在体积为VL的恒容容器中以n(CO2):n(H2)=2:3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬时扩大至2VL并保持不变,t2时重新达平衡。请在图2中作出容器内混合气体的平均相对分子质量随时间变化的图象。11、钛被誉为“21世纪的金属”,可呈现多种化合价。其中以+4价的Ti最为稳定。回答下列问题:(1).基态Ti原子的价电子轨道表示式为 。(2).已知电离能:I2(Ti)=1310kJ/mol,I2(K)=3051kJ/mol。I2(Ti)<I2(K),其原因为 。(3).钛某配合物可用于催化环烯烃聚合,其结如图所示:①铁的配位数为 ,碳原子的杂化类型 。②该配合物中存在的化学键有 (填字母标号)。na.离子健b.配位键c.金属健d.共价键e.氢键(4)钛与卤素形成的化合物熔沸点如下表所示:TiCl4TiBr4TiI4熔点/℃﹣24.138.3155沸点/℃136.5233.5377分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是 。(5).已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为 。阴离子的空间构型为 。(6).已知TiN晶体的晶胞结构如下图所示,若该晶胞的密度ρg/cm3,阿伏加德罗常数值为NA则晶胞中Ti原子与N原子的最近距离为______pm.(用含ρ、NA的代数式表示)12、化合物J是一种香料,可按如下路线合成:已知:i.A的核磁共振氢谱有2组峰,峰面积之比为9:1;E为芳香烃。ii.iii.同一个碳上连两个羟基通常不稳定,易脱水形成碳氧双键niv.试回答下列问题:(1).A的化学名称为________,I中所含的含氧官能团为________(填名称)。(2)反应②的反应类型为________。(3)H的分子式为________。(4)H与新制Cu(OH)2悬浊液反应的化学方程式为________。(5).满足下列条件的I的同分异构体共有种(不含立体异构)。①含有苯环和碳碳双键②能够发生银镜反应和水解反应写出同分异构体中核磁共振氢谱图有5组峰,且峰面积之比为1:1:2:2:2的结构简式:。(6).参照上述合成路线以乙醇和甲醛为原料(无机试剂任选),设计制备丙烯酸(CH2=CHCOOH)的合成路线。答案1.D2.B3.A4.D解析:在常温下铁片遇浓硝酸发生钝化,A项错误;葡萄糖水溶液中水也含H-O键,B项错误;酯化反应是可逆反应,乙酸不能完全反应,C项错误;、分子所含质子数都是22,D项正确。5.Cn解析:一般来说,离子的核外电子层数越多,离子的半径越大,当电子层结构相同时,离子的核电荷数越大,离子的半径越小,则离子半径:,故A错误;Na、Al、Cl三种元素的最高价氧化物对应的水化物分别是氢氧化钠、氢氧化铝、高氯酸,氢氧化铝具有两性,氢氧化钠是强碱,高氯酸是强酸,它们之间可以相互反应,故B错误;Si、Cl形成的二元化合物为四氯化硅,四氯化硅的电子式为,各原子均满足8电子的稳定结构,故C正确;Na的简单氢化物为NaH,Cl的简单氢化物为HCl,是氧化还原反应,D错误。6.D解析:甲醇燃料电池的电解质呈碱性,则甲醇一极的电极反应式为CH3OH-6e-+8OH-CO32-+6H2O,A项错误;a为阳极,b为阴极,电解精炼铜时a应为粗铜,b应为纯铜,B项错误;若a、b均为石墨,则b极的电极反应式为Cu2++2e-Cu,C项错误;若a为石墨,b为铜,则a极的电极反应式为2H2O-4e-4H++O2↑,b极的电极反应式为Cu2++2e-Cu,消耗标准状况下336mLO2时,转移电子为,根据各电极上转移电子数相等,可得n(H+)=0.06mol,则,pH=1,D项正确。7.C解析:,所以,A错误;用0.1的盐酸滴定10mL0.1MOH溶液,由题图可知,滴定开始前,由于,则,说明MOH为弱碱。当AG=0时,溶液呈中性,当AG>0,溶液呈酸性,当AG<0,溶液呈碱性,C点溶液显中性,溶质为MCl和MOH,B错误;由上述分析知,C点溶液的溶质为MCl和MOH,溶液呈中性,水的电离既不被促进也不被抑制,D点溶液为等浓度的MCl和HCl的混合溶液,的水解程度小,HCl电离出抑制水的电离,因此溶液中由水电离的:C点>D点,C正确;B点时,加入盐酸的体积时5nmL,则溶液中的溶质是等物质的量的MOH和MCl,此时AG小于0,说明溶液显碱性,即溶液中MOH的电离程度大于的水解程度,结合电荷守恒知,故D错误。8.1.+42.2V2O5+N2H4•2HCl+6HCl=4VOCl2+N2↑+6H2O;有氯气生成,污染空气3.排除装置中的空气,避免产物被氧化;饱和NaHCO3溶液4.将+4的钒化合物氧化为;除去过量的KMnO4;解析:1.根据氧的化合价为-2,氯的化合价为-1,化合物中各元素化合价代数和为0可得,VOC12中V的化合价为+4价;2.步骤i中V2O5中加入N2H4•2HCl和盐酸反应生成VOC12的同时生成一种无色无污染的气体,V2O5被还原为VOCl2,则气体为N2,反应的化学方程式为2V2O5+N2H4•2HCl+6HCl=4VOCl2+N2↑+6H2O;也可只用浓盐酸与V2O5来制备VOC12溶液,V2O5被还原为VOCl2,则浓盐酸被氧化有氯气生成,污染空气;3.①+4价钒化合物在弱酸性条件下易被氧化,为防止+4价钒化合物被氧化,反应前应通入CO2数分钟排除装置中的空气,避免产物被氧化;②装置B中的试剂用于除去二氧化碳中的氯化氢气气,故所装试剂为饱和NaHCO3溶液;4.测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。称量ag样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/LKMnO4溶液至稍过量,充分反应后继续加1%NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,最后用cmol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为bmL。滴定反应为:+Fe2++2H+=VO2++Fe3++H2O.①KMnO4溶液具有强氧化性,其作用是将+4的钒化合物氧化为;NaNO2溶液的作用是除去过量的KMnO4;②根据反应+Fe2++2H+=VO2++Fe3++H2O可知,n()=n(Fe2+)=bc,根据钒守恒,粗产品中钒的质量分数的表达式为。n9.1.;2.①增大固体与液体的接触面积,加快酸浸速率;②还原生成;和均能催化的分解;氧化HCl产生的会污染环境;③;④否;在一定的pH范围内,该萃取剂对、的萃取选择性差;⑤;⑥解析:1.由题给信息知,碳酸钴()受热分解生成了,钴元素的化合价由+2变为+3,显然此反应是氧化还原反应,根据得失电子守恒和质量守恒分析另外的两种气体产物为CO和,发生反应的化学方程式为。2.①“研磨”含钴废料可增大固体与液体的接触面积,加快酸浸速率(或使酸浸更充分)。②由“酸浸”之前含钴废料的主要成分为CoO、,含有少量、NiO、,“酸浸”后的浸出液中含有的阳离子主要有、、、,结合在酸性条件下的氧化性比强可知,在“酸浸”时三价钴被还原,可被氧化,但量少,故需加入还原剂,所以加入的主要作用为还原生成;因为和均能催化的分解,所以加入的量要适当超过理论值;用盐酸代替和硫酸的弊端是氧化HCl产生的会污染环境。③根据表中阳离子完全形成氢氧化物沉淀的pH以及图1可知“酸浸"后的溶液调pH是为了使沉淀完全而除去,故滤渣1的主要成分的化学式为。④根据图1可知加入萃取剂的目的是将溶液中的、分离,由图2可知,该萃取剂在一定的pH范围内,对、的萃取率无明显的区别,所以不能较好地将二者分离。⑤“沉钴”时发生反应的离子方程式为n。⑥由镍氢电池充电时的总反应为可知,放电时的负极反应为。10.1.-48.9;4:5;<;><;>2O; CO2②解析:1.①根据H2(g)、CH3OH(l)的燃烧热ΔH分别为-285.8kJ·mol-1和-726.5kJ·mol-1可得a.b.,已知c.CH3OH(l)CH3OH(g)ΔH=+38kJ·mol-1和d.H2O(l)H2O(g)ΔH=+44kJ·mol-1,根据盖斯定律,由3×a-b+c+d得CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH=3×(-285.8kJ·mol-1)-(-726.5kJ·mol-1)+38kJ·mol-1+44kJ·mol-1=-48.9kJ·mol-1。②达到平衡时H2的转化率是50%,则H2的物质的量为6mol×50%=3mol,列三段式进行计算: CO2(g)+3H2(g)CH3OH(g)+H2O(g)起始/mol 4 6 0 0转化/mol 1 3 1 1n平衡/mol 3 3 1 1容器的体积固定,则平衡时与起始时容器内压强之比等于气体总物质的量之比,即4:5。③CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH<0,则该反应是放热反应,反应Ⅰ在恒温恒容条件下进行,反应Ⅱ在绝热恒容条件下进行,假设反应Ⅰ、Ⅱ均在恒温恒容条件下进行,由题意数据可知,两反应达到的平衡等效,但反应Ⅱ为绝热恒容条件下进行的逆向反应,反应过程中吸热,达到的平衡相当于反应Ⅰ达到平衡后降低温度,平衡正向移动,平衡常数增大,甲醇浓度增大。2.①该反应为放热反应,升高温度平衡逆向移动,根据反应开始时,在0.1MPa下,n(CO2):n(H2)=1:3及曲线变化趋势可知a为H2的变化曲线,d为CO2的变化曲线,结合化学计量数关系可知b为H2O的变化曲线,d为CH2=CH2的变化曲线。②以n(CO2):n(H2)=2:3的投料比加入反应物,设n(CO2)=2xmol,n(H2)=3xmol,反应前混合气体的平均相对分子质量,所以起点坐标为(0,18.8),随着反应进行,气体的总物质的量减小,总质量不变,则混合气体的平均相对分子质量增大,若H2全部转化,则容器内有0.5xmolCH2=CH2、2xmolH2O和xmolCO2,混合气体的平均相对分子质量,则时达到平衡,应在18.8~26.86之间,时将容器体积瞬间扩大至2VL,平衡逆向移动,时重新达到平衡,平均相对分子质量减小,且应大于18.8,据此作图。11.1.2.K+失去的是全充满的3p6电子,Ti+失去的是4s1电子3.6;sp3、sp2;bd4.三者都是分子晶体,组成和结构相似,随着相对分子质量增大,分子间作用力增强,熔沸点升高5.TiO2+或;正四面体6.n解析:1.Ti原子中3d、4s能级上电子为其价电子,其价电子排布图为,故答案为:;2.轨道中电子处于全满、全空或半满时较稳定,K+失去的是全充满的3p6电子,Ti+失去的是4s1电子,失电子前者较后者难,所以I2(Ti)<I2(K),故答案为:K+失去的是全充满的3p6电子,Ti+失去的是4s1电子;3.①根据图知,Ti原子配位数是6;甲基上的C原子价层电子对个数是4、环上C原子价层电子对个数是3,根据价层电子对互斥理论判断C原子杂化类型为sp3、sp2,故答案为:6;sp3、sp2;②Ti原子和氯原子、O原子之间存在配位键,C﹣H和C﹣C及C﹣O原子之间存在共价键,所以含有的化学键为配位键和共价键,故答案为:bd;4.这几种物质熔沸点较低,为分子晶体,组成和结构相似的分子晶体,其熔沸点与分子间作用力成正比,分子间作用力随着相对分子质量增大而增大,这几种分子相对分子质量从氯化物到碘化物依次增大,分子间作用力依次增大,则其熔沸点依次升高,故答案为:三者都是分子晶体,组成和结构相似,随着相对分子质量增大,分子间作用力增强,熔沸点升高;5.该阳离子中每个Ti4+含有氧离子个数=2×=1,则阳离子化学式为TiO2+或;硫酸根离子中S原子价层电子对个数=4+=4且不含孤电子对,根据价层电子对互斥理论判断该离子空间构型为正四面体形,故答案为:TiO2+或;正四面体;6.白色球个数=8×+6×=4、黑色球个数=12×+1=4,晶胞棱长=n,晶胞中Ti原子与N原子的最近距离为棱长的一半=×=×cm=×1010pm,故答案为:。12.1.异丁烷或2—甲基丙烷;羧基2.消去反应3.C9H8O4.5.5;6.解析: