- 2022-04-09 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高三化学考前周周模拟卷1
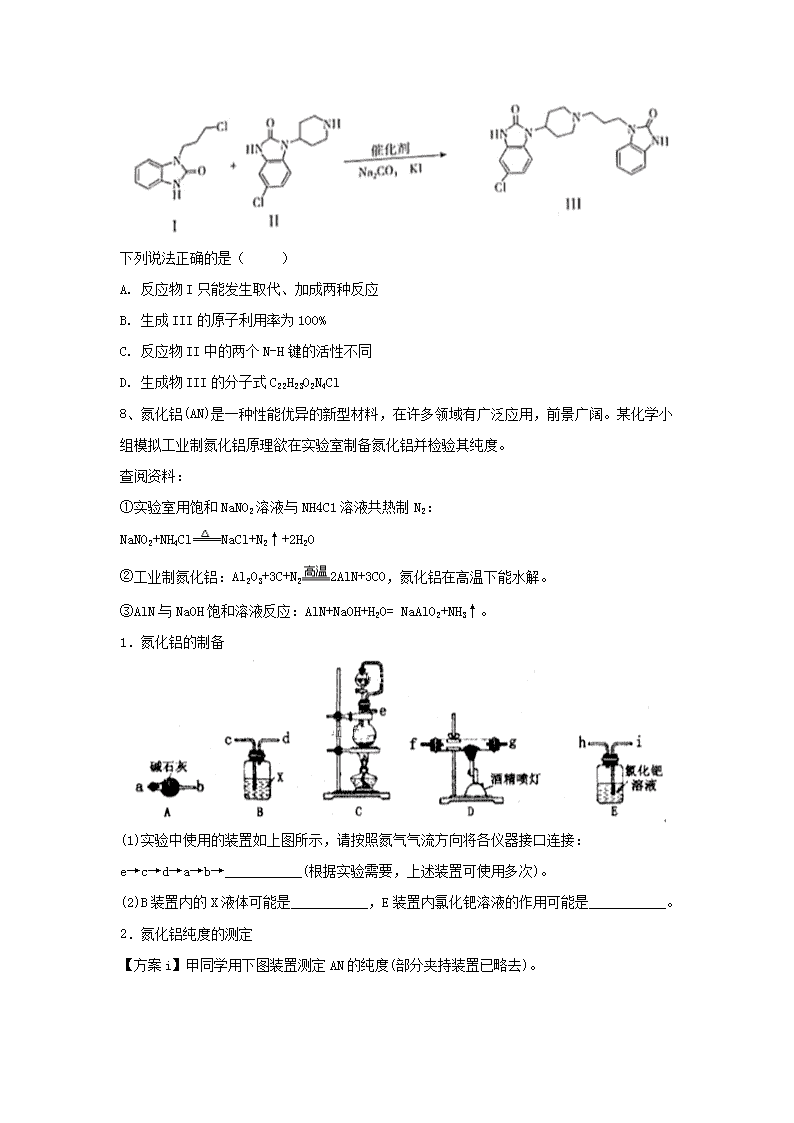
2019届高三考前化学周周模拟卷(1)1、化学与生产、生活及社会发展密切相关,下列有关说法不正确的是()A.“血液透析”和“静电除尘”利用了胶体的不同性质B.氨基酸在人体中生成新的蛋白质的反应属于缩聚反应C.从海水中提取物质都必须通过化学反应才能实现D.在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮2、下列反应的离子方程式书写正确的是()A.氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓B.氧化镁与稀盐酸反应:MgO+2H+=Mg2++H2OC.铜与氯化铁溶液反应:2Fe3++3Cu=2Fe+3Cu2+D.稀硫酸与氢氧化钡溶液反应:+Ba2+=BaSO4↓3、以高硫铝土矿(主要成分为、,还含少量)为原料,生产氧化铝并获得的部分工艺流程如下:下列叙述正确的是()A.加入可以减少的排放同时生成建筑材料B.向滤液中通入过量、过滤、洗涤、灼烧沉淀可制得C.隔绝空气焙烧时理论上反应消耗的D.“烧渣分离”不能用磁铁将烧渣中的分离出来4、根据元素周期律判断,不正确的是()A.铍(Be)原子失电子能力比Ca弱B.K与水反应比Mg与水反应剧烈C.HCl的稳定性强于HBrD.硼酸(H3BO3)的电离程度强于H2SO45、下表是25oC时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )化学式AgClAg2CrO4CH3COOHHClOH2CO3nKsp或KaKsp=1.8×10-10Ksp=2.0×10-12Ka=1.8×10-5Ka=3.0×10-8=4.1×10-7=5.6×10-11A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)B.碳酸钠溶液中滴加少量氯水的离子方程式为2+Cl2+H2O=2+Cl-+ClO-C.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9:5,此时溶液pH=5D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,先形成沉淀6、2013年日本正式启动以氨()为燃料的新型燃料电池的开发,当时的目标是实现在高温环境下工作的固体氧化物型氨燃料电池,其原理如图所示,下列说法不正确的是()A.物质a为B.镍基金属陶瓷电极发生还原反应C.电极发生的反应为D.消耗标准状况下11.2L的,转移的电子数为27、合成某种胃药的核心反应如下图:n下列说法正确的是()A.反应物I只能发生取代、加成两种反应B.生成III的原子利用率为100%C.反应物II中的两个N-H键的活性不同D.生成物III的分子式C22H23O2N4Cl8、氮化铝(AN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理欲在实验室制备氮化铝并检验其纯度。查阅资料:①实验室用饱和NaNO2溶液与NH4C1溶液共热制N2:NaNO2+NH4ClNaCl+N2↑+2H2O②工业制氮化铝:Al2O3+3C+N22AlN+3CO,氮化铝在高温下能水解。③AlN与NaOH饱和溶液反应:AlN+NaOH+H2O=NaAlO2+NH3↑。1.氮化铝的制备(1)实验中使用的装置如上图所示,请按照氮气气流方向将各仪器接口连接:e→c→d→a→b→___________(根据实验需要,上述装置可使用多次)。(2)B装置内的X液体可能是___________,E装置内氯化钯溶液的作用可能是___________。2.氮化铝纯度的测定【方案i】甲同学用下图装置测定AN的纯度(部分夹持装置已略去)。n(1)为准确测定生成气体的体积,量气装置(虚线框内)中的Y液体可以是___________。a.CCl4b.H2Oc.NH4Cl饱和溶液d.植物油(2)若装置中分液漏斗与导气管之间没有导管A连通,对所测AlN纯度的影响是___________(填“偏大”“偏小”或“不变”)【方案ii】乙同学按以下步骤测定样品中AN的纯度。(3)步骤②通入过量___________气体。(4)步骤③过滤所需要的主要玻璃仪器有___________。(5)样品中AlN的纯度是___________(用含m1、m2、m3的表达式表示)。9、为分离废磷酸亚铁锂电池的正极材料(主要含LiFePO4和铝箔)中的金属,将正极材料粉碎后进行如下流程所示的转化:已知LiFePO4不溶于水和碱,能溶于强酸。(1).“碱溶”时的离子方程式为 。 (2).向滤液Ⅰ中通入过量CO2会析出Al(OH)3沉淀,写出该反应的离子方程式: 。 (3)“酸浸”时溶液中Fe2+发生反应的离子方程式为 。 (4)检验“沉铁”后所得溶液中是否存在Fe3+的方法是 。 n(5).以Fe(OH)3为原料可以制取FeSO4晶体,还需的试剂有 。 (6).“沉锂”时,检验Li+是否沉淀完全的方法是 。10、世界上的氨除少量是从焦炉气中回收的副产物外,绝大部分是合成的。合成氨主要用于制化肥,还可作制冷剂和化工原料。(1)已知:(i)氢气的燃烧热为;(ii)合成氨反应的热化学方程式为______________________________________。(2)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K和温度的关系如表所示,400℃时,测得某时刻氮气、氢气、氨气的物质的量浓度分别为、、,此时刻该反应的正反应速率_____________(填“大于”“小于”或“等于”)逆反应速率。温度/℃200300400K1.00.860.5(3)—定条件下,往一恒容密闭容器中充入0.1mol、0.3mol,测得平衡混合物中氨的体积分数()随温度、压强的变化如图1所示。①其中、和由大到小的顺序是___________,原因是__________________________。②若容器的体积为1L,在250℃、条件下,合成氨反应达到平衡时,则该条件下合成氨反应的平衡常数K=____________________(结果保留两位小数)。n(4)用催化还原可以消除氮氧化物的污染。已知:。相同条件下,在2L恒容密闭容器内,选用不同的催化剂进行反应,产生的物质的量随时间的变化如图2所示。①在催化剂A的作用下,0~4min内________________。②该反应的活化能、、由小到大的顺序是____________,理由是__________________________。③下列说法正确的是___________(填标号)。a.该反应使用催化剂A达到平衡时,更大b.升高温度可使容器内气体颜色加深c.单位时间内形成N-H键与O-H键的数目相等,说明该反应已经达到平衡d.若该反应在恒容绝热的密闭容器中进行,当温度不变时,说明该反应已经达到平衡11、如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的________区。(2)②、⑥两元素形成的化合物的立体构型为_____,其中心原子的杂化轨道类型为_____。(3)写出元素③与元素⑤形成的稳定化合物的结构式_______。(4)⑧的二价阳离子与过量的④的氢化物的水化物作用的离子方程式为___________。n(5)元素⑦与可形成型化合物,该化合物常温下呈液态,熔点为-,沸点为,易溶于非极性溶剂,据此可判断该化合物晶体属于_____晶体(填晶体类型)。(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与间结合的作用力为________。(7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为___。12、8−羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8−羟基喹啉的合成路线。已知:i.ii.同一个碳原子上连有2个羟基的分子不稳定。(1)按官能团分类,A的类别是__________。(2)A→B的化学方程式是____________________。(3).C可能的结构简式是__________。(4)D→E的化学方程式是__________。n(5)F→G的反应类型是__________。(6)将下列K→L的流程图补充完整:(7)合成8−羟基喹啉时,L发生了__________(填“氧化”或“还原”)反应,反应时还生成了水,则L与G物质的量之比为__________。答案1.C2.B3.B解析:A项,第一次焙烧发生的反应有:,,生成建筑材料硫酸钙而不是亚硫酸钙,错误;B项,氧化铝与氢氧化钠溶液反应生成的偏铝酸钠留在滤液中,向滤液中通入过量生成氢氧化铝,过滤、洗涤、灼烧沉淀可制得,正确;C项,和隔绝空气焙烧生成四氧化三铁和的反应为了,即理论上反应消耗的,错误;D项,四氧化三铁有磁性,可以用磁铁将烧渣中的分离出来,错误。4.D5.Bn6.C由移动方向可知,镍基金属陶瓷为正极,为负极,物质a为,A项正确;正极发生还原反应,B项正确;负极发生的电极反应为,C项错误;正极发生的反应为,消耗标准状况下11.2L的,转移的电子数为2,D项正确。7.CA.反应物Ⅰ含有苯环,可发生加成反应,含有氯原子,可发生取代反应(或水解反应),也可以发生氯原子的消去反应,故A错误;B.根据原子守恒,该反应中同时生成NaCl等,则原子的利用率不是100%,故B错误;C.反应物Ⅱ中的两个N-H键的N原子连接不同的原子团,则两个N-H键的活性不同,故C正确;D.由结构简式可知生成物Ⅲ的分子式C22H24O2N4Cl,故D错误;答案选C8.1.(1)f(g)→g(f)→a→b→i(2)浓硫酸;吸收CO,防止污染2.(1)ad(2)偏大(3)(4)玻璃棒、漏斗、烧杯(5)解析:9.1.2Al+2OH-+2H2O=2+3H2↑2.+2H2O+CO2=Al(OH)3↓+3.2Fe2++2H++H2O2=2Fe3++2H2O4.取少量沉铁后所得上层溶液,向其中滴加KSCN溶液,若溶液变红色,则存在Fe3+,若溶液不变红,则不存在Fe3+5.硫酸、铁粉n6.静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀生成,则Li+沉淀完全解析:10答案:1.2.小于3.①;该反应的正反应为气体分子数减小的反应,相同条件下,增大压强平衡正移,的体积分数增大。②或5925.934.①;②;相同时间内生成的越多,反应速率越快,反应的活化能越低;③bcd解析:1.氢气的燃烧热为286.0,则燃烧的热化学方程式为(i),又(ii),根据盖斯定律,由得,2.此时刻(400℃),说明此时刻反应向逆反应方向进行,因此。3.①该反应的正反应为气体分子数减小的反应,相同条件下,增大压强平衡正移,的体积分数增大,由题图1可知。②由题图1可知250℃、条件下,平衡时氨气的体积分数为66.7%,根据三段式可计算出平衡时,,,则。n4.①在催化剂A的作用下,0~4min内。②相同条件下,相同时间内生成的越多,反应速率越快,反应的活化能越低,故该反应的活化能、、由小到大的顺序是。③催化剂不会影响,故a错误;升高温度可使平衡左移,使得二氯化氮的浓度增大,容器内气体颜色加深,故b正确;根据反应知,单位时间内形成N—H键与O-H键的数目相等时,说明该反应已经达到平衡,故c正确;若该反应在恒容绝热的密闭容器中进行,当温度不变时,说明反应已无热量变化,说明该反应已经达到平衡,故d正确。11.(1)s(2)平面正三角形杂化(3)O==C==O(4)(5)分子(6)配位键(7)2:1解析:12.1.烯烃2.CH2=CHCH3+Cl2CH2=CHCH2Cl+HCl3.HOCH2CHClCH2Cl;ClCH2CH(OH)CH2Cl4.HOCH2CH(OH)CH2OHCH2=CHCHO+2H2O5.取代反应6.7.氧化;3∶1n解析:查看更多