2019高中化学第一章第一节原子结构讲义新人教版
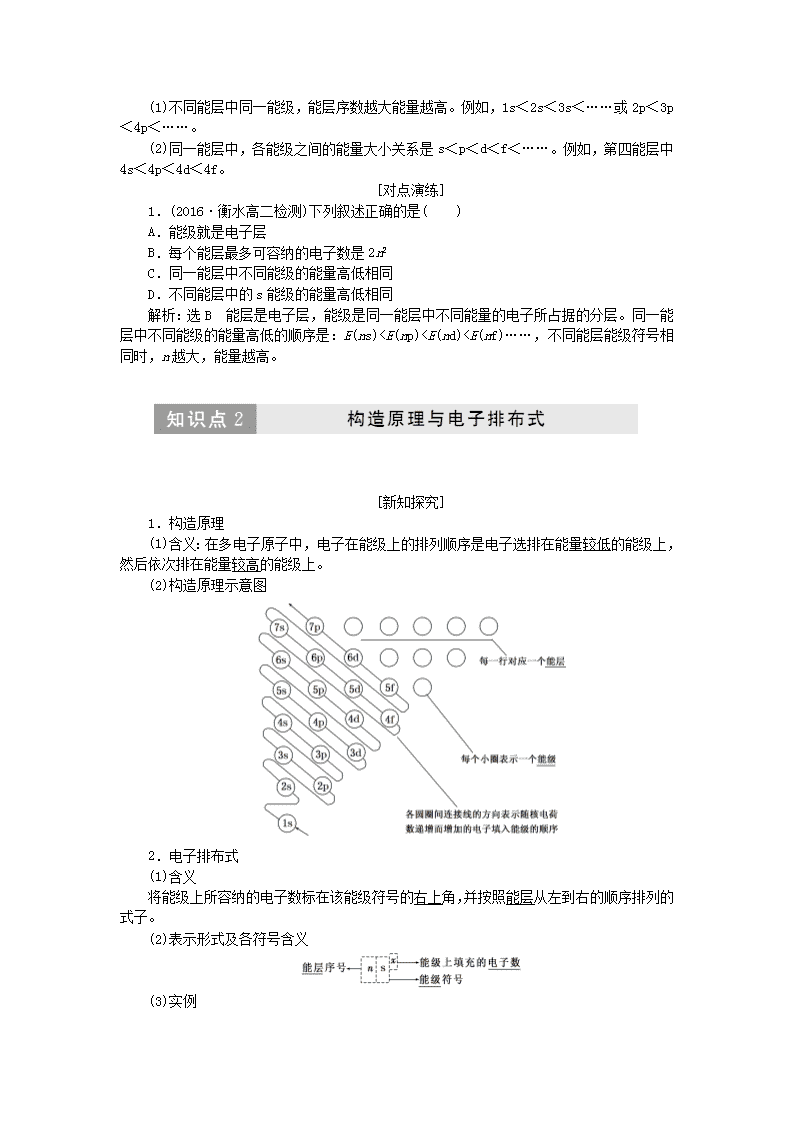
原子结构1.了解原子核外电子的运动状态。2.能应用电子排布式表示常见元素(1~36号)原子核外电子的排布。3.理解原子结构的构造原理,知道原子核外电子的能级分布。4.了解能量最低原理,了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。5.了解多电子原子核外电子的运动情况,知道电子云和原子轨道。了解泡利原理和洪特规则。细读教材记主干1.原子由原子核和核外电子构成,原子核一般由质子和中子构成。2.原子的核外电子是分层排布的,电子的能量越低离核越近,能量越高离核越远。3.一至七能层的符号分别为:K、L、M、N、O、P、Q,各能层容纳的最多电子数为2n2。4.原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理,处于最低能量的原子叫做基态原子。5.在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,这个原理称为泡利原理。6.洪特规则的内容是当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同。[新知探究]1.原子的诞生(1)原子的诞生(2)宇宙的组成及各元素的含量n(3)地球上元素的分类2.能层与能级(1)能层(2)能级(3)能层、能级中所容纳的电子数能层(n)一二三四五六七……符号KLMNOPQ……能级1s2s2p3s3p3d4s4p4d4f5s……………………最多电子数22626102610142……………………281832………………2n2[名师点拨] 能层与能级的组成与能量关系1.不同能层的能级组成任一能层的能级总是从s能级开始,而且能级数等于该能层序数,即第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),第三能层有3个能级(3s、3p和3d),依次类推。2.不同能层中各能级之间的能量大小关系n(1)不同能层中同一能级,能层序数越大能量越高。例如,1s<2s<3s<……或2p<3p<4p<……。(2)同一能层中,各能级之间的能量大小关系是s<p<d<f<……。例如,第四能层中4s<4p<4d<4f。[对点演练]1.(2016·衡水高二检测)下列叙述正确的是( )A.能级就是电子层B.每个能层最多可容纳的电子数是2n2C.同一能层中不同能级的能量高低相同D.不同能层中的s能级的能量高低相同解析:选B 能层是电子层,能级是同一能层中不同能量的电子所占据的分层。同一能层中不同能级的能量高低的顺序是:E(ns)
E(4s)。按能量最低原理,电子在进入核外电子层时,不是排完3p就排3d,而是先排4s,排完4s才排3d。由于能级交错,在次外层未达最大容量之前,已出现了最外层,而且最外层未达最大容量时,又进行次外层电子的填充,所以原子最外层和次外层电子数一般达不到最大容量。(3)洪特规则特例有少数元素基态原子的电子排布对于排布原则有1个电子的偏差。因为能量相同的原子轨道在全充满(如p6和d10)、半充满(p3和d5)和全空(p0和d0)状态时,体系能量较低,原子较稳定。如Cr:1s22s22p63s23p63d44s2(错误)应为1s22s22p63s23p63d54s1Cu:1s22s22p63s23p63d94s2(错误)应为1s22s22p63s23p63d104s12.原子核外电子排布的表示方法结构示意图意义将每个能层上的电子总数表示在原子核外的式子实例Al S2-电子排布式意义用数字在能级符号右上角标明该能级上排布的电子数实例K:1s22s22p63s23p64s1简化电子意义为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体结构的部分以相应稀有气体的元素符号外加方括号表示n排布式实例K:[Ar]4s1价电子排布式意义主族元素的价层电子指最外层电子,价层电子排布式即外围电子排布式实例Al:3s23p1电子排布图意义每个方框代表一个原子轨道,每个箭头代表一个电子实例Al[对点演练]3.下列原子或离子的电子排布式正确的是________,违反能量最低原理的是________,违反洪特规则的是________,违反泡利原理的是________。①Ca2+:1s22s22p63s23p6②F-:1s22s23p6③P:④Cr:1s22s22p63s23p63d44s2⑤Fe:1s22s22p63s23p63d64s2⑥Mg2+:1s22s22p6⑦C:解析:根据核外电子排布规律,②中错误在于电子排完2s轨道后应排2p轨道而不是3p轨道,正确的应为1s22s22p6。③中没有遵循洪特规则——电子在能量相同的轨道上排布时,应尽可能分占不同的轨道并且自旋状态相同,正确的应为。④中忽略了能量相同的原子轨道在半充满状态时,体系的能量较低,原子较稳定,正确的应为1s22s22p63s23p63d54s1。⑤和⑥正确。⑦违反泡利原理和洪特规则,所以应为。答案:①⑤⑥ ②④ ③⑦ ⑦4.(2016·郑州高二检测)以下对核外电子运动状况的描述正确的是( )A.同一原子中,2p,3p,4p能级的轨道依次增多B.当碳原子的核外电子排布由 n转变为这一过程释放能量C.3p2表示3p能级有两个轨道D.在同一能级上运动的电子,其运动状态可能相同解析:选B A项同一原子中,2p,3p,4p能级的轨道数相同,错误;B项当碳原子的核外电子排布由时能量较高,而 能量较低,由转变为这一过程释放能量,正确;C项3p2表示3p能级有两个电子,错误;D项在同一能级上运动的电子,其运动状态不可能相同,错误。1.下列说法中,不符合现代大爆炸宇宙学理论的是( )A.我们所在的宇宙诞生于一次大爆炸B.恒星正在不断地合成自然界中没有的新元素C.氢、氦等轻核元素是自然界中天然元素之母D.宇宙的所有原子中最多的是氢元素的原子解析:选B 宇宙诞生于一次大爆炸,爆炸后产生了大量的氢、氦及少量的锂,然后氢、氦等发生原子融合反应合成其他元素,该过程在宇宙中仍在进行,但合成的都是已知元素,且氢元素仍是宇宙中最丰富的元素。2.(2016·烟台高二检测)电子排布有能级顺序,若以E(nl)表示某能级的能量,以下各式中正确的是( )A.E(4s)>E(3d)>E(3px)>E(3py)B.E(3d)>E(4s)>E(3p)>E(3s)C.E(5s)>E(4f)>E(3px)=E(3py)D.E(5s)>E(4s)>E(4f)>E(3d)解析:选B A项应为E(3d)>E(4s),则为E(3d)>E(4s)>E(3px)=E(3py),错误;B项符合构造原理,正确;C项应为E(4f)>E(5s)>E(3px)=E(3py),错误;D项E(4f)>E(5s)>E(3d)>E(4s),错误。n3.(2016·银川高二检测)下列各组表述中,两种微粒一定不属于同种元素原子的是( )A.3p能级有一个空轨道的基态原子和核外电子排布式为1s22s22p63s23p2的原子B.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p63d64s2的原子C.最外层的电子数是核外电子总数的的原子和价电子排布式为4s24p5的原子D.2p能级有一个未成对电子的基态原子和原子的价电子排布式为2s22p5的原子解析:选B A项中3p能级有一个空轨道,说明3p上填2个电子,因填1个电子有2个空轨道,填3个电子或3个以上电子无空轨道,则3p上有2个电子,3s上肯定已填满,价电子排布式为3s23p2,A中两微粒相同。B项中M层全充满而N层为4s2,M层上有d轨道,即3s23p63d10,应该是锌元素,3d64s2是铁元素,B选项符合题意。C项中价电子排布式为4s24p5,则3d上已排满10个电子,核外电子排布式为1s22s22p63s23p63d104s24p5,最外层电子数是核外电子总数的原子,可按下述方法讨论:若最外层电子数为1,核外电子总数为5不可能,最外层电子数为2,核外电子总数为10不可能,同理,可讨论,只有最外层电子数为7,核外电子总数为35时合理,其电子排布式也是1s22s22p63s23p63d104s24p5,二者是同种元素的原子。D项中2p能级有一个未成对电子,可以是2p1。也可以是2p5,因此二者不一定属于同种元素的原子。4.(2016·松原高二检测)下列有关电子云的叙述中,正确的是( )A.电子云形象地表示了电子在核外某处单位的体积内出现的概率B.电子云直观地表示了核外电子的数目C.1s电子云界面图是一个球面,表示在这个球面以外,电子出现的概率为零D.电子云是电子绕核运动形成了一团带负电荷的云雾解析:选A 为了形象地表示电子在原子核外空间的分布状况,人们常用小黑点的疏密程度来表示电子在原子核外出现概率的大小;点密集的地方,表示电子出现的概率大;点稀疏的地方,表示电子出现的概率小,这就是电子云。1s电子云界面以外,电子出现的概率不为零,只是出现的概率很小。5.(2016·襄阳高二检测)以下核外电子的表示方法中,能表示该原子处于能量最低状态的是( )A.N:B.F:C.Fe:[Ar]3d54s2D.Cu:3d104s1解析:选D A选项不符合洪特规则,2p轨道上的3个电子应分占三个轨道时能量最低;B选项为F-的电子排布图,不是F原子的电子排布图;C选项中Fe是26号元素,而非25号;D选项符合洪特规则,原子处于能量最低状态。6.A、B、C、D、E代表5种元素。请填空:(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,该原子的电子排布图为______。n(2)B元素的负一价离子与C元素的正一价离子的电子排布式都与氩原子相同,B元素的符号为________,C的离子结构示意图为________。(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为________。(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布图为________________________________________________________________________。解析:(1)根据A元素基态原子的最外层有3个未成对电子,次外层有2个电子,可知该元素的基态原子有2个电子层,共有7个电子,是N元素,其电子排布图为。(2)B元素的负一价离子与C元素的正一价离子的电子排布式与氩原子相同,即都有18个电子,则B元素为Cl元素,C元素为K元素,K+的结构示意图为。(3)D元素的正三价离子的3d能级为半充满,即三价阳离子的构型为3d5,则原子的价电子构型为3d64s2,即为26号Fe元素,基态原子的电子排布式为1s22s22p63s23p63d64s2。(4)由E元素基态原子的M层全充满,N层没有成对电子,只有1个未成对电子,可知其价电子构型为3d104s1,所以E为Cu元素,基态原子的电子排布图为[Ar]。答案:(1)(2)Cl (3)Fe 1s22s22p63s23p63d64s2(或[Ar]3d64s2)(4)Cu [Ar]