- 2021-11-12 发布 |
- 37.5 KB |
- 82页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
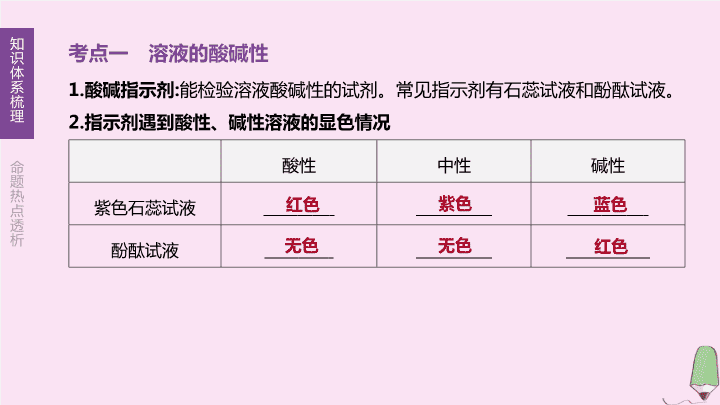
徐州专版2020中考化学复习方案第7章应用广泛的酸碱盐第14课时溶液酸碱性常见的酸和碱课件
第 14 课时 溶液酸碱性 常见的酸和碱 第 7 章 应用广泛的酸、碱、盐 【 考试要求 】 1. 了解用酸碱指示剂 ( 酚酞、石蕊 ) 和 pH 试纸检验溶液酸碱性的方法。 (B) 2. 知道酸碱性对人体健康和农作物生长的影响。 (A) 3. 认识常见酸碱的主要性质和用途。 (B) 4. 知道酸碱的腐蚀性。 (A) 5. 初步学会常见酸碱溶液的稀释方法。 (B) 6. 初步认识常见的复分解反应。 (A) 7. 能用常见的四种反应类型解释日常生活中的一些化学现象。 (C) 考点一 溶液的酸碱性 1. 酸碱指示剂 : 能检验溶液酸碱性的试剂。常见指示剂有石蕊试液和酚酞试液。 2. 指示剂遇到酸性、碱性溶液的显色情况 酸性 中性 碱性 紫色石蕊试液 酚酞试液 红色 紫色 蓝色 无色 无色 红色 3. 用蓝色石蕊试纸和红色石蕊试纸检测溶液酸碱性 (1) 检测 性溶液用红色石蕊试纸 , 现象是试纸变 色。 (2) 检测 性溶液用蓝色石蕊试纸 , 现象是试纸变 色。 碱 蓝 酸 红 易错判断 (1) 石蕊试液遇碱变蓝 , 遇酸变红属于化学变化 ( ) (2) 可以用无色酚酞试液一次性鉴别氯化钠溶液、纯碱溶液和稀盐酸 ( ) (3) 能使无色酚酞试液变红色的溶液一定是碱溶液 ( ) √ × × 考点二 溶液酸碱度的表示方法 1. 酸碱度 : 是指溶液酸碱性强弱的程度 , 常用 pH 表示。 (1)pH 的取值范围通常在 之间。 (2) 溶液酸碱性强弱与 pH 的关系如图 14-1 所示。 图 14-1 0~14 (3) 酸碱溶液稀释时的 pH 变化 若向酸性溶液中加水将其稀释 , 溶液的 pH 将会 增大 , 但不会超过 7 ; 而向碱性溶液中加水将其稀释时 , 溶液的 pH 将会 减小 , 但不会 小于 7( 如图 14-2 所示 ) 。 图 14-2 2.pH 的测定方法 测定溶液 pH 可以用 pH 计和 , 其中较简便的方法是用 。具体操作方法为 : 用干燥洁净的玻璃棒蘸取被测溶液并滴在 上 , 把显示的颜色与标准比色卡对照 , 读出相同颜色的 pH 。 pH 试纸 pH 试纸 pH 试纸 3. 溶液酸碱度的应用 (1) 科学实验及化工生产有许多 变化必须在一定 pH 的溶液中才能发生。 (2) 农作物一般适宜在 pH 的土壤中才能生长。 (3) 测定雨水的 pH 能了解空气质量 , 酸雨的 pH 5.6( 因溶有二氧化碳 , 正常雨水的 pH 约为 5.6) 。 (4) 测定人体内或排出的液体的 pH, 可以了解人的 状况。 化学 =7 或接近 7 小于 健康 易错判断 (1) 检测溶液酸碱度时 , 可以将 pH 试纸伸入待测溶液中 ( ) (2) 用湿润的 pH 试纸检测溶液酸碱度时 , 对检测结果没有影响 ( ) (3) 用 pH 试纸测定一瓶稀盐酸的 pH, 结果为 pH=3.6 ( ) (4) 可以用 pH 试纸、酸度计 (pH 计 ) 和酸碱指示剂检测溶液的酸碱度 ( ) × × × × 考点三 常见的酸 1. 浓盐酸与浓硫酸 (1) 浓盐酸和浓硫酸性质比较 浓 盐酸 ( 溶质为 HCl) 浓 硫酸 ( 溶质为 H 2 SO 4 ) 性质 无色、有 气味的液体 , 密度比水大 , 具有 性 , 打开瓶塞后 , 瓶口有 冒出 无色、黏稠、油状的液体 , 密度比 水 , 具有 性 ( 物理性质 ) 、 脱水性 和腐蚀性 ( 化学性质 ) 刺激性 挥发 白雾 大 吸水 (续表) 浓 盐酸 ( 溶质为 HCl) 浓 硫酸 ( 溶质为 H 2 SO 4 ) 敞口放 置后的 变化 溶液质量变 , 溶质的质量分数变 , 需密封保存 溶液质量变 , 溶质的质量分数 变 , 需密封保存 小 小 大 小 (2) 浓硫酸稀释 在稀释浓硫酸时 , 一定要把 沿容器壁慢慢注入 里 , 并用玻璃棒不断搅拌 , 使产生的热量迅速地扩散 , 切不可把 倒入 中。 浓硫酸 水 水 浓硫酸 图 14-3 2. 酸的通性 ( 以稀盐酸和稀硫酸为例 ) 酸的通性 稀盐酸 稀硫酸 与 酸碱指示剂作用 使紫色石蕊试液变 , 无色酚酞试液 酸 + 活泼金属→ 盐 + 氢气 ( 以锌为例 ) 酸 + 金属 氧化物 →盐 + 水 ( 以氧化铁为例 ) 红 不变色 2HCl+Zn ZnCl 2 +H 2 ↑ H 2 SO 4 +Zn ZnSO 4 +H 2 ↑ 6HCl+Fe 2 O 3 2FeCl 3 + 3H 2 SO 4 +Fe 2 O 3 Fe 2 (SO 4 ) 3 3H 2 O +3H 2 O (续表) 酸的通性 稀盐酸 稀硫酸 酸 + 碱→盐 + 水 ( 以氢氧化钠为例 ) 酸 + 盐 →新 酸 + 新 盐 ( 以碳酸钠为例 ) 性质相似的原因 溶液中都有 HCl+NaOH NaCl+ H 2 SO 4 +2NaOH Na 2 SO 4 + 2HCl+Na 2 CO 3 H 2 O H 2 SO 4 +Na 2 CO 3 H 2 O+CO 2 ↑ H + +H 2 O +CO 2 ↑ +2NaCl +2H 2 O +CO 2 ↑ +Na 2 SO 4 3. 用途 : 盐酸常用于金属表面除铁锈、制药等 ; 硫酸常用于制化肥、农药、火药、染料以及冶炼金属、精炼石油和金属表面除锈等。 易错判断 (1) 用如图 14-4 所示装置干燥气体时 , 瓶内装有稀硫酸 , 将气体从 a 端通入 ( ) (2) 浓硫酸不慎沾到皮肤或衣服上时 , 应先用大量水冲洗 , 再涂上氢氧化钠溶液 ( ) × × 图 14-4 考点四 常见的碱 1. 氢氧化钠和氢氧化钙性质及用途 氢氧化钠 (NaOH) 氢氧化钙 [Ca(OH) 2 ] 俗称 、 、 、 物理 性质 白色固体 , 易溶于水 , 溶解 时 __________ 热量 , 易吸收空气中水蒸气 而 白色粉末 , 溶于水 , 溶解度随温度升高而 腐蚀性 有强烈腐蚀性 有腐蚀性 火碱 烧碱 苛性钠 熟石灰 消石灰 放出 潮解 微 减小 (续表) 氢氧化钠 (NaOH) 氢氧化钙 [Ca(OH) 2 ] 制 取 ( 化学方程式 ) Na 2 CO 3 +Ca(OH) 2 CaCO 3 ↓ + 2NaOH ( 该反应能 热量 ) 保存 密封保存的原因 : ① 氢氧化钠固体易潮解 ;② 可与空气中的 CO 2 反应而变质 , 化学方程式 为 密封保存 , 其原因是可与空气中的 CO 2 反应而变质 , 化学方程式 为 用途 用于制取肥皂、造纸、石油、纺织、印染等 用于建筑业 ; 改良酸性土壤和配制波尔多液 CaO+H 2 O Ca(OH) 2 放出 2NaOH+CO 2 Na 2 CO 3 +H 2 O Ca(OH) 2 +CO 2 CaCO 3 ↓ +H 2 O 2. 碱的通性 ( 以氢氧化钠和氢氧化钙为例 ) 碱的通性 氢氧化钠 氢氧化钙 与 酸碱指示剂 作用 使 紫色石蕊试液变成 色 , 无色酚酞试液变成 色 碱 + 非金属 氧化物 →盐 + 水 ( 以 CO 2 为例 ) 碱 + 盐 →新 碱 + 新盐 ( 以 CuSO 4 为例 ) 碱 + 酸→盐 + 水 ( 中和反应 )( 以 HCl 为例 ) 性质相似的原因 溶液中都有 蓝 红 2NaOH+CO 2 Ca(OH) 2 +CO 2 CaCO 3 ↓ +H 2 O 2NaOH+CuSO 4 Ca(OH) 2 +CuSO 4 Cu(OH) 2 ↓ + NaOH+HCl Ca(OH) 2 +2HCl CaCl 2 +2H 2 O OH - +CaSO 4 Na 2 CO 3 +H 2 O Cu(OH) 2 ↓ +Na 2 SO 4 NaCl+H 2 O 易错判断 (1) 可以用氢氧化钠溶液治疗胃酸过多 ( ) (2) 用碱石灰 ( 烧碱和生石灰的混合物 ) 干燥二氧化碳 , 用浓硫酸干燥氨气 ( ) × × 考点五 中和反应 复分解反应 1. 定义 和 作用生成盐和水的反应叫作中和反应。中和反应能 热量 , 属于 反应。 2. 应用 (1) 改良土壤的酸碱性。 (2) 处理工厂的废水 , 一般用 中和硫酸厂的污水 ( 污水中含硫酸等杂质 ) 。 (3) 用于医药和日常生活中 , 如用胃舒平 ( 含氢氧化铝 ) 等药物来治疗胃酸过多症。 (4) 被蚊虫叮咬 ( 分泌出蚁酸 ) 后 , 涂一些碱性物质 ( 如肥皂、牙膏 ), 就可减轻痛痒。 (5) 调节溶液的酸碱性 , 把溶液的 pH 控制在一定范围内。 酸 碱 放出 复分解 熟石灰 3. 复分解反应是指两种 相互交换成分 , 生成两种新的 的反应。可表示为 AB+CD AD+CB, 其特征为“双交换、价不变”。 (1) 复分解反应通常发生在以下五组物质之间 :① 酸和碱、 ② 酸和金属氧化物、 ③ 酸和盐、 ④ 碱和盐、 ⑤ 盐和盐 ( 初中化学暂不要求 ) 。 (2) 复分解反应发生的条件 ① 反应物的要求 : 有酸酸溶 , 无酸两可溶。 ② 生成物的要求 : 两种化合物交换成分后 , 能生成气体、沉淀或水。 (3) 常见的不溶物有 : “五白” [CaCO 3 、 BaCO 3 、 BaSO 4 、 AgCl 、 Mg(OH) 2 ] 、“一蓝” [Cu(OH) 2 ] 、“一红褐” [Fe(OH) 3 ] 。 化合物 化合物 易错判断 (1) 能生成盐和水的反应一定是中和反应 ( ) (2) 二氧化碳与氢氧化钠溶液的反应属于复分解反应 ( ) × × 化学方程式网络构建 图 14-5 ① ; ② ; ③ ; ④ ; ⑤ ; ⑥ ; ⑦ ; ⑧ ; ⑨ ; HCl+NaOH NaCl+H 2 O Mg+2HCl MgCl 2 +H 2 ↑ 2Al+6HCl 2AlCl 3 +3H 2 ↑ Zn+H 2 SO 4 ZnSO 4 +H 2 ↑ Fe+H 2 SO 4 FeSO 4 +H 2 ↑ Fe 2 O 3 +6HCl 2FeCl 3 +3H 2 O Na 2 CO 3 +H 2 SO 4 Na 2 SO 4 +H 2 O+CO 2 ↑ 2NaOH+CO 2 Na 2 CO 3 +H 2 O 2NaOH+CuSO 4 Cu(OH) 2 ↓ +Na 2 SO 4 对点演练 1. 厨房中的下列物质或其水溶液呈酸性的是 ( ) A. 食醋 B. 淀粉 C. 白糖 D. 豆油 题组 1 溶液的酸碱性 A 2. 下列溶液能使紫色石蕊试液变成蓝色的是 ( ) A. 澄清石灰水 B.NaCl 溶液 C. 稀硫酸 D.KNO 3 溶液 [ 答案 ]A [ 解析 ] 澄清石灰水显碱性 , 能使石蕊试液变蓝色 ; 氯化钠溶液和硝酸钾溶液显中性 , 不能使石蕊试液变色 ; 稀硫酸显酸性 , 能使石蕊试液变红色。 3. 四种植物花汁在不同酸碱性下呈现的颜色如下表所示。若要检测某溶液的酸碱性 , 最好选用 ( ) A. 玫瑰花汁 B. 万寿菊花汁 C. 大红花汁 D. 万年青花汁 pH <7 =7 >7 玫瑰花汁 粉红 粉红 黄 万寿菊花汁 黄 黄 黄 大红花汁 橙 粉红 绿 万年青花汁 橙黄 浅绿 浅绿 [ 答案 ] C [ 解析 ] 通过比较表中信息 , 可以发现只有大红花汁能在酸性、碱性、中性溶液中分别呈现不同的颜色 , 故最好选用大红花汁检测某溶液的酸碱性。 4. 一些食物的 pH 范围如下 , 其中呈碱性的是 ( ) A. 柠檬汁 (2.0~3.0) B. 番茄汁 (4.0~4.4) C. 牛奶 (6.3~6.6) D. 鸡蛋清 (7.6~8.0) 题组 2 溶液酸碱度的表示方法 D 5. 下列有关测定氢氧化钠溶液 pH 的实验操作或描述 , 你认为正确的是 ( ) A. 用镊子夹取 pH 试纸直接伸入氢氧化钠溶液中测量 B. 先用蒸馏水将 pH 试纸润湿 , 再用滴管吸取氢氧化钠溶液滴到 pH 试纸上测量 C. 用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到 pH 试纸上 , 再与标准比色卡对照 D. 用 pH 试纸测得该氢氧化钠溶液的 pH=12.6 [ 答案 ] C [ 解析 ] 不能将 pH 试纸伸入待测液中 , 以免污染待测液 ; 氢氧化钠溶液显碱性 , 若使用蒸馏水润湿后的 pH 试纸进行测定 , 会使溶液的碱性减弱 , 测定结果偏小 ; 用 pH 试纸测得溶液的 pH 应取整数。 6. 一些物质的近似 pH 如图 14-6, 下列有关说法正确的是 ( ) A. 苹果汁的酸性比纯鲜牛奶的酸性弱 B. 肥皂水的碱性比炉具清洁剂的碱性强 C. 厕所清洁剂与炉具清洁剂能混用 D. 人被某些蚊虫叮咬后 , 可涂抹肥皂水以减轻痛痒 图 14-6 [ 答案 ] D [ 解析 ] 苹果汁的 pH 约为 3, 纯鲜牛奶的 pH 约为 6~7,pH 越小 , 酸性越强 , 所以苹果汁的酸性比纯鲜牛奶的酸性强 ; 肥皂水的 pH 约为 10, 炉具清洁剂的 pH 约为 12~13,pH 越大 , 碱性越强 , 所以肥皂水的碱性比炉具清洁剂的碱性弱 ; 厕所清洁剂呈酸性 , 炉具清洁剂呈碱性 , 二者能发生反应 , 所以不能混合使用 ; 蚊虫叮咬后会产生蚁酸 , 而肥皂水显碱性 , 所以人被某些蚊虫叮咬后可涂抹肥皂水以减轻痛痒。 7. 下列有关硫酸和盐酸的说法不正确的是 ( ) A. 打开浓盐酸的试剂瓶盖 , 出现白雾 B. 稀盐酸和稀硫酸都可用于金属除锈 C. 浓硫酸敞口放置在空气中因变质导致浓度变小 D. 稀释浓硫酸时 , 要把浓硫酸缓缓注入盛有水的烧杯中 , 用玻璃棒不断搅拌 题组 3 常见的酸 C 8. 在 ① 氧化铁、 ② 金属锌、 ③ 氢氧化铜、 ④ 氯化钡溶液四种物质中 , 跟稀硫酸、稀盐酸都能发生反应且反应中表现了“酸的通性”的组合是 ( ) A.①②③④ B.①②③ C.①③④ D.②③④ [ 答案 ]B [ 解析 ] 氧化铁与稀硫酸、稀盐酸都能反应生成可溶性铁盐 , 属于金属氧化物与酸的反应 ; 金属锌与稀硫酸、稀盐酸能反应生成锌盐和氢气 , 属于金属与酸的反应 ; 氢氧化铜与稀硫酸、稀盐酸能反应生成铜盐和水 , 属于碱和酸的反应 ; 氯化钡只能与稀硫酸反应 , 不能与稀盐酸反应。 9. 盐酸是重要的化工产品。 (1) 盐酸可用于金属表面除锈 , 请写出盐酸除铁锈的化学方程式 : 。 [ 答案 ] (1)Fe 2 O 3 +6HCl 2FeCl 3 +3H 2 O [ 解析 ] (1) 铁锈主要成分是氧化铁 , 盐酸与氧化铁反应生成氯化铁和水 , 化学方程式为 Fe 2 O 3 +6HCl 2FeCl 3 +3H 2 O 。 9. 盐酸是重要的化工产品。 (2) 盐酸具有挥发性 , 在空气中打开盛有浓盐酸的试剂瓶瓶盖 , 在瓶口处观察到的现象是 。 [ 答案 ] (2) 有白雾 [ 解析 ] (2) 盐酸具有挥发性 , 在空气中打开盛有浓盐酸的试剂瓶瓶盖 , 氯化氢气体与水蒸气在瓶口处形成盐酸小液滴 , 观察到的现象是有白雾形成。 9. 盐酸是重要的化工产品。 (3) 氨水也具有挥发性 , 可挥发出氨气。如图 14-7, 在 a 、 b 处放有浸泡过浓盐酸或浓氨水的棉花 , 过一会儿在 c 处可观察到的现象是 ,a 处是放有浸泡过 的棉花 ( 已知 :①NH 3 与 HCl 在空气中相遇可反应生成白色固体 NH 4 Cl;② 相对分子质量越小的气体扩散速度越快 ) 。 图 14-7 [ 答案 ] (3) 有白烟 浓氨水 [ 解析 ] (3) 氨气与氯化氢气体反应生成白色固体氯化铵 ,c 处可观察到有白烟生成。相对分子质量越小的气体扩散速度越快 , 故 a 处是放有浸泡过浓氨水的棉花。 9. 盐酸是重要的化工产品。 (4) 实验室可用 NH 4 Cl 与 Ca(OH) 2 固体加热发生复分解反应制取 NH 3 , 请写出此反应的化学方程式 : , 收集 NH 3 可用向 排空气法。 [ 答案 ] (4)2NH 4 Cl+Ca(OH) 2 CaCl 2 + 2NH 3 ↑ +2H 2 O 下 [ 解析 ] (4)NH 4 Cl 与 Ca(OH) 2 固体受热反应生成 NH 3 、氯化钙和水 , 反应的化学方程式为 2NH 4 Cl+Ca(OH) 2 CaCl 2 + 2NH 3 ↑ +2H 2 O,NH 3 密度比空气小 , 收集 NH 3 可用向下排空气法。 10. 下列关于氢氧化钠的描述中错误的是 ( ) A. 易溶于水 , 溶解时放出大量的热 B. 对皮肤具有强烈的腐蚀作用 C. 氢氧化钠溶液能使紫色石蕊试液变红 D. 能去除油污 , 可作炉具清洁剂 题组 4 常见的碱 C 11. 下面是某同学进行碱的化学性质实验时记录的实验现象 , 其中与事实不相符的是 ( ) A. 在 NaOH 溶液中加入稀盐酸 , 无明显变化 B. 在 NaOH 溶液中通入 CO 2 气体 , 有白色沉淀生成 C. 在 Ca(OH) 2 溶液中滴加石蕊试液 , 溶液呈蓝色 D. 在 NaOH 溶液中加入 CuSO 4 溶液 , 有蓝色沉淀生成 B 12. 某同学用如图 14-8 总结 NaOH 的四条化学性质 ( 即 NaOH 能够与四类物质发生化学反应 ) 。 (1) 为验证性质 ①, 该同学将无色酚酞试液滴入 NaOH 溶液中 , 溶液颜色由无色变成 。 图 14-8 [ 答案 ] (1) 红色 [ 解析 ] (1) 氢氧化钠溶液显碱性 , 能使无色酚酞试液变成红色。 12. 某同学用如图 14-8 总结 NaOH 的四条化学性质 ( 即 NaOH 能够与四类物质发生化学反应 ) 。 (2) 为了验证性质 ③, 该同学可选择的物质是 ( 填序号 ) 。 A.Na 2 CO 3 B.HCl C.CuSO 4 D.Ba(NO 3 ) 2 图 14-8 [ 答案 ] (2)C [ 解析 ] (2) 根据复分解反应发生的条件可知 , 氢氧化钠不能与碳酸钠、硝酸钡反应 ;HCl 属于酸 , 不符合题意 ; 氢氧化钠能与硫酸铜溶液反应生成蓝色沉淀。 12. 某同学用如图 14-8 总结 NaOH 的四条化学性质 ( 即 NaOH 能够与四类物质发生化学反应 ) 。 (3) 利用性质 ④, 可以用氢氧化钠溶液吸收二氧化碳气体 , 该反应的化学方程式为 。 图 14-8 CO 2 +2NaOH Na 2 CO 3 +H 2 O 13. 海水提取镁的反应之一为 MgCl 2 +Ca(OH) 2 CaCl 2 +Mg(OH) 2 ↓ , 该反应属于 ( ) A. 化合反应 B. 复分解反应 C. 置换反应 D. 分解反应 题组 5 中和反应 复分解反应 B 14. 中和反应在生活中有广泛应用。下列应用不属于中和反应的是 ( ) A. 用盐酸除铁锈 B. 服用含有氢氧化镁的药物治疗胃酸过多 C. 用熟石灰改良酸性土壤 D. 用硫酸处理印染厂含碱废水 [ 答案 ]A [ 解析 ] 中和反应是指酸和碱的反应 , 用盐酸除铁锈 , 反应物是金属氧化物和酸。 15. 兴趣小组的同学用氢氧化钠溶液和稀盐酸进行中和反应实验 , 具体操作如图 14-9 。 在烧杯中加入 10 mL 的氢氧化钠溶液 , 滴入几滴酚酞试液 , 此时溶液呈 色。接着加入一定量的稀盐酸 , 用玻璃棒搅拌后发现溶液为无色 , 此时 ( 填“能”或“不能” ) 得出两者恰好中和的结论。以下操作及实验现象能证明加入的盐酸过量的是 ( 填序号 ) 。 A. 加入少量铁粉 , 无明显现象 B. 滴加紫色石蕊试液 , 搅拌后溶液变蓝 C. 加入碳酸钠溶液 , 产生气泡 图 14-9 [ 答案 ] 红 不能 C [ 解析 ] 碱性溶液能使无色酚酞试液变红色。加入一定量的稀盐酸后 , 溶液为无色 , 溶液可能呈中性 , 也可能呈酸性 , 不能得出两者恰好中和的结论。若盐酸过量 , 则加入铁粉 , 会产生气泡 , 滴加紫色石蕊试液 , 溶液会变成红色 , 加入碳酸钠溶液 , 会产生气泡 , 综上所述 , 应选 C 。 16. 某实验小组做中和反应的实验 , 向盛有氢氧化钠溶液 ( 滴有酚酞试液 ) 的烧杯中逐滴加入稀盐酸 , 并不断搅拌。如图 14-10 为依据实验数据绘制的 V ( 盐酸 )-pH 图。 (1) 滴加盐酸的体积为 V 1 时 , 溶液呈 色。 (2) 滴加盐酸的体积为 V 2 时 , 溶液中除了水分子 外 , 还存在的微粒有 。 (3) 举出中和反应的一个应用实例 : 。 红 用熟石灰改良酸性土壤等 图 14-10 钠离子和氯离子 考向一 溶液的酸碱性和酸碱度 ( 6 年 6 考) 1. [2016 · 徐州 ] 下列有关实验的叙述错误的是 ( ) A. 酚酞试液遇到白醋不变色 B. 石灰水中滴加硫酸铜溶液产生蓝色沉淀 C. 硝酸铵溶于水使溶液温度降低 D. 红磷在空气中燃烧产生大量白雾 D 2. [2015 · 徐州 ] 下列有关实验操作的叙述中 , 错误的是 ( ) A. 用 pH 试纸测定未知溶液的酸碱度时 , 应将 pH 试纸预先用水湿润 B. 实验室用高锰酸钾制取 O 2 , 在实验结束时应先将导管移出水面 , 再停止加热 C. 稀释浓硫酸时 , 要把浓硫酸缓缓注入盛有水的烧杯中 , 用玻璃棒引流并不断搅拌 D. 在粗盐提纯实验中 , 待蒸发皿中出现较多固体时 , 停止加热 , 利用余热将滤液蒸干 [ 答案 ]A [ 解析 ] 用湿润的 pH 试纸测定溶液的 pH, 有可能会使测得的 pH 不准确。 3. 拓展 某化学组进行“溶液酸碱性的检验”的实验。 (1) 把自制的紫薯汁分别滴加到试管中 , 观察到的现象如下表所示。 据上表推测 , 紫薯汁遇到稀硫酸可能显示的颜色是 , 该汁液 ( 填“能”或“不能” ) 作酸碱指示剂。 溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水 加入紫 薯汁 后 的颜色 红色 红色 紫色 绿色 绿色 红色 能 3. 拓展 某化学组进行“溶液酸碱性的检验”的实验。 (2) 用 pH 试纸测定表中部分溶液的酸碱度 : 草木灰水 pH>7, 属于 ( 填“酸性”“碱性”或“中性” ) 溶液 , 白醋 pH ( 填“ > ”“ < ”或“ = ” )7 。 [ 答案 ] (2) 碱性 < [ 解析 ] (2)pH>7 的溶液属于碱性溶液 ; 向白醋与盐酸中分别加入紫薯汁后 , 试管中溶液均呈红色 , 即白醋呈酸性 , 故其 pH<7 。 3. 拓展 某化学组进行“溶液酸碱性的检验”的实验。 (3) 如图 14-11 是三位同学分别测定土壤酸碱度的操作示意图 , 其中正确的操作是 ( 填“ A ”“ B ”或“ C ” , 下同 ), 可能导致被测溶液的 pH 发生改变的错误操作是 。 图 14-11 [ 答案 ] (3)B C (4)D [ 解析 ] (3) 不能将试纸伸入溶液中 , 以免溶液被污染 ; 不能用润湿的 pH 试纸测定 pH, 否则可能导致测定值不准确。 3. 拓展 某化学组进行“溶液酸碱性的检验”的实验。 (4) 在一次实验开放日活动中 , 小明同学取出一无色溶液 , 向其中滴加酚酞试液后变红色。小明同学得出的下列结论中正确的是 。 A. 该溶液能使石蕊试液变成红色 B. 该溶液的 pH 小于 7 C. 该溶液中的溶质一定是某种碱 D. 该溶液显碱性 [ 答案 ] (4)D [ 解析 ] (4) 碱性溶液能使石蕊试液变蓝 ; 碱性溶液的 pH 大于 7; 碱性溶液的溶质也可能是某种盐 , 比如碳酸钠。 【 技法点拨 】 用 pH 试纸测定未知溶液的 pH 时 , 可按“一蘸、二滴、三比较”的方法进行 , 切不可把试纸伸入待测液中 , 以免污染待测液 ; 也不能用湿润的 pH 试纸 , 否则对测定值可能会有影响 , 具体表现为“酸大碱小中不变”。 考向二 酸和碱的性质与用途 ( 6 年 6 考) 4. [2019 · 徐州 ] 下列实验方案设计不能达到实验目的的是 ( ) A. 用灯帽熄灭酒精灯 , 以说明物质燃烧需要达到着火点 B. 用铁和硫酸铜溶液可验证铁、铜两种金属的活动性强弱顺序 C. 利用盛有浓硫酸的洗气瓶 , 可除去 CO 2 气体中混有的少量水蒸气 D. 用紫色石蕊试液 , 就可区别盐酸、氢氧化钠溶液和食盐水三种无色溶液 [ 答案 ] A [ 解析 ] 用灯帽熄灭酒精灯利用的是隔绝空气的灭火原理 ,A 符合题意 ; 铁能把铜从硫酸铜溶液中置换出来 , 说明铁的活动性比铜强 ,B 不符合题意 ; 浓硫酸具有吸水性 , 且不与二氧化碳反应 , 能用于干燥二氧化碳气体 ,C 不符合题意 ; 将紫色石蕊试液分别滴入三种溶液中 , 溶液变红色 , 则原溶液为稀盐酸 , 溶液变蓝色 , 则原溶液为氢氧化钠溶液 , 溶液不变色 , 则原溶液为食盐水 ,D 不符合题意。 5. [2016 · 徐州 ] 下列有关实验的描述错误的是 ( ) A. 用肥皂水可以区分硬水和蒸馏水 B. 稀释浓硫酸时应将水倒入浓硫酸中 C. 用氢氧化钠溶液可以除去一氧化碳中混有的二氧化碳 D. 蒸发结晶时 , 当蒸发皿中出现较多固体时即可停止加热 [ 答案 ] B [ 解析 ] 稀释浓硫酸时 , 应将浓硫酸慢慢注入水中 , 并用玻璃棒搅拌。 6. [2017 · 徐州 ] 酸、碱、盐是我们身边重要的化合物。 (1) 碱溶液有许多共同性质 , 是因为不同的碱溶液中都有 ( 填离子符号 ) 。 (2) 常用小苏打治疗胃酸过多 , 有关反应的化学方程式是 ______________________ 。 OH - NaHCO 3 +HCl NaCl+H 2 O+CO 2 ↑ 6. [2017 · 徐州 ] 酸、碱、盐是我们身边重要的化合物。 (3) 将一定量的硫酸铜溶液与氢氧化钠溶液混合 , 充分反应后过滤 , 得到无色溶液。该无色溶液中一定含有溶质硫酸钠 , 可能含有溶质 。若要验证这种可能含有的溶质 , 不宜使用 ( 填序号 ) 。 A. 酚酞试液 B.pH 试纸 C. 硫酸铵 D. 氯化钠 [ 答案 ] (3)NaOH( 或氢氧化钠 ) D [ 解析 ](3) 硫酸铜溶液与氢氧化钠溶液发生反应的化学方程式为 2NaOH+CuSO 4 Na 2 SO 4 +Cu(OH) 2 ↓ , 过滤后 , 得到无色溶液 , 说明硫酸铜反应完了 , 氢氧化钠可能反应完 , 也可能过量 , 因此可能含有的溶质是 NaOH 。检验是否含有氢氧化钠 , 就是检验溶液是否呈碱性 , 可以用酚酞 , 观察溶液是否变红 ; 可以测 pH; 可以用硫酸铵 , 观察是否有刺激性气味的气体产生 ; 碱性溶液不与氯化钠反应 , 不能用 NaCl 检验 NaOH 。 7. [2017 · 徐州二模 ] 盛有氢氧化钠溶液的试剂瓶 , 如果密封不好 , 氢氧化钠就会变质。 (1) 写出氢氧化钠变质的化学方程式 : 。 (2) 既能证明氢氧化钠变质 , 又能除去变质氢氧化钠中的杂质 , 该试剂是 ( 填序号 ) 。 A. 稀盐酸 B.Ca(OH) 2 溶液 C.CaCl 2 溶液 D. 稀硫酸 (3) 变质后的氢氧化钠溶液 , 其 pH ( 填“ > ”“ < ”或“ = ” )7 。 2NaOH+CO 2 Na 2 CO 3 +H 2 O B > 8. 拓展 碳酸钙、生石灰、熟石灰在一定条件下可以发生如图 14-12 所示转化关系。 (1) 生石灰是常用的干燥剂 , 其主要成分属于 ( 填序号 ) 。 ① 酸 ② 碱 ③ 盐 ④ 氧化物 ④ 图 14-12 8. 拓展 碳酸钙、生石灰、熟石灰在一定条件下可以发生如图 14-12 所示转化关系。 (2) 写出熟石灰在工农业生产中的一种用途 : 。 图 14-12 [ 答案 ] (2) 改良酸性土壤 ( 合理即可 ) [ 解析 ] (2) 熟石灰可用作建筑材料、改良酸性土壤、配制农药波尔多液等。 8. 拓展 碳酸钙、生石灰、熟石灰在一定条件下可以发生如图 14-12 所示转化关系。 (3) 写出从生石灰得到熟石灰的化学方程式 : 。 CaO+H 2 O Ca(OH) 2 图 14-12 9. 拓展 [2019 · 枣庄 ] 酸、碱、盐在生产生活中具有广泛的用途。化学实验室中有失去标签的四瓶无色溶液 : 稀盐酸、氢氧化钙溶液、碳酸钠溶液、酚酞试液。现将其任意编号为 A 、 B 、 C 、 D, 然后两两组合进行实验 , 其中部分现象如下表 : (1) 酚酞试液是 ( 填编号 ) 。 (2)B 与 C 反应的化学方程式为 , 反应所属的类型是 。 (3) 写出 D 的一种用途 : 。 实验 A+B A+C B+C B+D 现象 溶液变红 溶液变红 产生沉淀 产生气体 [ 答案 ] (1)A (2)Na 2 CO 3 +Ca(OH) 2 CaCO 3 ↓ +2NaOH 复分解反应 (3) 除铁锈 ( 合理即可 ) [ 解析 ] 由表格中现象分析可知 ,A 是酚酞试液 ,B 、 C 分别是氢氧化钙溶液、碳酸钠溶液中的一种 ,D 为稀盐酸 , 可用于除铁锈 ; 由 B+C 产生沉淀、 B+D 产生气体可知 ,B 为碳酸钠溶液 ,C 为氢氧化钙溶液 ;B 与 C 反应 , 是碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠 , 属于复分解反应。 考向三 酸碱中和反应 ( 6 年 3 考) 10. [2018 · 徐州树人二模 ] NaOH 溶液和稀盐酸发生中和反应的过程中 , 溶液 pH 的变化如图 14-13 所示。下列说法正确的是 ( ) A. 反应开始前 , 测量的是 NaOH 溶液的 pH B. b 点时 ,NaOH 和 HCl 恰好完全反应 C. a 点处的溶液能够使酚酞试液变红 D. c 点处的溶液能与 Fe 反应产生气体 图 14-13 [ 答案 ] B [ 解析 ] 根据 pH 曲线走势可知 , 该实验是将氢氧化钠溶液滴入稀盐酸中 ,A 错误 ; 在 a 点 , 稀盐酸没有完全反应 , 溶液呈酸性 , 滴加酚酞不变色 ,C 错误 ;c 点时 , 氢氧化钠过量 , 溶液呈碱性 , 不能与铁发生反应 ,D 错误。 11. [2014 · 徐州 ] 中和反应在工农业生产中应用广泛 , 现向 40 g 10% 的氢氧化钠溶液中不断滴加盐酸 , 同时测定溶液 pH 的变化 ( 曲线如图 14-14) 。请分析计算 : (1)40 g 10% 的氢氧化钠溶液中含有 g 的氢氧化钠 ; 当滴入 36.5 g 盐酸时 , 溶液的 pH 为 。 图 14-14 4 7 11. [2014 · 徐州 ] 中和反应在工农业生产中应用广泛 , 现向 40 g 10% 的氢氧化钠溶液中不断滴加盐酸 , 同时测定溶液 pH 的变化 ( 曲线如图 14-14) 。请分析计算 : (2) 所用盐酸的溶质质量分数。 ( 写出计算过程 ) 图 14-14 (2) 解 : 设盐酸中溶质的质量为 x 。 NaOH+HCl NaCl+H 2 O 40 36.5 4 g x x =3.65 g 所用盐酸的溶质质量分数为 ×100%=10% 。 答 : 所用盐酸的溶质质量分数为 10% 。 12. 拓展 [2019 · 宿迁改编 ] 根据氢氧化钠溶液和稀硫酸反应的微观示意图回答问题。 (1) 写出氢氧化钠溶液和稀硫酸反应的化学方程式 :__________________________ 。 图 14-15 2NaOH+H 2 SO 4 Na 2 SO 4 +2H 2 O 12. 拓展 [2019 · 宿迁改编 ] 根据氢氧化钠溶液和稀硫酸反应的微观示意图回答问题。 (2) 从微观的角度分析 , 上述反应的实质是 。 图 14-15 [ 答案 ] (2)H + +OH - H 2 O [ 解析 ] (2) 比较反应前后的微观示意图可以发现 , 溶液中钠离子和硫酸根离子在反应前后没有改变 , 而 H + 和 OH - 转化为 H 2 O 。 12. 拓展 [2019 · 宿迁改编 ] 根据氢氧化钠溶液和稀硫酸反应的微观示意图回答问题。 (3) 恰好完全中和时 ,Na + 与 S 的个数比为 。 图 14-15 2 : 1查看更多