- 2021-11-12 发布 |
- 37.5 KB |
- 39页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
杭州专版2020中考化学复习方案第11课时物质的变化和性质课件
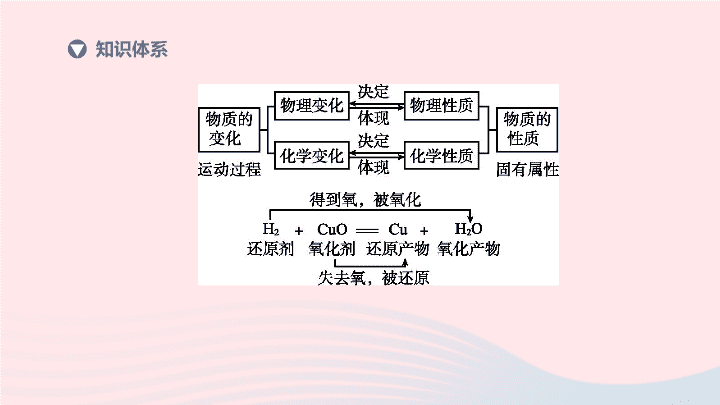
第 11 课时 物质的变化和性质 化学 | 第一部分 考点过关 知识体系 物理变化 化学变化 概念 的变化 生成 的变化 现象 通常在外形、状态等方面发生改变 常伴随发光、放热、颜色变化、生成气体、产生沉淀等现象 1. 物质的物理变化和化学变化 (1) 描述物理变化和化学变化 重点梳理 没有生成新物质 有新物质 ( 续表 ) 物理变化 化学变化 本质 区别 宏观上:物质种类没有变化 微观上:构成物质的微粒本身没有改变,改变的是微粒的间隔 宏观上:物质种类发生变化 微观上:构成物质的微粒的组成或结构发生了改变 联系 化学变化和物理变化往往同时发生 . 化学变化过程中 ( 填 “ 一定 ” 或 “ 不一定 ”) 同时发生物理变化;物理变化过程中不一定同时发生化学变化 一定 (2) 列举和区别常见物质的物理变化和化学变化 物理变化 化学变化 举例 水的三态变化、铁丝弯曲 镁条燃烧、铁钉生锈 判断依据 没有生成新物质 生成新物质 2. 物质主要的物理性质和化学性质 (1) 描述物质主要的物理性质和化学性质 ①物理性质:物质 发生化学变化就表现出来的性质 . 如颜色、状态、气味、密度、熔点、沸点、比热容、硬度、溶解性、挥发性、延展性、吸附性、导电性、导热性、铁磁性等 . ②化学性质:物质在 中表现出来的性质 . 如助燃性、可燃性、稳定性、氧化性、还原性、酸碱性、毒性等 . 不需要 化学变化 (2) 辨认物理性质和化学性质 ①物理性质和化学性质的根本区别在于物质的性质是否需要通过 表现出来 . ②物质的性质和变化的联系和区别 a. 性质和变化是两个不同的概念,性质是物质具有的特征,变化是物质的某种运动过程 . b. 性质和变化是密切相关的 . 性质是物质发生变化的内因,性质决定变化;而变化是性质的具体表现,在化学变化中才能体现出化学性质 . c. 区分某一叙述是指物质的性质还是变化,需注意抓住关键字,如 “ 能 ” “ 会 ”“ 可以 ” 等,则指的是物质的某种性质 . 化学变化 (3) 举例说明外界条件 ( 如温度、压强等 ) 能影响物质的性质 外界条件能影响物质的性质,如温度改变,物质的溶解度会发生变化,如压强改变,物质的沸点会发生变化 . 3. 氧气的氧化性以及氢气、一氧化碳的还原性和可燃性 (1) 能举例说出氧化反应和说明氧气具有氧化性 ①物质与氧 ( 包括氧气和含氧化合物 ) 发生的反应,属于 反应 . ②在氧化反应中,氧气是氧化剂,具有 性 . (2) 能举例说出还原反应和说明氢气和一氧化碳具有还原性 ①含氧化合物里的氧被夺去的反应,属于 反应 . ②在还原反应中,得到氧的物质叫还原剂,具有 性;常见的还原剂有 、 和 等 . 如炼铁的原理: Fe 2 O 3 +3CO 2Fe+3CO 2 . 其中 Fe 2 O 3 是 剂,具有 性; CO 是 剂,具有 性 . 氧化 氧化 还原 还原 碳 一氧化碳 氢气 氧化 氧化 还原 还原 ③常见的还原剂还原氧化铜实验 (续表) (3) 说出氢气和一氧化碳的可燃性,能根据它们的燃烧产物来鉴别氢气和一氧化碳 ①氢气和一氧化碳具有可燃性,点燃它们之前,需要进行 . ②根据燃烧产物来鉴别氢气和一氧化碳 ③可以利用氢气和一氧化碳还原金属氧化物,然后通过氧化产物对它们进行鉴别 . 物质 操作 现象 氢气 原来干冷的烧杯内壁出现水珠,倒置烧杯,注入澄清石灰水,振荡后石灰水不变浑浊 一氧化碳 烧杯内壁保持干燥,倒置烧杯,注入澄清石灰水,振荡后石灰水变浑浊 验纯 对点练习 考点 1 物质的物理变化和化学变化 1. 人们通过化学变化改造物质世界,并实现物质与能量的相互转化 . 化学变化中生成的新物质是指 ( ) A. 分子分成原子,生成新的元素 B. 原子重新组合,生成新的原子 C. 生成了组成或结构与原物质不同的物质 D. 生成了组成和结构与原物质相同的物质 C 2. [2019· 通辽 ] 日常生活中的下列做法,一定会有化学变化的是 ( ) A. 用汽油除油污 B. 用食醋除水垢 C. 用西瓜榨汁 D. 用玻璃刀切割玻璃 B 考点 2 物质主要的物理性质和化学性质 A 3. [2019· 无锡 ] 下列物质的用途仅与其物理性质有关的是 ( ) A. 活性炭作吸附剂 B. 稀盐酸作除锈剂 C. 铁粉作脱氧剂 D. 生石灰作干燥剂 4. 下面几种物质的具体应用,分别利用的性质是: (1) 干冰用于人工降雨: . (2)“ 金粉 ”( 黄铜粉 ) 用于装帧烫金: . (3) 紫甘蓝汁液用作酸碱指示剂: . (4) 浓硫酸用作干燥剂: . 易升华 具有特殊的颜色和金属光泽 遇酸、碱发生特定的颜色变化 具有吸水性 考点 3 氧气的氧化性以及氢气、一氧化碳的还原性和可燃性 5. [2019· 巴中 ] 化学实验小组利用以下装置测定某赤铁矿中氧化铁的纯度,向赤铁矿中通入纯净的一氧化碳气体,假设赤铁矿中杂质不参与反应 . 请回答下列问题 . 图 H11-1 (1) 实验开始时,先进行的操作是 ( 填序号 ). ①通入一氧化碳 ②加热 (2) 实验过程中观察到装置 A 中玻璃管内发生的现象 : . ① 红色固体逐渐变为黑色 5. [2019· 巴中 ] 化学实验小组利用以下装置测定某赤铁矿中氧化铁的纯度,向赤铁矿中通入纯净的一氧化碳气体,假设赤铁矿中杂质不参与反应 . 请回答下列问题 . 图 H11-1 (3) 写出 B 装置发生的化学反应方程式: ; 装置 C 的作用是 ___________________________________________________________ . (4) 从环境保护的角度看,现实验存在的缺陷是 . CO 2 +2NaOH Na 2 CO 3 +H 2 O 防止空气中的二氧化碳进入装置 B 中,影响赤铁矿中氧化铁纯度的测定 没有尾气处理装置 5. [2019· 巴中 ] 化学实验小组利用以下装置测定某赤铁矿中氧化铁的纯度,向赤铁矿中通入纯净的一氧化碳气体,假设赤铁矿中杂质不参与反应 . 请回答下列问题 . 图 H11-1 (5) 实验前称量赤铁矿的质量为 20 g ,通入足量的一氧化碳完全反应后 B 装置总质量增加了 13.2 g. 则赤铁矿中氧化铁的纯度为 . 80% 6. 某化学兴趣小组利用如图 H11-2 所示装置进行实验,探究工业炼铁的化学原理,试按要求回答下列问题 . 图 H11-2 (1) 硬质玻璃管中观察到的现象是 ,写出一氧化碳和氧化铁反应的化学方程式: . (2) 实验时首先通入一氧化碳的目的是 ______________________________________ . 红色固体变为黑色 3CO+Fe 2 O 3 2Fe+3CO 2 排尽玻璃管内的空气,防止加热时发生 爆炸 6. 某化学兴趣小组利用如图 H11-2 所示装置进行实验,探究工业炼铁的化学原理,试按要求回答下列问题 . 图 H11-2 (3) 装置中导管末端加一点燃的酒精灯的目的是 _____________________________ . 除去多余的 CO ,防止污染 空气 例 1 充有钠蒸气的高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明 . 钠的化学性质活泼,常温下可以与氧气、水反应,在实验室里,金属钠保存在煤油中,用镊子从煤油中取出金属钠,放在滤纸上,用小刀切下一小块,投入盛有水 ( 滴有酚酞试液 ) 的烧杯中,发现钠块浮在水面上,很快熔化成银白色小球,四处游动,发出嘶嘶的响声,偶有火星出现,溶液变成红色 . 依据提供的信息,回答下列问题 . (1)“ 钠保存在煤油中 ” 说明钠具有的化学性质是 . (2)“ 钠块浮在水面上 ” 说明钠具有的物理性质是 . 重点一 区别和辨认物理变化和化学变化、物理性质和化学性质 常温下可以与氧气、水反应 图 H11-3 钠的密度比水的密度小 例 1 充有钠蒸气的高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明 . 钠的化学性质活泼,常温下可以与氧气、水反应,在实验室里,金属钠保存在煤油中,用镊子从煤油中取出金属钠,放在滤纸上,用小刀切下一小块,投入盛有水 ( 滴有酚酞试液 ) 的烧杯中,发现钠块浮在 水面上,很快熔化成银白色小球,四处游动,发出嘶嘶的 响声,偶有火星出现,溶液变成红色 . 依据提供的信息, 回答下列问题 . (3)“ 溶液变成红色 ” 说明钠与水反应的生成物中含有 性的物质 . (4) 根据所学知识解释钠 “ 熔化成银白色小球 ” 的原因是 . 碱 图 H11-3 钠的熔点低 重点二 能说明氧气的氧化性和氢气、一氧化碳具有还原性 例 2 [2017· 杭州 ] 小金利用图 H11-4 所示装置进行甲、乙对比实验,探究温度对 CO 和 Fe 2 O 3 反应的影响 ( 固定装置略 ). 图 H11-4 (1) 从实验安全角度考虑,图示装置还应采取的改进措施是 __________________ . 步骤 操作 甲组现象 乙组现象 1 称量黑色粉末质量 /g m 1 m 2 2 取黑色粉末,用 磁铁吸引 能被吸引 能被吸引 3 取黑色粉末, 加入稀盐酸 全部溶解 ,有 大量气泡 无 明显现象 4 取黑色粉末, 加入足 量 CuSO 4 溶液 有红色 物质生成 无 明显现象 在装置末端尖嘴导管处,放置一盏燃着的酒精灯 例 2 [2017· 杭州 ] 小金利用图 H11-4 所示装置进行甲、乙对比实验,探究温度对 CO 和 Fe 2 O 3 反应的影响 ( 固定装置略 ). 图 H11-4 步骤 操作 甲组现象 乙组现象 1 称量黑色粉末质量 /g m 1 m 2 2 取黑色粉末,用 磁铁吸引 能被吸引 能被吸引 3 取黑色粉末, 加入稀盐酸 全部溶解 ,有 大量气泡 无 明显现象 4 取黑色粉末, 加入足 量 CuSO 4 溶液 有红色 物质生成 无 明显现象 (2) 完全反应后,两组的生成物均为黑色粉末 ( 纯净物 ) ,分别用两组生成物进行以下实验: ①甲组的黑色粉末与稀盐酸反应的化学方程式是 . ②小金查阅资料后发现 Fe 3 O 4 在常温下不与稀盐酸、 CuSO 4 溶液反应,故猜想乙组的生成物为 Fe 3 O 4 . 他又发现 m 2 恰好为 g ,这可成为支持上述猜想的新证据 . (3) 甲、乙两组实验说明温度对 CO 和 Fe 2 O 3 反应有影响,且均体现出 CO 的 ( 填写化学性质 ). Fe+2HCl FeCl 2 +H 2 ↑ 4.64 还原性和可燃性 重点三 氢气、一氧化碳等气体的鉴别 例 2 某混合气体可能含有 CO 、 H 2 、 CO 2 、 H 2 O( 气 ) 中的一种或几种 . 为验证其组成,同学们进行实验的装置和现象如图 H11-5( 夹持仪器已省略,假设气体均吸收完全 ) : 图 H11- 5 结论 甲 乙 丙 含有 CO 、 H 2 、 H 2 O( 气 ) 含有 CO 、 H 2 、 CO 2 含有 CO 、 H 2 、 CO 2 、 H 2 O( 气 ) (1) 仪器 a 的名称是 . (2) 装置 D 中溶液变浑浊的化学方程式是 . 点燃尾气,火焰呈 色 . 图 H11- 5 锥形瓶 CO 2 +Ca(OH) 2 CaCO 3 ↓ +H 2 O 蓝 例 2 某混合气体可能含有 CO 、 H 2 、 CO 2 、 H 2 O( 气 ) 中的一种或几种 . 为验证其组成,同学们进行实验的装置和现象如图 H11-5( 夹持仪器已省略,假设气体均吸收完全 ) : 图 H11- 5 (3) 丁认为,由于他们对装置 ( 填序号 ) 中的实验现象分析不同而导致结论有差异 . 根据碳酸盐可转化为 CO 2 的性质,丁利用上述实验结束后装置内药品和某种常见试剂进行实验,证明了甲的结论是正确的 . 请写出丁的实验操作过程与现象: A 将 A 中固体取出,加入烧杯 ( 或试管 ) 中,加入过量稀盐酸,无明显现象 1. 下列质量增加的变化有一种与其他三种存在本质的区别,这种变化是 ( ) A. 长期放置在空气中的氢氧化钠质量增加 B. 长期敞口放置的浓硫酸质量增加 C. 久置的生石灰质量增加 D. 久置的铁钉生锈质量增加 B 2. [2018· 仙桃 ] 亚硝酸钠 (NaNO 2 ) 是一种工业用盐,人若误食会中毒 . 下列选项中给出了亚硝酸钠的性质,则有关亚硝酸钠性质归类的判断错误的是 ( ) A.NaNO 2 有咸味 —— 物理性质 B.NaNO 2 的水溶液呈碱性 —— 物理性质 C.NaNO 2 为白色固体 —— 物理性质 D.NaNO 2 有毒 —— 化学性质 B 3. 关于木炭、一氧化碳、氢气分别与氧化铜的反应,下列说法错误的是 ( ) A. 都有红色物质生成 B. 都有还原剂参加反应 C. 都是置换反应 D. 反应都需要加热或高温 C 4. [2018· 杭州 ] 图 H11-6 为氢气还原氧化铜的实验装置图 . 下列有关分析正确的是 ( ) A. 装置中试管口需略向下倾斜,主要是为了利于通入氢气 B. 在给试管内药品加热前,需先通氢气排尽试管内的空气 C. 待药品完全反应后,需同时撤去酒精灯和通氢气的导管 D. 该实验装置也可直接用于一氧化碳还原氧化铜的实验 B 图 H11-6 5. 图 H11-7 中甲是氢气和氧化铜反应的实验,图乙是木炭和氧化铁反应的实验 . 图 H11-7 (1) 在上述两个实验中,氢气和木炭表现出相同的化学性质是 性 . (2) 实验步骤的先后次序非常重要,比如甲实验中,反应前必须先通氢气后点燃酒精灯,否则易发生爆炸;反应结束后必须先 ,后 ,否则生成的红色的铜会变成黑色 . 还原 移走酒精灯 停止通氢气 5. 图 H11-7 中甲是氢气和氧化铜反应的实验,图乙是木炭和氧化铁反应的实验 . 图 H11-7 (3) 某同学正确操作做完乙实验后,发现澄清石灰水变浑浊,试管中粉末全部变为黑色,取少量黑色粉末,加入足量稀硫酸充分振荡,但她惊讶地发现黑色粉末没有溶解,试管中也未产生预期的气泡,这说明该反应并没有生成 . 铁 ( 或 Fe) (4) 查阅资料,得到关于铁的氧化物的如下信息: 根据以上信息,试写出乙实验试管中反应的化学方程式 . 经分析后,该同学试着提高反应温度后,实验出现了预期的现象 . 图 H11-7 铁的氧化物化学式 Fe 2 O 3 Fe 3 O 4 FeO 颜色 红 黑 黑 化学性质 可溶于酸 常温下 不溶 于稀酸 可溶于酸 C+6Fe 2 O 3 4Fe 3 O 4 +CO 2 ↑查看更多