- 2021-11-11 发布 |
- 37.5 KB |
- 31页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学复习:工艺流程题课件
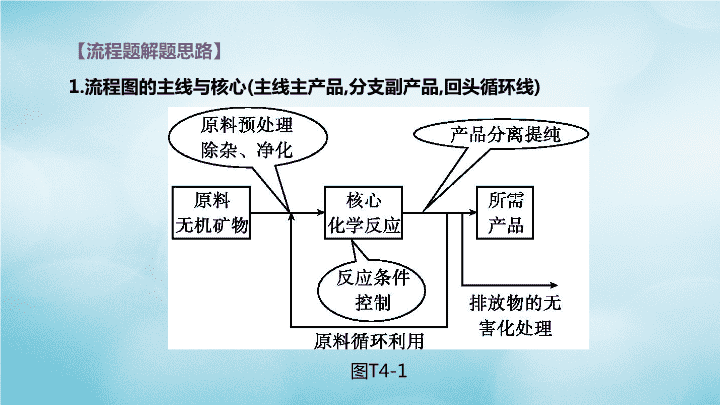
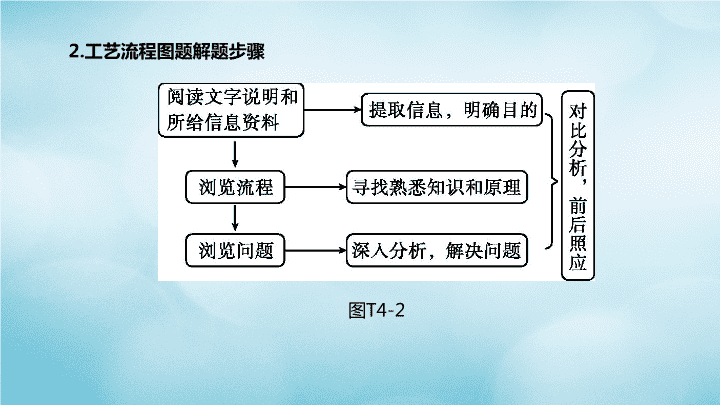
题型突破(四) 工艺流程题 【流程题解题思路】 1.流程图的主线与核心(主线主产品,分支副产品,回头循环线) 图T4-1 2.工艺流程图题解题步骤 图T4-2 3.常见的答题热点 (1)粉碎目的:加速溶解或增大反应物的接触面积,加快反应速率。 (2)循环利用的物质:流程中箭头返回的物质或生产出与原料一样的副产品。 (3)核心反应化学方程式:箭头进去的一般是反应物,箭头出来的一般是生成物(还 要注意水和氧气是否参加反应)。 (4)加入过量试剂的目的:将原物质中的杂质完全反应掉。 类型一 海水加工 例1 [2019·滨州]镁是一种用途广泛的金属,目前世界上60%的镁是从海水(溶质 主要含有NaCl和MgCl2)中提取的,主要步骤如下: (1)工业生产中,加入试剂①发生反应的化学方程式为 ,试剂 ②的名称为 。 图T4-3 [答案](1)MgCl2+Ca(OH)2 Mg(OH)2↓+CaCl2 盐酸(或稀盐酸) [解析](1)由题意知海水中含有氯化钠和氯化镁,结合流程图可知,加入试剂①后 得到氢氧化镁沉淀,可知试剂①为氢氧化钙(廉价易得),发生的反应为MgCl2+ Ca(OH)2 Mg(OH)2↓+CaCl2;由于氢氧化镁是沉淀,要转化为氯化镁,只能和 稀盐酸反应,所以试剂②是稀盐酸。 例1 [2019·滨州]镁是一种用途广泛的金属,目前世界上60%的镁是从海水(溶质 主要含有NaCl和MgCl2)中提取的,主要步骤如下: (2)写出无水MgCl2在熔融状态下电解制取金属镁的化学方程式: 。 该反应属于基本反应类型中的 反应。 图T4-3 [答案] (2)MgCl2 Mg+Cl2↑ 分解 [解析] (2)电解无水氯化镁时会生成镁和氯气,属于分解反应,其反应的化学方 程式为MgCl2 Mg+Cl2↑。 类型二 金属的制备、回收和利用 例2 [2019·湘潭]某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。现欲 回收铜和锌,并对硫进行环保处理,主要步骤如图T4-5所示: 已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。 图T4-5 (1)烟泥最初处理需要除油污,用洗涤剂 除油污的过程中发生了 现象。 步骤①产生的废气B中,一定含有的有害 气体是 (填化学式)。环保处理 最好采用的试剂是 (填序号)。 A.浓硫酸 B.食盐水 C.石灰乳 [答案] (1)乳化 SO2 C [解析] (1)用洗涤剂除油污发生的是 乳化现象。烟泥中存在硫单质,在空 气中加热产生的有害气体是SO2。 SO2能与碱性溶液反应,处理时应选 用碱性试剂,即选用石灰乳。 例2 [2019·湘潭]某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。现 欲回收铜和锌,并对硫进行环保处理,主要步骤如图T4-5所示: 已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。 图T4-5 (2)写出步骤④中得到铜的化学 方程式: ,它属于基本 反应类型中的 反应。 [答案] (2)Zn+CuSO4 Cu+ZnSO4 置换 [解析] (2)固体A中含有CuO、ZnO,和过量的 稀硫酸反应过滤后得到的溶液C中含有ZnSO4、 CuSO4和H2SO4,故步骤④中得到铜的化学方 程式为Zn+CuSO4 Cu+ ZnSO4;该反应是 一种单质和一种化合物反应生成了另一种单质 和另一种化合物,属于置换反应。 例2 [2019·湘潭]某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。现 欲回收铜和锌,并对硫进行环保处理,主要步骤如图T4-5所示: 已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。 图T4-5 (3)步骤③和④中主要操作的名称是 。 [答案] (3)过滤 [解析] (3)步骤③和④都能将固体和液体 分开,是过滤操作。 例2 [2019·湘潭]某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。现 欲回收铜和锌,并对硫进行环保处理,主要步骤如图T4-5所示: 已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。 图T4-5 (4)我国古代就制得了一种外观似金子的 锌和铜的合金,也就是黄铜,它的硬度比 纯铜 (填“高”或“低”)。 [答案] (4)高 [解析] (4)一般情况下,合金跟组成它 的纯金属相比硬度更大,所以黄铜的 硬度比纯铜的高。 例2 [2019·湘潭]某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。现 欲回收铜和锌,并对硫进行环保处理,主要步骤如图T4-5所示: 已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。 图T4-5 (5)取少量的溶液C,往其中加入一定 质量的镁粉,充分反应后过滤,得到滤 渣和滤液。往滤渣中加入稀盐酸有 气泡产生,则滤液中一定没有 (填 序号)。 A.硫酸镁 B.硫酸锌 C.硫酸铜 D.硫酸铜和硫酸锌 [答案] (5)C [解析] (5)溶液C中含有H2SO4、CuSO4 和ZnSO4,加入一定质量的镁粉后,先后发 生的反应有Mg+CuSO4 MgSO4+Cu, Mg+H2SO4 MgSO4+H2↑,Mg+ ZnSO4 MgSO4 +Zn,在滤渣中加入稀 盐酸有气泡产生,说明滤渣中一定有固体 Zn存在,则溶液中CuSO4一定不存在。 类型三 矿产资源加工 例3 [2019·烟台]我国煤炭资源丰富。某实验室设计的利用水煤浆(由煤和水混 合而成)制备氢气的生产工艺如图T4-9流程一所示。 流程一 制备氢气。 (1)气化器中发生的主要反应为:Ⅰ.H2O+C CO+H2;Ⅱ.CO+H2O CO2+ H2。其中属于置换反应的是 (填“Ⅰ”或“Ⅱ”), 反应Ⅱ中发生还原反应的物 质是 。 图T4-9 [答案]流程一(1)Ⅰ H2O [解析]流程一(1)置换反应是一种单质和一种化合物反应生成另一种单质和另 一种化合物的反应,所以属于置换反应的是Ⅰ;氧化剂发生还原反应,反应Ⅱ中发 生还原反应的物质是H2O。 例3 [2019·烟台]我国煤炭资源丰富。某实验室设计的利用水煤浆(由煤和水混 合而成)制备氢气的生产工艺如图T4-9流程一所示。 流程一制备氢气。 (2)重整器的作用是 ,重整器中发生反 应的化学方程式是 。 图T4-9 [答案]流程一(2)分离CO2和H2,得到纯净的氢气 CaO+CO2 CaCO3 [解析]流程一(2)重整器的作用是分离CO2和H2,得到纯净的氢气;重整器中氧化 钙与二氧化碳反应生成碳酸钙。 例3 [2019·烟台]我国煤炭资源丰富。某实验室设计的利用水煤浆(由煤和水混 合而成)制备氢气的生产工艺如图T4-9流程一所示。 流程一 制备氢气。 (3)该流程中可以循环使用的物质是 。 图T4-9 [答案]流程一(3)氧化钙、碳酸钙 [解析]流程一(3)既是反应物也是生成物的物质可以循环使用,所以该流程中可 以循环使用的物质是氧化钙和碳酸钙。 例3 [2019·烟台]我国煤炭资源丰富。某实验室设计的利用水煤浆(由煤和水混 合而成)制备氢气的生产工艺如图T4-9流程一所示。 流程二 为充分利用流程一产生的高纯度二氧化碳,该实验室又设计了如图中 流程二所示的两种工艺,分别制备尿素和乙二醇。 (1)在高温高压下,CO2和NH3可以合成尿素[CO(NH2)2],同时生成水,该反应的化 学方程式为 。 尿素属于化肥中的________ 肥,能使作物枝叶繁茂。 图T4-9 [答案] 流程二(1)CO2+2NH3 CO(NH2)2+H2O 氮 [解析] 流程二(1)二氧化碳和氨气在高温高压的条件下生成尿素和水,化学方程 式为CO2+2NH3 CO(NH2)2+H2O;尿素属于化肥中的氮肥,能使作物枝 叶繁茂。 例3 [2019·烟台]我国煤炭资源丰富。某实验室设计的利用水煤浆(由煤和水混 合而成)制备氢气的生产工艺如图T4-9流程一所示。 流程二 为充分利用流程一产生的高纯度二氧化碳,该实验室又设计了如图中 流程二所示的两种工艺,分别制备尿素和乙二醇。 (2)以CO和H2为原料生产乙二醇(C2H6O2)时,按照“绿色化学”原则,应调节原 料中CO和H2的分子个数比 为 。 图T4-9 [答案] 流程二(2)2∶3 [解析] 流程二(2)乙二醇(C2H6O2)中C、H原子个数比为1∶3,由化学反应前后 各原子个数不变,可得参加反应的CO、H2的分子个数比为2∶3。 类型四 环境保护 例4 某烟气脱硫的工艺不仅能消除SO2,还能将其转化为石膏(CaSO4·2H2O)等 产品,实现“变废为宝”。主要物质转化关系如图T4-14所示。 请回答: (1)设备1中,通过喷淋水脱去烟气中的SO2,该反应的化学方程式为_____________ 。 (2)设备2中,加入CaCO3的目的是 将H2SO3转化为 。 图T4-14 SO2+H2O CaSO3 H2SO3 例4 某烟气脱硫的工艺不仅能消除SO2,还能将其转化为石膏(CaSO4·2H2O)等 产品,实现“变废为宝”。主要物质转化关系如图T4-14所示。 请回答: (3)设备3中,反应前后化合价发生改变的元素是 。 图T4-14 [答案] (3)O、S [解析] (3)氧气和CaSO3反应生成硫酸钙,氧元素由0价变为-2价,硫元素由+4价 变为+6价。查看更多