- 2021-11-10 发布 |
- 37.5 KB |
- 40页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
杭州专版2020中考化学复习方案第07课时酸和碱课件
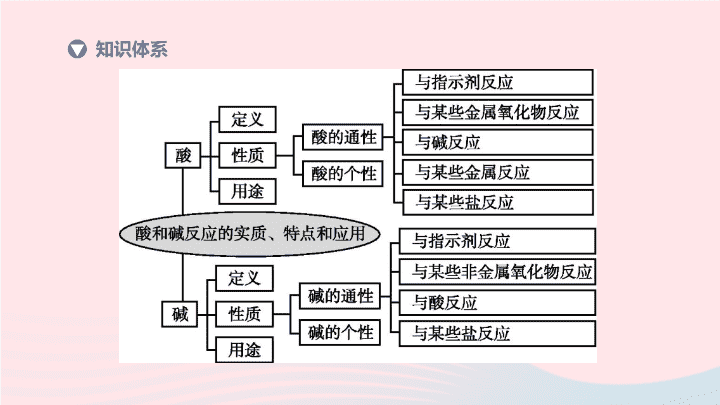
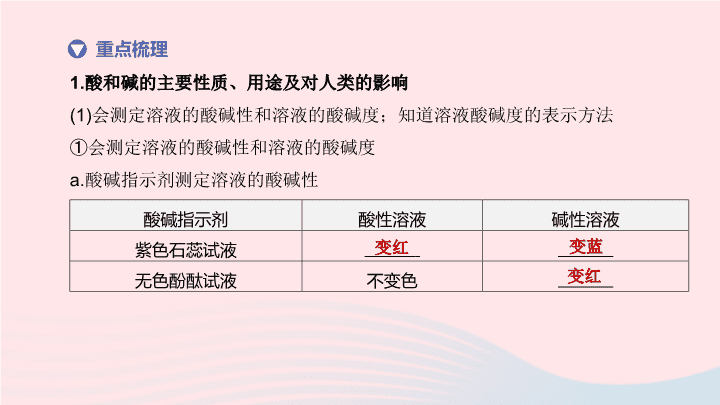
第 7 课时 酸和碱 | 第一部分 考点过关 知识体系 酸碱指示剂 酸性溶液 碱性溶液 紫色石蕊试液 无色酚酞试液 不变色 1. 酸和碱的主要性质、用途及对人类的影响 (1) 会测定溶液的酸碱性和溶液的酸碱度;知道溶液酸碱度的表示方法 ①会测定溶液的酸碱性和溶液的酸碱度 a. 酸碱指示剂测定溶液的酸碱性 重点梳理 变红 变蓝 变红 b.pH 试纸测定溶液的酸碱度 使用方法:在玻璃片或白瓷板上放一片 pH 试纸,用洁净的 蘸取少量溶液滴到试纸上,把试纸显示的颜色与 比较,即可得出溶液的 pH. 玻璃棒 标准比色卡 【 注意 】 使用时不能用水将 pH 试纸润湿,否则会稀释待测溶液,使结果不准,如测酸性溶液会使结果偏大,测碱性溶液会使结果偏小;不能直接把试纸浸入被测溶液中,以免污染溶液;检验气体的酸碱性时可将试纸润湿再用 . ②知道溶液酸碱度的表示方法 pH 的范围通常在 0~14 之间, pH 7 ,溶液显酸性, pH 越小,酸性越 ; pH 7 ,溶液显碱性, pH 越大,碱性越 ; pH 7 ,溶液显中性 . ③酸碱性是物质的化学性质 实质是溶液中的 离子使溶液显酸性, 离子使溶液显碱性 . 故酸性溶液中一定含有 离子,碱性溶液中一定含有 离子 . 注意:酸性溶液不一定是酸溶液,碱性溶液不一定是碱溶液,但酸溶液一定显酸性,碱溶液一定显碱性 . < 强 > 强 = 氢 氢氧根 氢 氢氧根 (2) 了解电离的概念,知道电离方程式的含义 ①电离:物质 或 而形成自由移动离子的过程 . ②电离方程式:用化学式和离子符号表示电离过程的式子 . (3) 说出酸的含义,列举常见的酸;说出盐酸、硫酸等常见酸的性质和用途;概述盐酸、硫酸等酸的共性,并说明原因 ①定义:电离时产生的阳离子全部是 的化合物叫酸,常见的酸有盐酸、硫酸和硝酸等 . 溶解于水 受热熔化 H + ②概述盐酸、硫酸等酸的共性、并说明原因: a. 能使紫色石蕊试液变 . b. 与碱反应生成 和 . c. 与某些金属氧化物反应生成 和 . d. 与活泼金属反应生成盐和 . e. 与某些盐反应生成 和 . 酸的共性实质上是 的性质 . ③说出盐酸、硫酸等常见酸的性质和用途,强酸的使用注意事项 盐酸:浓盐酸具有 性 . 浓盐酸在空气里会形成 ,这是挥发出的 气体与空气中的 接触形成的 的缘故 . 工业用的浓盐酸因含有少量杂质而略带 色 . 浓盐酸具有强烈的腐蚀性 . 红 盐 水 盐 水 氢气 新酸 新盐 H + 挥发 白雾 HCl 水蒸气 盐酸小液滴 黄 硫酸:纯净的硫酸是 色、黏稠、 状液体, 挥发 . 浓硫酸具有 性、 性和强烈的腐蚀性,在使用时应特别小心 . 若不慎溅到皮肤上,要先用干布拭去,然后用 冲洗,最后用 3%~5% 的 溶液冲洗 . 浓硫酸可用作干燥剂,溶于水会放出大量的热 . 在稀释浓硫酸时,一定要把 沿器壁 注入 中,并不断 . 切不可将 倒进 里 . 硝酸:硝酸具有 性和强烈的腐蚀性,还具有强氧化性,故一般不能用它制取氢气 . 无 油 不易 吸水 脱水 大量清水 NaHCO 3 浓硫酸 缓慢 水 搅拌 水 浓硫酸 挥发 AgNO 3 白色 BaCl 2 [ 或 Ba(NO 3 ) 2 ] 白色 (5) 说出碱的含义,列举常见的碱;概述氢氧化钠、氢氧化钙等常见碱的性质和用途;概述氢氧化钠、氢氧化钙等碱的共性,并说明原因 ①定义:电离时产生的阴离子全部是 的化合物叫碱,常见的碱有氢氧化钠、氢氧化钙等 . ②概述氢氧化钠、氢氧化钙等碱的共性,并说明原因 a. 碱的水溶液能使紫色石蕊试液变 ,能使无色酚酞试液变 . b. 与酸反应生成 和 . c. 与某些非金属氧化物反应生成 和 . d. 与某些盐反应生成 和 . 碱的共性实质上是 的性质 . OH - 蓝 红 盐 水 盐 水 新碱 新盐 OH - ③概述氢氧化钠、氢氧化钙等常见碱的性质和用途,强碱的使用注意事项 氢氧化钠:俗称 、 、 ,是 色固体, _______ 溶于水,溶解时 热 . 暴露在空气中的固体 NaOH 易吸收 而潮解,可用作 .NaOH 对皮肤、纸张、织物等有强烈的腐蚀性,若不慎沾在皮肤上,要立即用大量水冲洗,再涂上硼酸溶液 .NaOH 露置于空气中还会吸收空气中的 而变质,反应的化学方程式为 . 烧碱 火碱 苛性钠 白 放 水蒸气 干燥剂 易 CO 2 氢氧化钙:俗称 、 ,是一种 色粉末状物质,微溶于水,其水溶液俗称 .Ca(OH) 2 对皮肤、衣服等有腐蚀作用 . Ca(OH) 2 可由氧化钙和水反应生成,化学方程式为 ,反应的过程中放出大量的热 . 工业上通过煅烧石灰石来生产氧化钙,化学方程式为 ,氧化钙俗称 ,具有 性,常用作干燥剂 . 熟石灰 消石灰 白 石灰水 生石灰 吸水 2. 酸和碱的反应 (1) 说出酸和碱反应的实质和特点 ①实质: 和 结合生成 . ②特点:酸和碱的反应,反应前后溶液的 会发生变化,且属于 反应 . (2) 举例说明酸和碱反应的应用 ①农业上:常用 改良酸性土壤 . ②工业上:利用酸中和碱性污水,利用碱中和酸性污水 . ③医疗上:可服用碱性药物来中和过多胃酸,如含 Al(OH) 3 的药物,化学方程式: . H + OH - H 2 O pH 放热 熟石灰 对点练习 考点 1 酸和碱的主要性质、用途及对人类的影响 1. 如图 H7-1 ,向点滴板① ~ ④滴孔中分别滴入指示剂后,①②③④滴孔内溶液显示的颜色依次是 ( ) A. 无色、红色、蓝色、红色 B. 红色、蓝色、黄色、紫色 C. 蓝色、红色、紫色、无色 D. 无色、蓝色、红色、蓝色 A 图 H7-1 2. [2018· 常州 ] 利用如图 H7-2 所示的实验探究物质的性质 . 下列叙述错误的是 ( ) A. ②处有气泡,③处无现象,则可判断锌、铜的金属活动性 B. ①②④⑤处有明显现象,则 M 可能为稀盐酸 C. ⑤处固体明显减少,则 M 可能为稀硫酸 D. ⑥处反应放热,则 N 可能是氢氧化钠溶液 C 图 H7-2 3. 浓硫酸和浓盐酸敞口放置在空气中一段时间后,溶液中 ( ) A. 溶质的质量分数都变小 B. 溶液的质量都增大 C. 溶质的质量分数都变大 D. 溶质的质量分数前者变大,后者变小 A 4. 区分稀盐酸和稀硫酸,应选用的药品是 ( ) A.BaCl 2 溶液 B.NaCl 溶液 C. 稀硝酸 D. 酚酞试液 A 5. 研究氢氧化钠性质实验中的部分实验及现象记录如下,其中现象不合理的是 ( ) C 序号 实验 现象 A 将氢氧化钠固体放在表面皿上,放置一会儿 固体受潮,逐渐溶解 B 向盛有氢氧化钠溶液的试管中滴入无色酚酞试液 溶液变红 C 向盛有氢氧化钠溶液的试管中滴加稀盐酸 有氯化钠生成 D 向盛有氢氧化钠溶液的试管中滴加硫酸铜溶液 产生蓝色沉淀 6. 实验小组用传感器探究稀 NaOH 溶液与稀盐酸反应过程中温度和 pH 的变化 . 测定结果如图 H7-3 所示 . 下列说法不正确的是 ( ) A. 反应过程中有热量放出 B.30 s 时,溶液中溶质为 HCl 和 NaCl C. 该实验是将稀盐酸滴入稀 NaOH 溶液 D. 从 20 s 到 40 s ,溶液的温度升高、 pH 增大 考点 2 酸和碱的反应 C 图 H7-3 7. [2018· 临沂 ] 向 NaOH 溶液中滴入稀盐酸至恰好完全反应 . (1) 如图 H7-4 表示该反应前后溶液中存在的主要离子,在下面横线上写出每种图形表示的离子 ( 填离子符号 ). (2) 发生反应的化学方程式是 . OH - 图 H7-4 Na + 7. [2018· 临沂 ] 向 NaOH 溶液中滴入稀盐酸至恰好完全反应 . (3) 下列物质中只有一种能与 KOH 溶液发生上述类似反应,应是 ( 填序号 ). ① HNO 3 ② CuSO 4 ③ CaCl 2 ① 重点一 说出盐酸、硫酸等常见酸的共性及其原因 例 1 [2019· 长春 ] 通过如下实验对稀硫酸部分化学性质进行验证,回答下列问题 . 实验一: Mg 和稀硫酸 实验二: MgO 和稀硫酸 实验三: Ba(NO 3 ) 2 溶液和稀硫酸 实验四: KOH 溶液和稀硫酸 (1) 实验三中发生反应的化学方程式为 . (2) 实验四无明显现象,再将打磨过的铁丝浸入该实验后的溶液中,仍无明显现象,据此 ( 填 “ 能 ” 或 “ 不能 ”) 验证 KOH 溶液和 H 2 SO 4 发生了反应 . 能 (3) 将上述所有实验后的溶液混合,并进行如下实验: ①写出滤液 a 中所含溶质的所有可能情况 _________________________________ . ②分析上述实验,下列说法正确的是 ( 填序号 ). A. 用白色沉淀 A 一定能除去 MgCl 2 溶液中的少量盐酸 B. 用白色沉淀 B 能检验 CaCl 2 溶液中是否含有盐酸 C. 用滤液 b 与适量的 K 2 SO 4 溶液混合, 过滤,制备 KNO 3 溶液 D. 向溶液 c 中加入过量的 NaOH 溶液或 过量的 Na 2 CO 3 溶液都有明显的现象 图 H7-5 KNO 3 、 Mg(NO 3 ) 2 或 KNO 3 、 Mg(NO 3 ) 2 、 HNO 3 BD 重点二 会鉴别氯离子和硫酸根离子,能区别盐酸和硫酸 ( 续表 ) (1) 方案 Ⅱ 的实验结论如果正确,步骤①中滴加的物质是 . (2) 方案 Ⅰ 和 Ⅲ 中,结论不成立的方案是 , 理由是 . (3) 方案 Ⅲ 的滤渣中,滴加稀硝酸是为了排除 的干扰 . 稀盐酸 方案 Ⅰ 不能排除 Ag + 的干扰 重点三 概述氢氧化钠、氢氧化钙等常见碱的共性及其原因 例 3 [2018· 长春 ] 为验证 Ba(OH) 2 的化学性质做如图 H7-6 所示的四个实验: 图 H7-6 (1) 实验一中能够观察到的明显现象是 . (2) 实验二、三验证了 Ba(OH) 2 能和某些 ( 填物质类别 ) 发生化学反应 . (3) 实验四中发生反应的化学方程式为 . 溶液变红色 盐 例 3 [2018· 长春 ] 为验证 Ba(OH) 2 的化学性质做如图 H7-6 所示的四个实验: 图 H7-6 (4) 将上述实验后四支试管中的所有物质倒入同一个烧杯,充分混合后过滤,得到白色固体和溶液 A. 取一定量溶液 A ,加入少量 Ba(OH) 2 溶液,振荡后只得到无色溶液 . 综上分析,溶液 A 中除酚酞外,一定还含有的溶质是 ________________ . 氯化氢、氯化钠、 氯化镁 重点四 说出酸和碱反应的实质和特点 例 4 [2019· 遵义 ] 在研究 “ 酸碱中和反应 ” 时,某兴趣小组同学想证明稀盐酸与氢氧化钠溶液混合后是否发生了化学反应,进行了如下探究: (1) 在盛有氢氧化钠溶液的烧杯中滴入几滴酚酞试液,再逐滴加入稀盐酸,并不断搅拌 ( 如图 H7-7 甲 ). 用数字化传感器测得盐酸与氢氧化钠溶液混合前后的温度变化情况 ( 如图乙 ). 由实验现象和曲线变化情况 分析可知,盐酸和氢氧化钠溶液发生了反应并 ( 填 “ 吸收 ” 或 “ 放出 ”) 热量 . 放出 图 H7-7 例 4 [2019· 遵义 ] 在研究 “ 酸碱中和反应 ” 时,某兴趣小组同学想证明稀盐酸与氢氧化钠溶液混合后是否发生了化学反应,进行了如下探究: (2) 从微观角度分析盐酸与氢氧化钠溶液的反应 . 由图 H7-8 可知,该反应的微观实质是 . 交流讨论 同学们讨论后认为,如果盐酸和氢氧化钠减少 ( 或消失 ) ,或者有新物质生成,都能证明反应已经发生 . 氢离子和氢氧根离子结合生成水分子 图 H7-8 步骤 现象 结论 实验 1 :取烧杯中的溶液少许于试管中,加入硫酸铜溶液 证明没有 NaOH 实验 2 ;另取烧杯中的溶液少许于试管中,加入硝酸银溶液 出现白色沉淀 证明含有 HCl 实验 3 :再取烧杯中的溶液少许于蒸发皿中,加热蒸干 有 产生 证明有 NaCl 生成 例 4 [2019· 遵义 ] 在研究 “ 酸碱中和反应 ” 时,某兴趣小组同学想证明稀盐酸与氢氧化钠溶液混合后是否发生了化学反应,进行了如下探究: (3) 探究实验后烧杯中溶质的成分 . 没有明显现象 白色固体 得出结论 氢氧化钠溶液和盐酸发生了中和反应 . 评价反思 Ⅰ. 有同学认为,仅通过实验 2 得出 “ 溶液中含有 HCl” 证据不足,理由是 . Ⅱ. 运用中和反应,可以解决生产生活中的实际问题 . 如工厂用氨水 (NH 3 ·H 2 O) 处理废水中的硫酸,能得到一种氮肥 —— 硫酸铵,写出该反应的化学方程式: . Ⅲ. 多角度认识化学反应是学习化学的重要方法 . 生成的氯化钠也能和硝酸银反应生成白色沉淀氯化银 2NH 3 · H 2 O+H 2 SO 4 (NH 4 ) 2 SO 4 +2H 2 O 1. [2019· 杭州 ] 在①氧化铁、②金属锌、③氢氧化铜、④氯化钡溶液四种物质中,跟稀硫酸、稀盐酸都能发生反应且反应中表现了 “ 酸的通性 ” 的组合是 ( ) A. ①②③④ B. ①②③ C. ①③④ D. ②③④ B 2. [2016· 杭州 ] 小金制作了一个如图 H7-9 中甲所示的简易酸碱灭火器,并进行了如图乙所示的灭火操作 . 结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加 2 滴紫色石蕊试液,变红色;②另取少量残留液于试管中,滴加适量氯化钡溶液,有白色沉淀 . 则残留液中有大量的 ( ) A. 硫酸钠 B. 碳酸钠 C. 盐酸 D. 氯化钠 A 图 H7-9 3. [2018· 恩施州 ] 下列关于氢氧化钠的描述中错误的是 ( ) A. 可用于改良酸性土壤 B. 易溶于水,溶解时放出大量的热 C. 能去除油污,可作炉具清洁剂 D. 对皮肤有强烈的腐蚀作用 A D 图 H7-10 5. [2018· 广西 ] 利用以下装置对酸的化学性质进行探究 . 图 H7-11 (1) 实验 Ⅰ 中,在点滴板的 a 、 b 穴中滴入酸溶液后,溶液变红的是 ( 填 “a” 或 “b”). 使用点滴板的优点之一是 ___________________________________ . (2) 实验 Ⅱ 中,为了验证石灰石中含有碳酸根离子,试剂 X 的名称是 . a 节约药品 ( 或方便观察反应现象等,合理即可 ) 澄清石灰水 5. [2018· 广西 ] 利用以下装置对酸的化学性质进行探究 . 图 H7-11 (3) 实验 Ⅲ 中,在试管①②中均可观察到的现象是 、 . 试管②中发生反应的化学方程式是 . 红棕色固体逐渐消失 溶液逐渐变成黄色 Fe 2 O 3 +3H 2 SO 4 Fe 2 (SO 4 ) 3 +3H 2 O 6. [2019· 北京 ] 用图 H7-12 甲所示装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图乙所示 . 图 H7-12 (1) 先推入的溶液是 . [ 答案 ] (1)NaOH 溶液 [ 解析 ] (1) 由图乙可知,推入液体后容器中压强减小,说明二氧化碳气体被吸收,氢氧化钠溶液和二氧化碳反应生成碳酸钠和水,使二氧化碳气体的体积减小,因此,先推入的溶液是 NaOH 溶液。 6. [2019· 北京 ] 用图 H7-12 甲所示装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图乙所示 . 图 H7-12 (2) bc 段压强不变,原因是 . [ 答案 ] (2) 氢氧化钠溶液与二氧化碳充分反应,反应停止,瓶内气体量不再改变 [ 解析 ] (2) 氢氧化钠溶液与二氧化碳充分反应,反应停止,瓶内气体量不再改变,所以,图乙中 bc 段压强不变。 6. [2019· 北京 ] 用图 H7-12 甲所示装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图乙所示 . 图 H7-12 (3) cd 段压强变大,用化学方程式解释: . [ 答案 ] [ 解析 ] (3) 图乙中 cd 段压强迅速变大,原因是碳酸钠和盐酸反应生成氯化钠、二氧化碳和水,由于生成二氧化碳速度很快,所以,容器中压强迅速增大,反应的化学方程式为 Na 2 CO 3 +2HCl 2NaCl+ H 2 O+CO 2 ↑ Na 2 CO 3 +2HCl 2NaCl+H 2 O +CO 2 ↑查看更多