- 2021-11-10 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
辨别物质的元素组成教案2
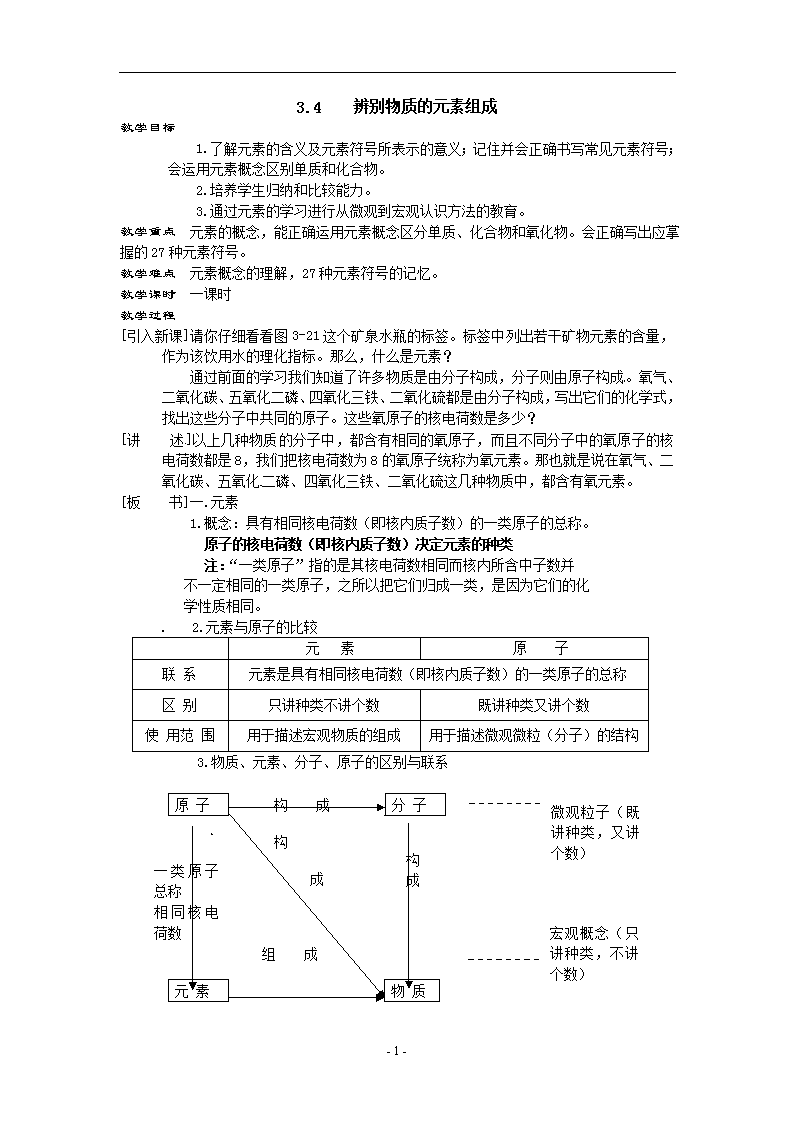
3.4 辨别物质的元素组成 教学目标 1.了解元素的含义及元素符号所表示的意义;记住并会正确书写常见元素符号;会运用元素概念区别单质和化合物。 2.培养学生归纳和比较能力。 3.通过元素的学习进行从微观到宏观认识方法的教育。 教学重点 元素的概念,能正确运用元素概念区分单质、化合物和氧化物。会正确写出应掌握的27种元素符号。 教学难点 元素概念的理解,27种元素符号的记忆。 教学课时 一课时 教学过程 [引入新课]请你仔细看看图3-21这个矿泉水瓶的标签。标签中列出若干矿物元素的含量,作为该饮用水的理化指标。那么,什么是元素? 通过前面的学习我们知道了许多物质是由分子构成,分子则由原子构成。氧气、二氧化碳、五氧化二磷、四氧化三铁、二氧化硫都是由分子构成,写出它们的化学式,找出这些分子中共同的原子。这些氧原子的核电荷数是多少? [讲 述]以上几种物质的分子中,都含有相同的氧原子,而且不同分子中的氧原子的核电荷数都是8,我们把核电荷数为8的氧原子统称为氧元素。那也就是说在氧气、二氧化碳、五氧化二磷、四氧化三铁、二氧化硫这几种物质中,都含有氧元素。 [板 书]一.元素 1.概念:具有相同核电荷数(即核内质子数)的一类原子的总称。 原子的核电荷数(即核内质子数)决定元素的种类 注:“一类原子”指的是其核电荷数相同而核内所含中子数并 不一定相同的一类原子,之所以把它们归成一类,是因为它们的化 学性质相同。 2.元素与原子的比较 元 素 原 子 联 系 元素是具有相同核电荷数(即核内质子数)的一类原子的总称 区 别 只讲种类不讲个数 既讲种类又讲个数 使 用范 围 用于描述宏观物质的组成 用于描述微观微粒(分子)的结构 3.物质、元素、分子、原子的区别与联系 构 成 原 子 微观粒子(既讲种类,又讲个数) 分 子 构 元 素 物 质 一类原子总称 相同核电荷数 构 成 成 成 宏观概念(只讲种类,不讲个数) 组 成 - 3 - [讲 述]所有的物质都是由元素组成。现在已知的物质有三千多万种,而组成它们的元素只有一百余种。 阅读课本87页地壳中各元素的质量分数。 [板 书]地壳中质量分数列前四位的元素:氧>硅>铝>铁 [阅 读]课本88页 知识视窗“生物赖以生存的元素” [讲 解]课本88页“元素的中文名称”找规律 [板 书]3.元素符号(拉丁文名称缩写) [讲 解]国际上统一采用元素的拉丁文名称第一个大写字母来表示元素,如果几种元素的第一个字母相同,可再附加一个小写字母来区别。 [板 书](1)写法:“一大二小” [阅 读]课本84页常见元素的核电荷数、名称和元素符号 [板 书](2)意义:表示一种元素(宏观),还表示这种元素的一个原子(微观) 如:S表示硫元素,一个硫原子 Fe表示铁元素,一个铁原子 [阅 读]课本90页知识视窗“元素周期表” [讨 论]比较以下两组纯净物的元素组成,它们之间有什么不同之处: 第一组:氧气(O2)、氩气(Ar)、碳(C)、铁(Fe)、汞(Hg) 第二组:二氧化碳(CO2)、氨气(NH3)、氯化铵(NH4Cl)、硫酸(H2SO4) 不同点是:组成元素的种类。第一组由一种元素组成,第二组由两种或多种元素组成。 [板 书]二.纯净物的分类 1.单质:由同种元素组成的纯净物叫做单质。 2.化合物:由不同种元素组成的纯净物叫做化合物。 单质 化合物 宏观组成 同种元素 不同种元素 微观构成 同种原子或同种分子 (由同种原子构成) 同种分子 (由不同种原子构成) 化学性质 不能发生分解反应 一定条件下能发生分解反应 如果化合物仅由两种元素组成且其中一种是氧元素,则此种 化合物称为氧化物。 [讨 论]化合物与混合物有什么异同点? 混合物 化合物 宏观组成 多种物质组成 多种元素组成的一种纯净物 微观构成 (分子观点) 含多种分子 含一种分子 性 质 无固定性质,各成分保持原有化学性质 有固定性质 组成成分 无固定组成 有固定的组成 举 例 空气、海水、糖水、碘酒 水、二氧化碳、高锰酸钾 联 系 混合物可以有多种化合物组成 [课堂练习]完成92页检查站 [小 结]课本92页归纳 - 3 - [课堂练习]P.93/1. 2. 5. [布置作业]P.93/3. 4. 熟记元素周期表中前20号元素和符号以及课本84页表格中20号元素以外的常见元素和符号 - 3 -查看更多