2007年全国初中化学竞赛佛山市初赛试题
2007年全国初中化学竞赛佛山市初赛试题
(90分钟满分100分)
可能用到的相对原子质量:
H-1 C-12 N-14 O-16 Na-23 S-32 K-39 Cl-35.5 Fe-56
一、选择题(本题包括15小题,每小题2分,共30分。第1-9题为单选题。第10-15题有1或2个选项符合题意,若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确得1分,选两个且都正确得2分,但只要选错一个,该小题为0分)
1.下列仪器中能直接放在酒精灯上加热的有 ( )
① 试管 ② 集气瓶 ③ 瓷质蒸发皿 ④ 量筒 ⑤ 烧杯 ⑥ 燃烧匙 ⑦ 石棉网
A.① ③ ⑥ ⑦ B.① ② ⑤ ⑦ C.① ④ ⑤ ⑥ D.② ③ ⑤ ⑥
2.实验室中装有浓硫酸的试剂瓶应贴有的图标是 ( )
A B C D
3.燃料电池是一种能将化学反应产生的能量直接转换成电能的装置。下列燃料电池比较
适合在宇宙飞船上使用的是 ( )
A.CO—O2燃料电池 B.C2H5OH—O2燃料电池
C.CH4一O2燃料电池 D.H2—O2燃料电池
4. 用酒精灯给试管里的液体加热时,发现试管破裂,可能有的原因有:① 用酒精灯的外焰给试管加热;② 加热前没有擦干试管外壁的水;③ 加热时试管底部触及灯芯;④ 被加热的液体超过试管容积的1/3;⑤ 加热时没有上下移动试管;⑥ 没有进行预热。其中与之有关的是 ( )
A.① ③ ⑤ ⑥ B.② ④ C.② ③ ⑥ D.③ ④ ⑤
5.在配制10%NaCl溶液的过程中,导致溶液中NaCl质量分数小于10%的可能的原因是:①用量筒量取水时仰视读数 ②配制溶液时烧杯用少量蒸馏水润洗 ③在托盘天平的左盘称量氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数④盛装溶液的试剂瓶用蒸馏水润洗 ⑤氯化钠晶体不纯 ( )
A.①②③④⑤ B.②③④⑤ C.①②③ D.①②④⑤
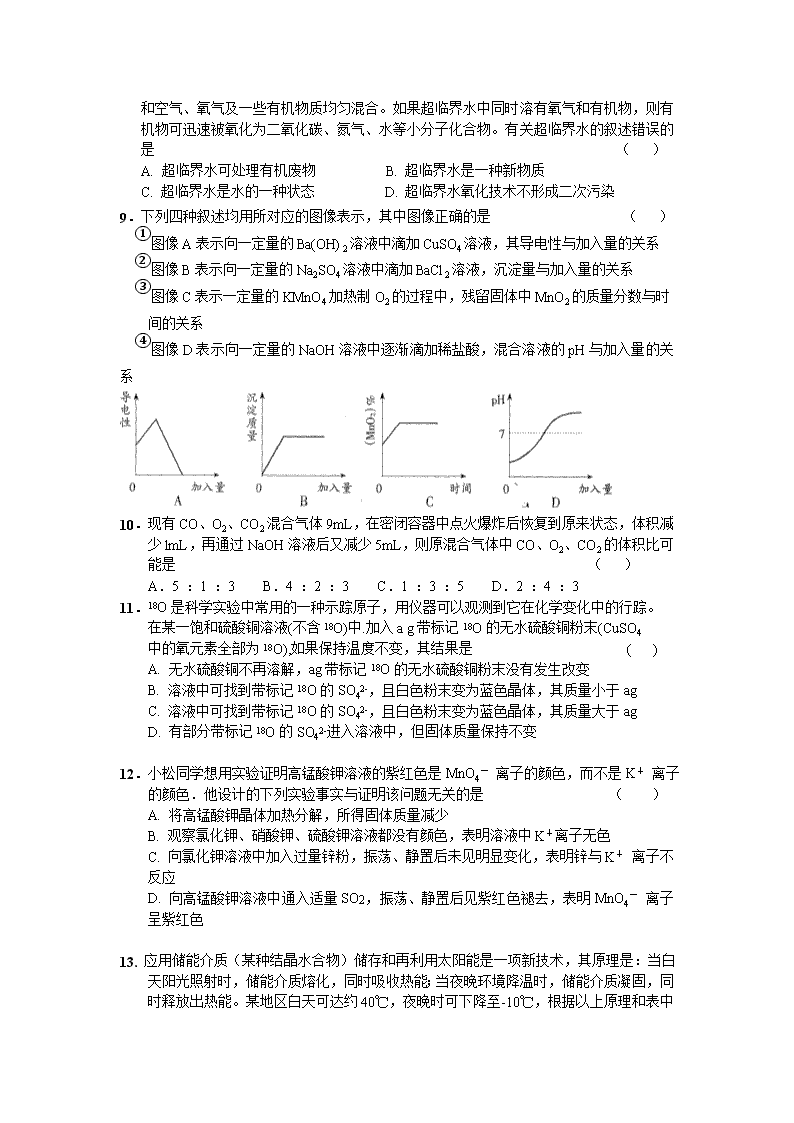
6.实验室可用右图装置制氧气,可用推拉注射器的方法检验装置的气密性,
当缓慢拉活塞时,如果装置气密性良好,可观察到( )
A.注射器内进入液体 B.瓶内液面上升
C.长颈漏斗内的液面上升 D.长颈漏斗下端管口产生气泡
7.有机高分子合成材料的出现是材料发展史上的重大突破,下列属于有机高分子合成材料
的一组是 ( )
①家用保鲜袋 ②不锈钢 ③淀粉 ④尼龙布 ⑤汽车轮胎
A.①④⑤ B.②③④ C.②③⑤ D.①⑤
8. 当水的温度和压强升高到临界点(t=374.3℃,p=22.05MPa)以上时,水就处于超临界状态,该状态的水即称之为超临界水。
超临界水具有通常状态下水所没有的特殊性质,它可以和空气、氧气及一些有机物质均匀混合。如果超临界水中同时溶有氧气和有机物,则有机物可迅速被氧化为二氧化碳、氮气、水等小分子化合物。有关超临界水的叙述错误的是 ( )
A. 超临界水可处理有机废物 B. 超临界水是一种新物质
C. 超临界水是水的一种状态 D. 超临界水氧化技术不形成二次污染
9.下列四种叙述均用所对应的图像表示,其中图像正确的是 ( )
①图像A表示向一定量的Ba(OH)2溶液中滴加CuSO4溶液,其导电性与加入量的关系
②图像B表示向一定量的Na2SO4溶液中滴加BaCl2溶液,沉淀量与加入量的关系
③图像C表示一定量的KMnO4加热制O2的过程中,残留固体中MnO2的质量分数与时
间的关系
④图像D表示向一定量的NaOH溶液中逐渐滴加稀盐酸,混合溶液的pH与加入量的关系
10.现有CO、O2、CO2混合气体9mL,在密闭容器中点火爆炸后恢复到原来状态,体积减少lmL,再通过NaOH溶液后又减少5mL,则原混合气体中CO、O2、CO2的体积比可能是 ( )
A.5 :1 :3 B.4 :2 :3 C.1 :3 :5 D.2 :4 :3
11.18O是科学实验中常用的一种示踪原子,用仪器可以观测到它在化学变化中的行踪。
在某一饱和硫酸铜溶液(不含18O)中.加入a g带标记18O的无水硫酸铜粉末(CuSO4
中的氧元素全部为18O),如果保持温度不变,其结果是 ( )
A. 无水硫酸铜不再溶解,ag带标记18O的无水硫酸铜粉末没有发生改变
B. 溶液中可找到带标记18O的SO42-,且白色粉末变为蓝色晶体,其质量小于ag
C. 溶液中可找到带标记18O的SO42-,且白色粉末变为蓝色晶体,其质量大于ag
D. 有部分带标记18O的SO42-进入溶液中,但固体质量保持不变
12.小松同学想用实验证明高锰酸钾溶液的紫红色是MnO4― 离子的颜色,而不是K+ 离子的颜色.他设计的下列实验事实与证明该问题无关的是 ( )
A. 将高锰酸钾晶体加热分解,所得固体质量减少
B. 观察氯化钾、硝酸钾、硫酸钾溶液都没有颜色,表明溶液中K+离子无色
C. 向氯化钾溶液中加入过量锌粉,振荡、静置后未见明显变化,表明锌与K+ 离子不反应
D. 向高锰酸钾溶液中通入适量SO2,振荡、静置后见紫红色褪去,表明MnO4― 离子呈紫红色
13. 应用储能介质(某种结晶水合物)储存和再利用太阳能是一项新技术,其原理是:当白天阳光照射时,储能介质熔化,同时吸收热能;当夜晚环境降温时,储能介质凝固,同时释放出热能。某地区白天可达约40℃,夜晚时可下降至-10℃
,根据以上原理和表中数据,该地区应用上述技术调节室温时,所选用的储能介质最好是表中的 ( )
选项
结晶水合物
熔点/℃
熔化时吸热/(KJ•g-1)
A
CaCl2•6H2O
29.0
0.172
B
Na2SO4•10H2O
32.4
0.239
C
Na2HPO4•12H2O
36.1
0.282
D
Na2S2O3•5H2O
48.5
0.200
14.用质量均为2 g的薄锌片,在不同温度下分别与足量某浓度的稀硫酸反应。锌片完全溶解所用时间与温度的关系如下表所示。
序号
温度/℃
单位时间消耗锌的质量
锌片完全溶解的时间/s
l
5
ml
400
2
15
m2
200
3
25
m3
100
4
30
m4
t4
5
35
m5
50
6
10
m6
t6
7
20
m7
t7
试根据表中数据推测下列各表达式正确的是 ( )
①50
200>t7 ③单位时间内消耗锌的质量(m):m7>m6>m2
A.① B.② C.①② D.①②③
15.以下验证“盐酸中哪种粒子使紫色石蕊试液变红色”的实验设计不合理的是( )
水不变红色不变红色变红色
+石蕊试液
+NaCl溶液
+稀HCl
稀HCl变红色 红色褪去
{
①稀HCl变红色;稀H2SO4变红色
+石蕊试液
+石蕊试液
②NaCl溶液不变红色;Na2SO4溶液不变红色
+石蕊试液
+石蕊试液
{
①稀HCl变红色;稀H2SO4变红色
+石蕊试液
+石蕊试液
②H2O不变红色;NaNO3溶液不变红色
+石蕊试液
+石蕊试液
+适量NaOH溶液
+石蕊试液
A.
B.
C.
D.
二、填空题与简答(共20分)
16.(4分)近年来,许多城市在公交车和出租车上推行以天然气代替汽油作燃料,不少公交车和出租车上印有“CNG”的标志,代表它们是以压缩天然气为燃料的汽车。这一改革的目的是_______________________________,天然气的主要成分是_________,该主要成分燃烧的化学方程式是________________________________________。天然气的主要成分若在煤矿的矿井里达到一定的浓度,遇到明火就会发生爆炸,称为瓦斯爆炸,为了防止瓦斯爆炸,煤矿矿井内必须采取的安全措施是_______________。
17. (3分)经过学习我们可以初步认识到:化学反应的快慢、现象、生成物等与反应物量的多少、反应条件有着密切的关系。请各举一例说明:
(1)使用催化剂,能改变化学反应的速率: 。
(2)反应物的量不同,生成物可能不同: 。
(3)反应物的量不同,反应现象可能不同: 。
18.(4分)我国自主研发设计的海水法脱硫工艺,已成功应用于大、中型火电机组。其工艺大致流程是:从高而下的海水洗脱从下而上燃煤烟气中的SO2,然后与氧气充分接触,再采取跟大量天然海水(pH=8.1~8.3)混合等措施,使各项指标接近天然海水后再排放。
某海滨发电厂(6× 600MW)的海水脱硫法与其它脱疏法对比项目如下表所示:
对比项目
海水法
氧化镁法
石灰石法
脱硫效率
>90%
80%
>90%
矿石消耗量
无
3万吨/年
(氧化镁)
17.5万吨/年
(石灰石)
淡水消耗量
无
150万吨/年
数百万吨/年
脱硫电价成本
¥0.6分/度电
¥1.3分/度电
>¥1.5分/度电
(1)根据上述内容,归纳海水法脱硫的优势和局限。
优势是 、 ;
局限是 。
(2)已知洗过烟气后的海水与氧气反应的产物是硫酸钠和盐酸,试写出该反应的化学方程式 。
19.(4分)下表是几种行星上“大气”(相当于地球上的空气)的主要成分:
行星名称
金星
火星
冥王星
行星上“大气”主要成分
二氧化碳 硫酸
二氧化碳
甲烷
⑴它们中可以成为宇宙飞船燃料补给站的行星是 。
⑵科学家发现宇宙飞船飞过冥王星“大气”时,甲烷并没有被点燃,原因是
。
⑶“勇气”号太空车近日测得温度很高的火星表层土壤中可溶性盐的含量很高。科学家认为这是火星“地下”有水的证据。请结合溶液的知识说明为什么上述发现可作为火星有水的证据: 。科学家在火星上寻找水的意义是: 。
20.(5分)将一种盐溶于水时,会使水的冰点
(凝固点)降低,冰点降低多少与盐在溶液
中的质量分数有关。如果将此盐溶液降
温,则在零度以下某温度会析出冰。但当
盐在溶液中的质量分数比较大时,在将溶
液冷却的过程中先析出的固体不是冰而
是盐的晶体。如右图所示,横坐标为氯化
钙溶液中溶质的质量分数,纵坐标为温
度。试填空或简答。
(1)氯化钙溶液可用作冷冻剂,当无水氯
化钙与水混合的质量比为 : 时
(填写最简整数比),冷却效果最好。
(2)指出两条曲线分别表示的具体含义。
曲线AB: ;
曲线BC: 。
(3)将10℃时38%的氯化钙溶液降温到-40℃时,下列有关说法正确的是 (填序号)。此小题为不定项选择填空,多选、错选不给分)
A.此时溶液处于不饱和状态 B.溶液中析出了氯化钙晶体 C.溶液中已经有冰析出
D.此时冰、氯化钙晶体和氯化钙饱和溶液共存E.此时氯化钙晶体和氯化钙饱和溶液共存
三、实验与推断题(共40分)
21.(5分) 为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计出了下列4种实验装置,请回答下列问题:
(1)选择任意一种实验装置,简述出现的实验现象,解释产生该实验现象的原因:
选择的实验装置是 。实验现象为 。
产生该实验现象的原因是 。
(2)某同学质疑上述实验设计,该同学质疑的依据是:
。
(3)在原实验的基础上,请你设计实验证明CO2和NaOH肯定发生了化学反应。
。
22.(5分)小明同学在使用 “除垢净”去除热水瓶中的水垢时,发现有大量的气泡产生。联想水垢的主要成分是碳酸钙,小明猜想“除垢净”的成分中可能有酸。
①为证实自己的猜想,小明从家中又找来两类不同的物质进行实验:
实验一: ;
实验二: 。
经实验,小明得出“除垢净”的有效成分中一定有酸的结论。
②小明想试制一瓶“除垢净”,你认为HCl、H2SO4两种酸中的 更合适,理由是 。
③结合上面对“除垢净”的了解,在使用“除垢净”时应注意
。
23.(4分) 人体所需的元素从食物中摄取不足时,可通过食品添加剂和保健药剂以补充。如制成补钙、补锌的保健药剂或制成加碘食盐等,来增加对这些元素的摄入量。
(1)从上面提到的补钙剂、补锌剂和加碘食盐中的钙、锌、碘是指 (填选项字母)。
A. 单质 B.原子 C.离子 D.元素
(2)碳酸钙是一种价廉高钙补钙剂,虽然碳酸钙难溶于水,但服用后可转化为可溶性钙盐被人体吸收,其中的道理是(用化学方程式表示) 。
因此,碳酸钙在医疗上还可以用来治疗 症。
(3)为了提高补钙效果,服用这种补钙剂时常需配合服用维生素D,据此可推知维生素D的功能是 。
24.(8分)有一包固体A,可能含有Cu(OH)2、CuO、Cu、NaOH、Na2CO3、CaCl2中的几种,取少量的A做如下实验,现象如图所示。
根据实验过程中的现象判断:
(1)气体D是 (填化学式,下同),沉淀G是 。
(2)混合物A中的可能组成有 、 、 。
(3)溶液F中,一定存在溶质是 。
(4)写出过程③中可能发生的化学反应中的一个化学方程式 。
(5)滤液B中,可能存在的溶质是 。
浓硫酸
25.(12分)甲酸(HCOOH)通常是一种无色易挥发的液体,它在浓硫酸作用下易分解,反应方程式为: HCOOH=CO↑+H2O ,某课外活动小组的同学欲用该反应来制取CO,并还原红棕色的氧化铁粉末。现有下列仪器或装置供选择:
(1)用甲酸滴入浓硫酸的方法制取CO,应选 (填序号)装置;如果要除去CO中混有少量甲酸气体,最好选择上图中 (填序号)进行洗气。
(2)用上述方法制取的CO还原氧化铁,并检验气体产物,则各仪器的接口连接顺序为
(填字母)。
(3)在对氧化铁粉末加热前,为安全起见,应进行的一项重要操作是 。
(4)从开始加热到实验结束,氧化铁粉末的颜色变化为 ,
反应方程式为 。
(5)上述实验的尾气不能直接排放到空气中,请你说出一种处理尾气的方法:
(6)在该制取CO的反应中,浓硫酸所起的是 作用。
26.(6分)用氯气或液氯消毒饮用水时,会和水中的有机物发生反应,生成对人体有毒的有机物。因此,世界环保联盟将全面禁止用氯气对饮用水消毒,建议推广采用安全、高效杀菌消毒剂ClO2。ClO2 是一种黄绿色、有刺激性气味的气体,熔点:-59.0℃,沸点:11.0℃,冷却至11.0℃以下时变成红色液体,易溶于水,见光易分解。ClO2易与碱反应,其杀菌、漂白能力均优于Cl2,消毒水体时不生成有害物质,也不存在用氯气消毒时残留的臭味。
(1)制取ClO2的方法有多种,目前欧洲一些国家用NaClO3氧化浓盐酸制取ClO2(Kestiog法)同时有Cl2生成,该反应的化学方程式为 。
(2)我国最近研究成功用Cl2氧化NaClO2(N2保护下)制取ClO2,该反应的化学方程式是_____________________;此法与Kestiog法相比,其优点是_________________。
(3)工业上也可以在60℃时,用稍加潮湿的KClO3与草酸(HOOCCOOH)反应制取ClO2。某实验小组用右上图所示装置制取并收集ClO2,在装置图中A为ClO2的发生装置,B为ClO2的收集装置,C为尾气吸收装置。请问:
①为了保证实验成功,在A装置外面需加 、B装置外面需加 ;②C中所盛放的药品是 。
四、计算题(共10分)
二甘醇(C4H10O3)是无色、无味的粘稠液体,易溶于水,易燃,无腐蚀性,低毒。
27.(3分)2006年4~5月间,我省多名患者因注射某制药公司生产的假药“亮菌甲素注射液”而死亡。造成该事件的原因是该制药公司在购买药用辅料丙二醇(C3H8O2)时,购入了二甘醇假冒丙二醇以至酿成悲剧。完成以下填空。
(1)丙二醇的相对分子质量是____________。
(2)二甘醇中C、H、O元素的质量比为 。
(3)4n个二甘醇与5n个丙二醇所含氢元素的质量 (填“相同”或“不相同”)。
28. (7分) 为了测定混有少量氯化钠的碳酸氢钠(NaHCO3)固体的质量分数,某同学利用该固体混合物与稀盐酸反应,进行了三次实验,所得相关的实验数据记录如下表:
第一次
第二次
第三次
所取固体混合物的质量 /g
10
10
15
所用稀盐酸的质量 /g
60
70
50
生成CO2的质量 /g
3.3
3.3
3.3
(1)混合物中NaHCO3的质量分数是 。
(2)稀盐酸溶质的质量分数是 。
(3)从上表分析,当所取固体混合物与所用稀盐酸的质量比为 时,表明该固体混合物中的NaHCO3 与稀盐酸恰好完全反应。
(4)取10g该固体混合物与稀盐酸恰好完全反应,求所得溶液中溶质的质量分数(计算结果精确到0.001,并用%表示)。
2007年全国初中化学竞赛佛山市初赛试题
参 考 答 案
一、选择题(共30分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
答案
A
A
D
C
A
D
A
B
B
A D
C
A C
C
C
D
二、填空题与简答(共20分)
16. (4分)减少大气污染,改善城市空气质量(1分);CH4(1分);CH4 + 2O2 CO2 + 2H2O(1分); 通风、严禁烟火(1分)
17. (3分) (1)使用MnO2作催化剂,可加快KClO3分解反应的速率。(1分)
(2)木炭在充足的空气里燃烧,生成物为二氧化碳;而当空气量不足时,燃烧后的生成物为一氧化碳。(1分)
(3)硫在空气中燃烧只能发出微弱的淡蓝色火焰,而在纯氧中燃烧能发出蓝紫色火焰。(1分)
18.(4分) (1) 成本低 节约资源 受地域限制
(2) 4NaCl+O2+2SO2+2H2O=2Na2SO4+4HCl (化学方程式每个1分)
19.(4分)(1) 冥王星(2) 冥王星上没有氧气(3)CO2与水反应生成碳酸,能溶解可溶性盐,火星曾经有生物存在
20.(5分) (1)3 :7 (2)水的冰点曲线 氯化钙饱和溶液的质量分数随温度变化的曲线 (3) B E
三、实验与推断题(共40分)
21.(5分)(1)~(4)只需答一组。(装置、实验现象、原因各1分)
装置(1)
装置(2)
装置(3)
装置(4)
实验现象
试管内液面上升烧杯内液面下降
软塑料瓶变瘪
气球胀大
烧杯内的水流入锥形瓶中
产生实验现象的原因
二氧化碳与氢氧化钠溶液反应,使试管内气体压强减少,液体被压入试管中
二氧化碳与氢氧化钠溶液反应,使塑料瓶内压强减少,大气压将软塑料瓶压瘪了
二氧化碳与氢氧化钠溶液反应,使锥形瓶内气体减少,大气压使气球胀大
二氧化碳与氢氧化钠溶液反应,使锥形瓶气体压强减小,大气压将液体压入锥形瓶
(2)二氧化碳溶解于水,使气体的量减少,也可以出现类似的现象。(1分)
(3)往二氧化碳与氢氧化钠溶液作用后的液体中加入过量的稀盐酸,如果有无色无味的气体产生,说明二氧化碳与氢氧化钠溶液已经发生了化学反应。(1分)
22.(5分)①实验一:将废锌皮(或铁钉等)放入除垢净中,有气体出现且该气体能够燃烧
实验二:将生锈铁钉放入到除垢净中,铁锈消失且溶液颜色逐步变为黄色
实验三:用植物色素(如花瓣汁液等)加入到除垢净中,植物色素出现颜色的变化
说 明:本题选取物质的种类不同,答案有所不同,其他合理答案均可按标准给分。
②盐酸
硫酸与水垢反应生成微溶的硫酸钙,除垢不彻底(或盐酸是胃液的成分之一,使用盐酸配制“除垢净”更安全)
说 明:本小题第二空中其他合理答案也可得分。
③去除铝壶中的水垢时,应控制水“除垢净”的浓度,(或不要滴到手上或衣服上、防止腐蚀、除垢后要将“除垢净”冲洗干净等)
23.(4分) (1)D (2)CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 胃酸过多 (3)帮助钙的吸收
24.(1)CO2 Cu(2)Na2CO3 CuO Cu ,Na2CO3 Cu(OH)2 Cu ,Na2CO3 Cu(OH)2 CuO Cu(其它答案正确也可以)(3)CuSO4(4)CuO +H2SO4= CuSO4+H2O(5)NaOH
25.(12分)
(1) ②(1分) ③(1分)
(2)B接 D、C接 G(或H)、H(或G)接F(3分,接口对一处给1分)
△
(3)检验气体的纯度(或验纯,1分)
(4)由红棕色变为黑色(1分) Fe2O3+3CO=2Fe+3CO2 (2分)
(5)将尾气点燃(或用气球、塑料袋收集尾气,2分)
(6)脱水(1分)
26. (6分)(1)2NaClO3+4HCl = 2ClO2↑+ Cl2 ↑+ 2H2O + 2NaCl (1分)
(2)2NaClO2+ Cl2 = 2ClO2↑ +2NaCl (1分)无有害气体生成,产品易分离(1分)
(3)60℃水、冰水(2分)② NaOH(1分)
四、计算题(共10分)
27.(共3分 )(1)76 (1分) (2)24 :5 :24 (1分) (3)相同(1分)
28.(共7分)
(1)63%(1分)
(2)5.48%(5.475%)(1分)
(3)1:5 (1分)
(4)解:因为10g固体混合物与50g盐酸恰好完全反应,产生3.3g CO2
设10g固体混合物所含的NaHCO3质量为X ,生成NaCl的质量为Y (0.5分)
NaHCO3 + HCl === NaCl + H2O + CO2↑(0.5分)
84 58.5 44
X Y 3.3 84 :X = 44 :3.3
58.5 :X = 44 :3.3
解得: X = 6.3g (0.5分) Y = 4.3875g (0.5分)
10g固体混合物所含的m(NaCl) = 10g – 6.3g = 3.7g(0.5分)
所以反应后所得溶液中NaCl的总质量 = 3.7g + 4.3875g = 8.0875(0.5分)g
所得溶液的质量 = 10g + 50g – 3.3g = 56.7g(0.5分)
所得溶液的溶质的质量分数为(8.0875/56.7)×100%=14.26%(0.5分)
答:略。