- 2021-11-10 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
物质构成的奥秘 小结
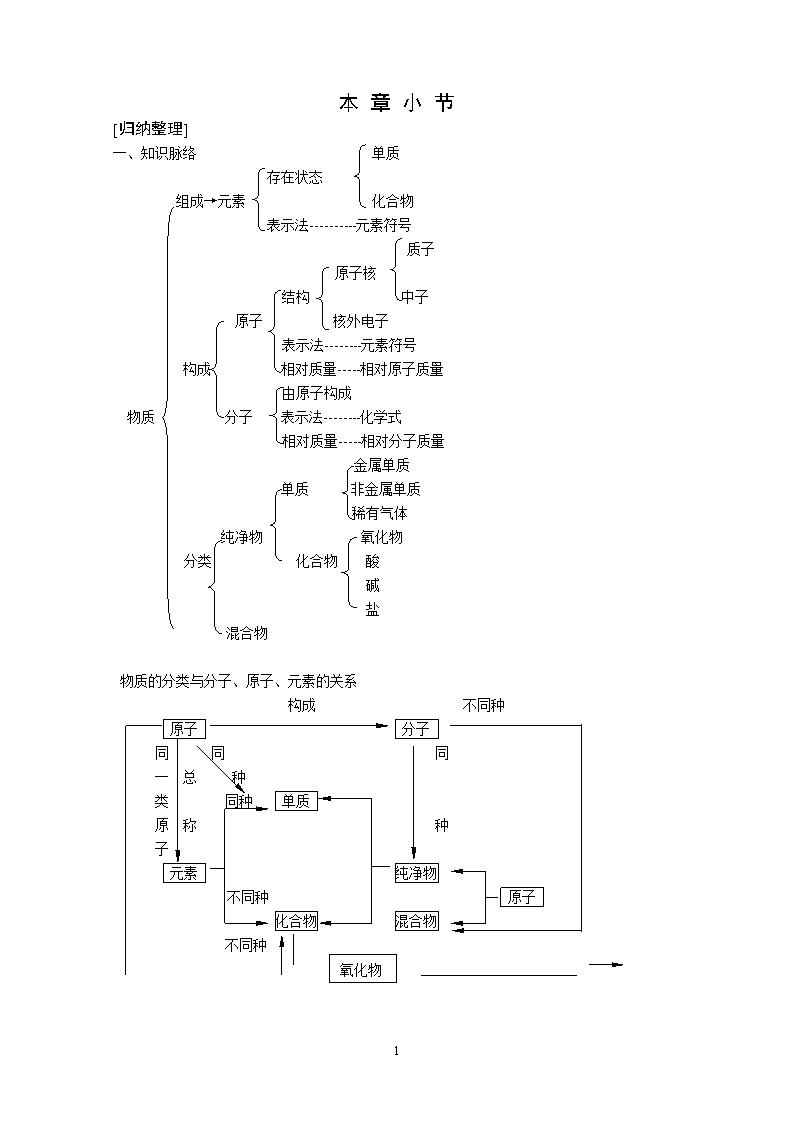
本 章 小 节 [归纳整理] 一、知识脉络 单质 存在状态 组成→元素 化合物 表示法----------元素符号 质子 原子核 结构 中子 原子 核外电子 表示法--------元素符号 构成 相对质量-----相对原子质量 由原子构成 物质 分子 表示法--------化学式 相对质量-----相对分子质量 金属单质 单质 非金属单质 稀有气体 纯净物 氧化物 分类 化合物 酸 碱 盐 混合物 物质的分类与分子、原子、元素的关系 构成 不同种 原子 分子 同 同 同 一 总 种 类 同种 单质 原 称 种 子 元素 纯净物 不同种 原子 化合物 混合物 氧化物 不同种 8 元素分类、性质跟原子结构的关系。 原 子 结 构 示 意 图 电子层数 氢(H) +1 1 氦(He) +2 2 1 2 锂(Li) +3 3 铍(Be) +4 2 2 硼(B) +5 2 3 碳(C) +6 2 4 氮(N) +7 2 5 氧(O) +8 2 6 氟(F) +9 2 7 氖(Ne) +10 2 8 3 钠(Na) +11281 镁(Mg) +12 2 8 2 铝(Al) +13 2 8 3 硅(Si) +14 2 8 4 磷(P) +15 2 8 5 硫(S) +16 2 8 6 氯(Cl) +17 2 8 7 氩(Ar) +18 2 8 8 最外层电子数 1 2 3 4 5 6 7 8 元素分类 ---金属元素-------------------- ----------非金属元素----------- 稀有气体元素 结构特征 --最外层电子数一般小于4-- --最外层电子数一般多于或是等于4 8电子稳定结构(He除外) 元素性质 -------------易失电子---------- ---------------易得电子------------ 稳定 形成的微粒 阳离子 阴离子 / 小结 金、少、失 非、多、得 稳定 [问题讨论] 例1.用分子的观点解释酒精挥发和酒精燃烧本质区别。 分析:物理变化和化学变化的根本区别在于变化前后是否生成了其它物质。用分子的观点来区别,就是看变化前后构成物质的分子本身是否起了变化。 答:酒精挥发,只是由于酒精分子运动使分子间的间隙增大了,酒精由液态变成气态,而酒精分子本身并没有改变,所以是物理变化。而酒精燃烧,在燃烧过程中,酒精分子被破坏,分子中的原子和氧分子中的原子重新排列组成了其它物质,生成了二氧化碳分子和水分子,其结果是酒精分子发生了变化,所以酒精燃烧是化学变化。 例2.指出下列符号各表示什么意义:(1)H (2)2H (3)H2O (4)2H2O 分析:按照元素符号和化学式表示的意义以及系数的含义来回答。 答:(1)H:表示氢元素;表示1个氢原子 (2)2H:表示2个氢原子 (3) H2O:表示水;表示水由氢元素、氧元素组成;表示1个水分子;表示1个水分子是由2个氢原子和1个氧原子构成 (4)2H2O:表示2个水分子 例3.将分子、原子、离子、质子、中子、电子等微粒名称填入下列适当空格中: 8 (1)构成物质的基本微粒是_________________________。 (2)构成原子的基本微粒是_________________________。 (3)显示电中性的微粒有_________________________。 (4)质量最小的微粒是_________________________。 (5)参加化学反应一定发生变化的微粒是_________________________。 (6)原子中数目一定相等的微粒是_________________________。 分析:利用上述微粒的结构、性质等来回答。 答案:(1)分子、原子、离子; (2)质子、中子、电子; (3)中子、分子、原子; (4)电子; (5)分子; (6)质子和电子。 例4.现有二氧化碳、硫粉、空气、氧气、氧化汞、氯酸钾、海水、铁等8种物质,其中(属纯净物的均写化学式): (1)属于混合物的是_____________ (2)属于单质的是_____________ (3)属于化合物的是_____________ (4)属于氧化物的是_____________ (5)含有氧分子的物质是_______________________________ (6)由原子构成的单质是_______________________________ 分析:利用物质的分类知识及化学式的书写规则完成。 答案:(1)空气、海水;(2)S、O2、Fe;(3)CO2、HgO、KClO3;(4)CO2、HgO; (5)空气、O2、海水;(6)S、Fe 例5.黑火药是中国古代的伟大发明,它是由木炭、硫粉、硝酸钾配成,回答下列问题: (1)黑火药是纯净物还是混合物? (2)黑火药中哪些是单质?哪些是化合物? (3)黑火药中共含哪几种元素?硝酸钾中各元素的质量比及氧元素的质量分数各是多少解:(1)属于混合物;(2)单质为木炭、硫,化合物为硝酸钾; (3)黑火药中共含有碳、硫、钾、氮、氧五种元素。 KNO3中钾氮氧三种元素的质量比=39:14:16×3 =39:14:48 KNO3中氧元素的质量分数= = = =47.5% [单元练习] 可能用到的相对原子质量:Se:79 C:12 N:14 O:16 H:1 I:127 K:39 一、选择题(每小题只有1个选项符合题意) 1.氧化汞受热时的变化可用图表示(图中大圆圈表示汞原子,小圆圈表示氧原子)。据图得出的下列结论错误的是 ( ) 8 A.氧化汞受热时能分解成汞和氧气 B.原子是化学变化中的最小微粒 C.分子在化学变化中可以再分 D.所有的物质都是由分子构成 2.下列现象中不能用分子运动论解释的是 ( ) A.把两块表面平滑干净的铅压紧,就不容易将它们拉开 B.在室内,同样表面积的热水比冷水蒸发得快 C.氧化汞受热分解生成汞和氧气 D.医院里充满了酒精味和药味 3.干燥多风季节夜晚,在荒野里,人们有时可看到“鬼火”现象,其实它是一种类似与氨气组成的气体(PH3)在空气中的自燃现象,则PH3中P的化合价是 ( ) A.+3价 B.-3价 C.+1价 D.+5价 4.曾用作麻醉剂的“笑气”是一种氮氧化物,其中氮元素的化合价为+1价,“笑气”的化学式是 ( ) A.N2O5 B.NO2 C.NO D.N2O 5.下列说法中,若以质量分数比较,错误的是 ( ) A.空气中含量最多的元素是氮 B.地核里含量最多的元素是氧 C.矿泉水中含量最多的元素是钙 D.海水中含量最多的元素是氧 二、填空题 6.按要求用正确的化学符号表示: (1)2个氮原子_________; (2)铵根离子___________; (3)地核中含量最多的金属元素_______; (4)1个硫酸分子____________; (5)硝酸汞中正二价的汞元素________; (6)3个亚铁离子____________; (7)构成氯化钠晶体的阴离子_______; (8)由硫离子与亚铁离子构成的物质______。 7.焚烧生活垃圾会产生二恶英,其中毒性较大的一种物质化学式是C12H4O2Cl4,该物质中氢、碳元素的原子个数比为____________,氯、氧元素的质量比为__________。 8.硒元素具有抗衰老、抑制癌细胞生长的功能,已知硒的元素符号为Se,其含氧酸的化学式为H2SeO4,则硒元素的化合价为________,该酸一个分子中所含原子的总数为____个,组成该酸的H、Se、O元素质量比为_____________。 9.已知毒品海洛因的化学式为C21H23NO5,它由____种元素组成,相对分子质量为____,其中氮的质量分数为______,它应属于______物。 10.如图所示的装置久放之后,烧杯甲中的溶液变 ______色,烧杯局中溶液的溶质的质量分数将______ (填大或小) 三、简答题 11.邪教头目李洪志宣称,练他的法轮功后能将铜分子、铝分子变成黄金。请你根据科学知识反驳其荒唐性。 12. 8 古罗马人的平均寿命很短,只有廿余年。你认为这可能主要跟以下哪些因素有关?为什么? (1)古罗马上空的空气污染严重。 (2)古罗马人营养很差。 (3)古罗马城市中用铅作水管,用铅制器皿饮水。 13.下表列出了四种金属元素的原子结构及单质的性质等具体情况: 元素名称 元素符号 原子结构示意图 密度(g/mL) 熔点(℃) 沸点(℃) 冷水反应 锂 Li +3 2 1 0.534 180.5 1347 剧烈 钠 Na +11 2 8 1 0.97 97.81 832.9 剧烈 钾 K +19 2 8 8 1 0.86 63.65 774 剧烈 轻微爆炸 铷 Rb +37 2 8 18 8 1 1.532 38.89 688 剧烈 发生爆炸 按以上表列资料分析,你发现了哪些规律性: (1)______________________________________________________________________ (2) ______________________________________________________________________ (3) ______________________________________________________________________ 四、计算题 14.在食盐中加入适量的碘酸钾(KIO3),可以有效地防治碘缺乏病。KIO3的相对分子质量为______,KIO3中各元素的质量比为________,其中碘元素的质量分数为________(保留三位有效数字),我国规定每Kg食盐中含碘0.035g,相当于每Kg食盐含碘酸钾______g。 15.近年来,乳酸成为人们研究的热点之一,乳酸在医药、食品等工业中应用前景广阔,乳酸的化学式为C3H6O3,试计算: (1)乳酸中碳、氢、氧元素的质量比 (2)乳酸中碳元素的质量分数 16.(1)通过计算比较硝酸铵(NH4NO3)与尿素[(NH2)2CO]哪个含氮量高?(2)为满足生产需要,要使每公顷地增加2kg的氮元素,问在50hm2地上适宜施何种氮肥?施多少kg? 8 参考答案提示 第一节 练习测试 1.C 2.C 3.这3类5种洗涤用品混合后发生了化学反应,生成氯气,而氯气由于运动于空气被人吸入而中毒。在使用洗涤用品时,不能随意混合使用。 4.主要从物质的微粒之间有间隔考虑。 5.答案很多,只要符合题意均可。 6.(1)打开香水瓶盖,由于香水中微粒不断运动,分散到空气里被人呼入。 (2)由于碳墨水的微粒不断运动,分散到水分子的间隔里,故逐渐溶解而变黑。 (3)味精中微粒由于不断运动而扩散到菜汤微粒的间隙里,故可感觉到味精的鲜味。 (4)因为太阳晒着的地方温度高,微粒运动的动能增大,故水中的微粒易运动而扩散到空气中。 (5)防止因酒精、汽油里的微粒由于不断运动而散失。 (6)瓶里还应存在空气,瓶壁附有水。 第二节 练习测试 1.C 2.D 3.D 4.61 5.分子 分子 原子 原子 原子 原子 分子。 原子 原子核 电子。 质子 中子 电子 原子。 6.(1)在原子里质子数等于核外电子数 (2)不同种原子的质子数不同 (3)相对原子质量通常等于质子数与中子数之和。 (4)不同种类原子数相对质量一般不相同。等等 7.答:水通电是由于水分子在直流电的作用下分解氢原子和氧原子,而每两个氢原子和两个氧分子分别构成了1个氢分子和1个氧分子,许许多多的分子聚集成氢气和氧气,分子变了发生了化学变化。而水蒸发是由于水分子不断运动而散发到空气里,水由液态变成了气态。水分子本身改变属物理变化。 8.由于二氧化碳分子不断运动,分散到水分子间的间隙里,使得气体体积减小,气压减小,故瓶子瘪了。 9.[提示]科学是反映自然、社会、思维等客观规律的分科的知识体系。 恩格斯所以认为“化学的新世纪开始于原子学说” 8 。是因为在18世纪的后半期,化学研究中普遍应用了天平之后,开始重视定量研究,从而对物质的变化和性质有了较深入、较细致的认识。19世纪的前50年代左右,化学从定性研究的方法或观点逐步向定量研究的方法和观点发展,以弄清物质的组成及化学变化中反应物之间和反应物、生成物之间量的关系为目的,由此建立了像质量守恒定律、定比定律、信比定律、化含量定律等一些基本化学定律。为了进一步揭示这些基本定律之间的内在联系和本质,道尔顿提出了近代原子学说。这一学说经过尔后的不断完善,终于成为当时说明各种化学现象的统一理论。所以说,它标志着近代化学发展的新起点。 10.油气炸弹爆炸时释放了大量可燃性气体,而大量可燃性气体引爆时消耗了大量氧气,使防空工事里缺氧,造成人的窒息死亡。 第三节 练习测试 1.B 2.B 3.B 4.C 5.核外电子,16,3,6;质子数,最外层的电子数 6.碳和氢两种,氧。 7. 定义 关系 举例 含氧化合物 含有氧元素的化合物 共同点:都含有氧元素的化合物 KClO3为含氧化合物,但不属氧化物 氧化物 由两种元素组成,其中有一种是氧元素的化合物 不同点:含氧化合物不一定是氧化物 SO2既是含氧化合物,又是氧化物 8.(1)⑥⑦⑨ (2)①②③④⑤⑧⑩ (3)③⑤⑧ (4)③⑧ (5)⑩ (6)①②④ 9.(1)不正确。如Mg2+、Cl-等离子最外层电子数也为8个。 (2)正确 (3)不正确。2H表示2个氢原子,2H+表示2个氢离子,H2表示氢气或氢分子,所以化学性质不同。 10.(1)A为镁原子Mg B为氖原子Ne C为氟原子F (2)氖原子性质稳定,因最外层8个电子,镁原子易失电子,因为最外层只有2个电子,氟原子因为最外层有7个电子与8电子结构只差1个,所以易得电子。 11.(1)炼铜原料中一定含有铅、铜、锌等元素。 (2)不能,因为外地受污染的蔬菜也会进入本地。 (3)应按照谁污染谁治理的原则进行治理整顿,做到达标排放,否则要实行关、停、并、转。 第四节 练习测试 1.A 2.B 3.D 4.H2; H、O; H2O; H+、OH-; H+ 5.四 11 61 6.从上到下填入代号:D、B、C、A、E 7.略。 8.重点抓住NaCl中氯原子得到1个电子成为带1个负电荷的氯离子(Cl-) 8 而显-1价,而HCl是氢、氯原子各出1个电子形成的共用电子,偏向氯而使氯原子显负电性,Cl显-1价。 9.过氧化氢与水均属由氢氧两种元素组成的氧化物,但由于分子构成不同、物质不同,故化学性质不同。 10.CO、CO2;CO、O2;CO、CO2、O2;CO、O3;CO、CO2、O3;CO、O2、O3; CO、CO2、O2、O3、 11.(1)Fe2O3中铁氧朱子个数比为2:3 元素质量比为7:3(112:48) (2)Fe%=70% O%=30% (3)56g (4)40g (5)200t 12.实际含氮量为96.4%>96% 可按一级品出售。 单元练习 一、选择题 1.D 2.A 3.B 4.D 5.C 二、填空题 +2 6.(1)2N (2)NH (3)Al (4)H2SO4 (5)Hg(NO3)2 (6)3Fe2+ 7. 1:3 142:32(或71:16) 8. +6 7 2:79:64 9. 四 369 3.8% 化合物或含氧化合物或有机物 10. 红 变小 三、简答题 11.答:(1)铜、铝均由原子构成,不能讲由分子构成。 (2)化学变化的实质是原子重新组合,元素种不变,所以铜、铝不可能变成金。 12.主要与(3)有关,因为人体内吸入过量的铅引起的中毒。 13.(1)Li、Na、K、Rb原子最外层电子数相同 (2)随核电荷数增加,核外电子层数依次增加。 (3)熔、沸点依次减小,与冷水反应的剧烈程度依次增强。 四、计算题 14. 214 39:127:48 59.3% 0.06 15. (1)6:1:8 (2)40% 16. (1)NH4NO3:N%=35% (NH2)CO中N%=46.7% 尿毒的含氮量高 (2)宜施尿素,约214.3kg。 8查看更多