- 2021-11-06 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
杭州专版2020中考化学复习方案专题06化学解答题课件
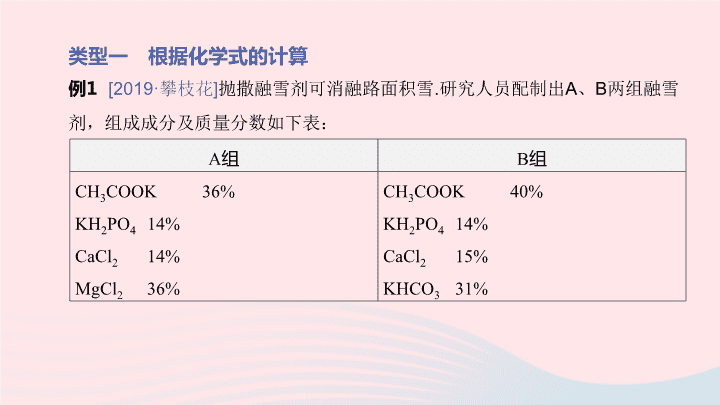
专题 6 化学解答题 化学 | 第二部分 专题突破 专题简介 【 命题重点 】 化学解答题主要涉及两方面的内容:根据化学式计算和根据化学方程式的计算 . 根据化学式的计算主要包含元素质量比、元素质量分数、分子中原子的个数比 . 根据化学方程式的计算中,往往会结合质量守恒定律、溶液中溶质质量分数和物质纯度的计算 . 【 方法要点 】 首先要注意化学式和化学方程式的正确书写以及它们所代表的含义,因为这是化学计算的前提;其次要注意审题,理清题目的已知量和未知量,明确各量的关系;最后在书写时要注意格式 . 类型一 根据化学式的计算 例 1 [2019· 攀枝花 ] 抛撒融雪剂可消融路面积雪 . 研究人员配制出 A 、 B 两组融雪剂,组成成分及质量分数如下表: A 组 B 组 CH 3 COOK 36% KH 2 PO 4 14% CaCl 2 14% MgCl 2 36% CH 3 COOK 40% KH 2 PO 4 14% CaCl 2 15% KHCO 3 31% 回答下列问题 . (1)A 、 B 两组融雪剂相比较, 组的 CH 3 COOK ( 乙酸钾 ) 含量高 . (2)KH 2 PO 4 的相对分子质量为 . (3)B 组融雪剂中,含氯的质量分数为 ( 填计算结果,结果保留至 0.1%). B 136 9.6% 【 变式 1 】 用于治疗咽炎、扁桃体炎、支气管炎等的消炎药罗红霉素片,主要成分是罗红霉素,其化学式为 C 41 H 76 N 2 O 15 . 请计算: (1) 罗红霉素中含有 种元素 . (2) 罗红霉素中氢元素与氮元素的质量比是 ( 填最简整数比 ). 4 19∶7 类型二 根据化学方程式的计算 例 2 [2019· 衢州 ] 小科为测定某石灰石样品 ( 主要成分为碳酸钙,其他成分不与稀盐酸反应 ) 中碳酸钙的含量,利用气密性良好的图 HT6-1 甲装置进行实验:①称取石灰石样品 6 g ,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入空气;②一段时间后打开分液漏斗活塞,注入足量的稀盐酸,开始计时;③待装置 D 总质量不再增加时停止鼓入空气 . 实验过程中 测得装置 D 增加的质量随时间变化图像 如图乙 ( 碱石灰能吸收二氧化碳和水 ). 图 HT6-1 图 HT6-1 (1) 根据图乙,运用化学方程式计算该石灰石样品中碳酸钙的质量分数 .( 计算结果精确到 0.1%) 例 2 [2019· 衢州 ] 小科为测定某石灰石样品 ( 主要成分为碳酸钙,其他成分不与稀盐酸反应 ) 中碳酸钙的含量,利用气密性良好的图 HT6-1 甲装置进行实验:①称取石灰石样品 6 g ,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入空气;②一段时间后打开分液漏斗活塞,注入足量的稀盐酸,开始计时;③待装置 D 总质量不再增加时停止鼓入空气 . 实验过程中测得装置 D 增加的质量随时间变化图像 如图乙 ( 碱石灰能吸收二氧化碳和水 ). 图 HT6-1 (2) 下列情况中,会导致测得的碳酸钙质量分数偏大的是 . ①去掉装置 A ,将空气直接鼓入装置 B ②去掉装置 C ,将 B 和 D 装置直接相连 ③当气泡停止产生时立即停止鼓入空气 图 HT6-1 [ 答案 ] (2)①② [ 解法指导 ] (2)① 装置 A 中的氢氧化钠溶液能吸收空气中的二氧化碳,如果去掉装置 A ,会使装置 D 吸收的二氧化碳气体的质量偏大,从而使测得的碳酸钙质量分数偏大; ② 装置 C 中的浓硫酸能吸收二氧化碳气体中的水蒸气,若去掉装置 C ,将 B 和 D 装置直接相连,会使装置 D 增加的质量偏大,从而使测得的碳酸钙质量分数偏大; ③ 当气泡停止产生时立即停止鼓入空气,二氧化碳气体没有完全被吸收,会使二氧化碳气体的质量变少,从而使测得的碳酸钙质量分数偏小 . 【 变式 2 】 将 40 g 稀盐酸逐滴加入 20 g 溶质质量分数为 4% 的氢氧化钠溶液中,边滴加边搅拌 . 随着稀盐酸的滴加,溶液的 pH 变化如图 HT6-2 甲所示,溶液的温度变化如图乙所示 ( 不考虑反应过程中热量损失 ). 试回答: (1) 图乙从 A 到 B 过程中,溶液的 pH 逐渐 ( 填 “ 增大 ” 或 “ 减小 ”). (2) 图乙表示酸碱恰好完全反应的点是 . (3) 计算稀盐酸中溶质的质量分数 . 图 HT6-2 减小 B [ 解法指导 ] 本题是一道以酸碱反应为背景,结合溶液中溶质质量分数计算的化学方程式计算题 . 同时,以坐标曲线图的方式呈现反应过程中的 pH 变化和温度变化 . 这种通过坐标曲线描述反应过程中某些量的变化来呈现反应进程的题型也是近几年中考的热点 . 答题时,需要明确曲线的变化背后的意义,并利用曲线上的某些量与化学反应建立联系,进行计算 . 例 3 徐州地区石灰石资源丰富 . 某化学兴趣小组称取 4.0 g 石灰石样品,把 40 g 稀盐酸分 4 次加入样品中 ( 假设杂质不反应也不溶解 ) ,得实验数据如下: 请计算: (1)4.0 g 石灰石样品中碳酸钙的质量是 g. (2)10 g 稀盐酸能与 g 碳酸钙恰好完全反应 . (3) 求稀盐酸的溶质质量分数 .( 写出计算过程,结果精确到 0.1%) 稀盐酸的用量 剩余固体的质量 第一次加入 10 g 3.0 g 第二次加入 10 g 2.0 g 第三次加入 10 g 1.0 g 第四次加入 10 g 0.6 g 3.4 1.0 [ 解法指导 ] 本题中出现了表格,也是近几年中考的热点 . 对于表格的数据分析,一般要运用质量守恒定律 . 分析表格中加入盐酸后剩余固体的质量的变化规律,当变化规律出现改变的点即碳酸钙完全反应的点,由此可以列出已知量和待求量,利用化学方程式求解 . 【 变式 3 】 [2018· 益阳 ] 某研究性学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品 5 g ,把 60 g 稀盐酸分四次加入,实验过程所得数据如下表 ( 已知石灰石样品中含有的杂质不溶于水,也不与稀盐酸反应 ). 根据实验数据计算: (1) 石灰石样品中碳酸钙的质量分数为 . (2) 求 60 g 稀盐酸中溶质质量分数 .( 要求写出计算过程 ) 实验次数 1 2 3 4 加入稀盐酸的质量 /g 15 15 15 15 剩余固体的质量 /g 3.50 2.00 0.75 0.75 85%查看更多