- 2021-11-06 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2011年全国各地市中考化学模拟试题分类汇编金属与金属矿物2
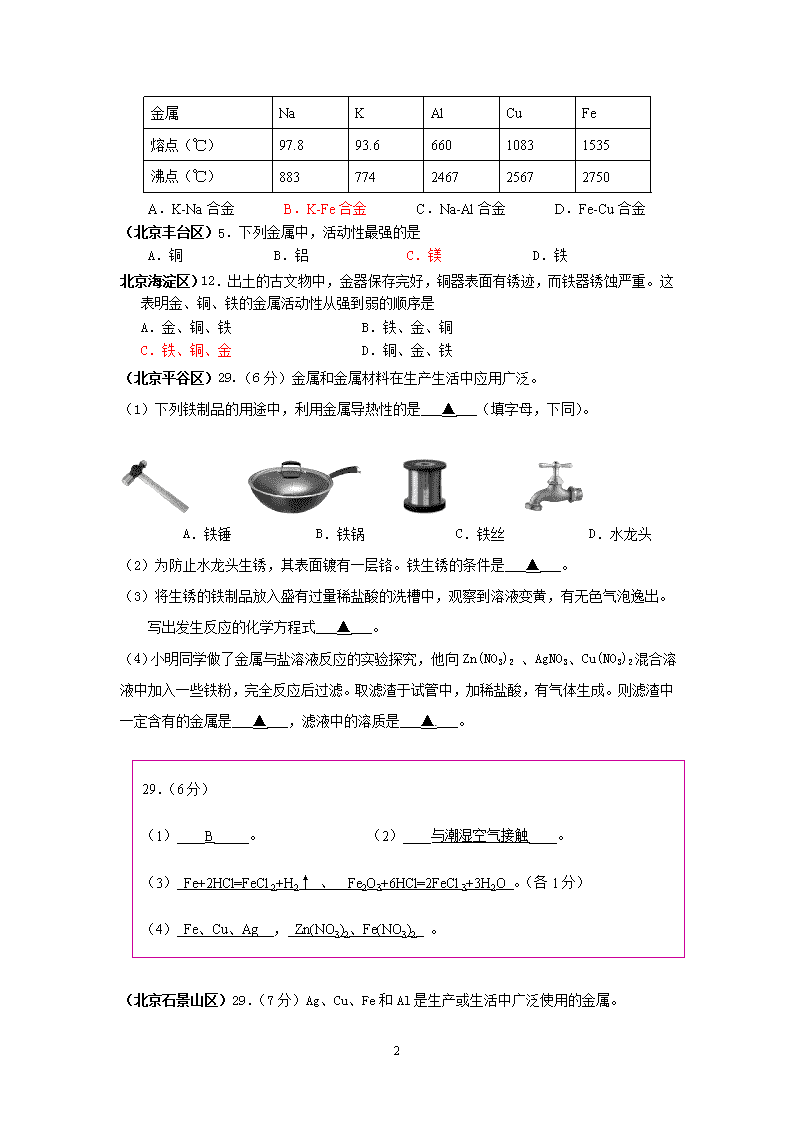
2011年全国各地市中考化学模拟试题分类汇编金属与金属矿物2 (河北省模拟)11.某新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线,当玻璃被击碎时,与金属线相连的警报系统就会立刻报警。“防盗玻璃”能报警,这利用了金属的 ( ) A.延展性 B.导热性 C.弹性 D.导电性 (湖北荆州市)9.下列防止金属锈蚀的措施中,不正确的是 A.雨淋后的自行车及时擦干并涂上石蜡油 B.金属容器的表面涂上一层油漆 C.铁制品放在干燥的环境中 D.铁制品表面的铁锈用作防护层 (安徽合肥市)11.(共5分)如今,青少年近视的人越来越多,我们青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具。请根据下图回答下列问题: ⑴图中标示的物质属于金属材料的有 (填序号,1个即可,下同);属于有机合成材料的是 。 ⑵灯管后面的反光片为铝箔。铝块能制成铝箔是利用了铝的 性。 ⑶设计实验方案比较铁和铜的金属活动性强弱: (只要写出实验方法或化学方程式)。11.(5分,第4空2分,其余每空1分) (1)① (或②、④均可) ⑤ (2)延展 (3)将铁片放入硫酸铜溶液中,观察现象(其他答案或化学方程式合理均可) (安徽合肥市)1.合肥市胜利广场原标志性建筑是一具钢铁制造的重达150吨的中 国结,因为建造地下商场,而地下商场又不能承载中国结的重量。 因此政府决定将中国结迁至北文化广场,整个拆迁、安装工程还 要持续一段时间,不过,五一前夕,市民将可再睹中国结的新风 采。有关钢铁的说法不正确的是:…………………………[ ] A.钢是铁合金 B.钢的硬度比纯铁要硬 C.钢是纯金属 D.钢的含碳量比生铁要低 (安徽合肥市)7.工业生产中常将两种金属在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物——合金。试根据下表中所列的金属的熔点和沸点数据(其他条件均已满足),判断不能制得合金的是:……………………………………………………………[ ] 7 金属 Na K Al Cu Fe 熔点(℃) 97.8 93.6 660 1083 1535 沸点(℃) 883 774 2467 2567 2750 A.K-Na合金 B.K-Fe合金 C.Na-Al合金 D.Fe-Cu合金 (北京丰台区)5.下列金属中,活动性最强的是 A.铜 B.铝 C.镁 D.铁 北京海淀区)12.出土的古文物中,金器保存完好,铜器表面有锈迹,而铁器锈蚀严重。这表明金、铜、铁的金属活动性从强到弱的顺序是 A.金、铜、铁 B.铁、金、铜 C.铁、铜、金 D.铜、金、铁 (北京平谷区)29.(6分)金属和金属材料在生产生活中应用广泛。 (1)下列铁制品的用途中,利用金属导热性的是___▲___(填字母,下同)。 A.铁锤 B.铁锅 C.铁丝 D.水龙头 (2)为防止水龙头生锈,其表面镀有一层铬。铁生锈的条件是___▲___。 (3)将生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,有无色气泡逸出。 写出发生反应的化学方程式___▲___。 (4)小明同学做了金属与盐溶液反应的实验探究,他向Zn(NO3)2 、AgNO3、Cu(NO3)2混合溶液中加入一些铁粉,完全反应后过滤。取滤渣于试管中,加稀盐酸,有气体生成。则滤渣中 一定含有的金属是___▲___,滤液中的溶质是___▲___。 29.(6分) (1)____B_____。 (2)____与潮湿空气接触____。 (3) Fe+2HCl=FeCl2+H2↑ 、 Fe2O3+6HCl=2FeCl3+3H2O 。(各1分) (4) Fe、Cu、Ag , Zn(NO3)2、Fe(NO3)2 。 (北京石景山区)29.(7分)Ag、Cu、Fe和Al是生产或生活中广泛使用的金属。 7 ⑴四种金属中,不是银白色的是 ▲ 。 ⑵铁制品容易锈蚀,铁生锈的条件是 ▲ 。生锈的废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为 ▲ 。 滤液 铁粉和铜 粉混合物 气体 滤渣 硝酸银溶液 过滤 稀盐酸 ⑶根据下图所示回答:滤渣中一定有的金属是 ▲ ,滤渣与稀盐酸反应的化学方程式为 ▲ ;滤液中的溶质是 ▲ 。 29.(7分)⑴ Cu ⑵ 与水和氧气接触 3CO + Fe2O3 高温 2Fe + 3CO2 ⑶ Fe 、Cu 、Ag Fe + 2HCl FeCl2 + H2↑ Fe(NO3)2(2分) (北京西城区)21.一般情况下,两种活泼性不同的金属在潮湿的环境中接触时,活泼性强的金属首先被腐蚀。为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌的金属是 A.铜板 B.银板 C.锌板 D.锡板 (北京西城区)29.(6分)金属在生产生活中应用广泛。 (1)用金属铜做电线,主要利用了金属的_____性。 (2)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)炼铁,反应的化学方程式为_____。 每年因腐蚀而报废了大量的铁制品,铁生锈的条件是_____。 (3)取某溶液少许放入试管中,向其中加入适量的铁粉,充分反应后,向试管中继续加入足量的另一种金属,溶液中FeSO4的质量随时间的 变化如右图所示。试分析: ①若b点表示的溶液中只含一种溶质,则a点表示的 溶液中的溶质可能是_____(写出1种情况即可), 从a点到b点的过程中,反应的化学方程式是_____。 ②若从b点到c点的过程中,溶液的质量不断增加,则加入的另一种金属是_____。 高温 === 29.(1)导电 (2)Fe2O3 + 3CO 2Fe + 3CO2 与潮湿的空气接触 (3)① FeSO4和H2SO4(或FeSO4和CuSO4或FeSO4、CuSO4和H2SO4) Fe + H2SO4 = FeSO4 + H2↑(与上空对应即可) ② Zn (北京燕山区)29.(9分)人类生活离不开金属。 (1)下列所示物质中,主要利用有机合成材料制成的是 ,根据下图,总结金属具有的物理性质有 。 a.铜导线 b.塑料餐具 c.铁锅 d.铝箔 7 (2)铁是生活中常用的金属。右图是某“取暖片”外 包装的图片。该“取暖片”中发热剂主要成分有 铁粉、活性炭、氯化钠、水等,其发热是利用铁 生锈时会放热 。 ①发热剂需接触到空气才会发热,原因是铁要与 等物质共同作用才会生锈。 ②炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁Fe2O3)、空气等为主要原料炼铁,请写出一氧化碳与氧化铁反应的化学方程式: ; (3)应用金属活动性顺序能帮助我们进一步学习金属性质。 已知下列各组物质间均能发生置换反应。 A.Fe 和CuSO4 溶液 B.Mg和MnSO4 溶液 C.Mn和FeSO4 溶液 ①写出B反应的化学方程式 。 ②Mn、Fe、Mg 、Cu四种金属的活动性由强到弱的顺序 。 Zn 0 反应时间 Mg Fe 氢气的质量 ③下图是等质量的稀硫酸分别与等质量的镁、铁、锌三种金属反应,生成氢气质量与反应时间之间关系图,其中表述正确的是 A.反应结束后,生成氢气质量相同 B.反应结束后,稀硫酸有剩余 C.反应结束后,镁、铁一定有剩余,锌可能有剩余 D.三种金属中镁的反应速率最快 (4)电化学腐蚀是金属腐蚀的主要原因。当两种活泼性不同的金属在潮湿的环境中接触时,因形成原电池,活泼性强的金属首先被腐蚀。利用这一原理,为了保护轮船的钢质外壳,通常在行驶的轮船外壳上连接 。(填“铜板”、“锌板”)。 高温 29、(1) b , 导电性、导热性、延展性 (2)①氧气和水 ②Fe2O3 + 3CO ==== 2Fe + 3CO2 (3)① Mg Mn Fe Cu ② 锌板 MnO2 (4) A C D (共2分,漏选给1分,错选、多选不给分) (广东东莞市)18. (6分)钢铁的生产和使用是人类文明和社会进步的一个重要标志。每年世界上钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失。 (1)铁在空气中锈蚀,实际上是铁跟 、 等物质相互作用的结果。 (2)试举两种减缓钢铁锈蚀的方法:① 、② ; (3)工人师傅在焊接钢铁制品时,通常先用稀盐酸清洗制品,原因是(用化学方程表示): 。 18. (6分)(1) 水 、 氧气 等物质相互作用的结果。 7 (2)① 涂油 、② 刷油漆 ; (3) Fe2O3+6HCl==2FeCl3+3H2O 。 (广东湛江市)20.(6分)小彬同学家新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的。他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动。 【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液……。铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液……。 【预 测】三种金属在金属活动性顺序中的相对位置关系: ①Cr> Al > Cu ②Al > Cr> Cu ③Al > Cu> Cr 【实验过程】取大小相同的三种金属薄片,用砂纸打磨光亮。 实验一 实验二 实验三 实验 方案 实验 现象 铬片表面产生气泡缓慢,溶液变蓝色。 ①____________________ 铝片表面产生气泡较快。 结论 铬能和稀硫酸发生反应,反应速率较慢。 铜不与稀硫酸反应 ②_________________ 三种金属在金属活动性顺序中的相对位置关系是③_____________________ 【回答问题】(1)填写上述“实验过程”中空白处。 (2)用砂纸打磨金属片的目的是_____________________。 (3)“实验一”中所发生反应的化学方程式是____________________________。 20.(1)①无明显实验现象②结论:铝能与稀硫酸发生反应,反应速率较快 ③Al > Cr > Cu(或“②”) (2)除去金属表面氧化物(或污物) (3) Cr+H2SO4=CrSO4+H2↑( 2分) (北京丰台区)28.(5分)铁、铜是我们生活中常见的金属。 (1)下列生活用品中,铁锅用来做饭是利用了铁的 性,铜丝作导线是利用了铜的 铁锅 铜丝 性。 (2)根据右侧转化关系图,回答问题。 7 ①铁生锈的条件是 。 ②写出步骤II中的化学方程式 。 ③黄色溶液中的溶质是 。 28.(5分) (1)导热 导电 (2)①潮湿的空气(与氧气、水接触) ②3CO + Fe2O32Fe + 3CO2 ③FeCl2、FeCl3、HCl (北京海淀区)27.(7分)汽车是现代生活中不可缺少的代步工具。请回答下列问题: (1)汽车电路中的导线大都是铜制的,这是利用了金属铜的延展性和____________性。 (2)下列汽车配件及用品中,属于有机合成材料的是(填序号,下同)__________。 a.钢铁外壳 b.玻璃车窗 c.橡胶轮胎 d.羊毛座垫 (3)铁在潮湿的空气中容易锈蚀。 ①汽车表面喷漆,可以延缓汽车的锈蚀,其防锈原理是隔绝____________和水。 ②喷漆前需将铁制品放入稀盐酸中除锈(铁锈主要成分是Fe2O3),观察到溶液变黄,有无色气泡逸出,反应的化学方程式是___________;___________。 (4)回收再利用生锈的铁制品是保护金属资源的一种有效途径。右图所示的废铁粉中Fe2O3含量大约在80%(其余20%为铁)左右,回收后在工业上常用一氧化碳将其还原,反应的化学方程式是_______________,若回收100 t这样的废铁粉可以得到__________t铁。 27.(共7分) (1)导电 ……………………………………………………1分 (2)c ……………………………………………………1分 (3)①空气(或氧气) ……………………………………………………1分 ② Fe2O3 + 6HCl == 2FeCl3 + 3H2O ……………………………1分 高温 Fe + 2HCl == FeCl2 + H2↑ ……………………………1分 7 (4)Fe2O3 + 3CO ===== 2Fe + 3CO2(写加热给分) ……………………………1分 76 ……………………………………………………1分 7查看更多