- 2021-11-06 发布 |
- 37.5 KB |
- 48页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
安徽专版2020中考化学复习方案主题三物质的化学变化第12课时质量守恒定律化学方程式课件
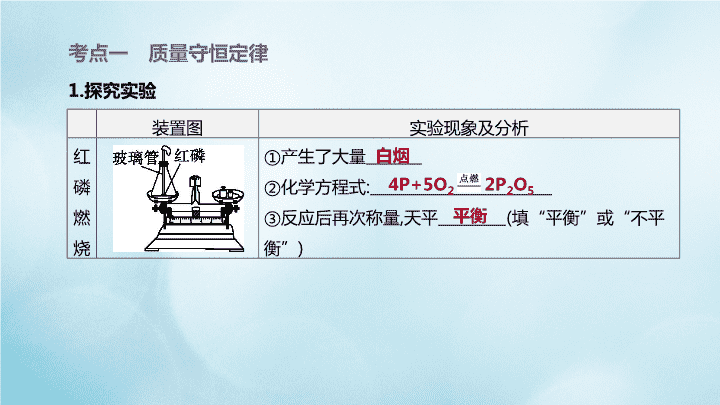
第 12 课时 质量守恒定律 化学方程式 主题三 物质的化学变化 装置图 实验现象及分析 红 磷 燃 烧 ①产生了大量 ②化学方程式: ③反应后再次称量,天平 (填“平衡”或“不平 衡”) 考点一 质量守恒定律 1.探究实验 白烟 4P+5O2 2P2O5 平衡 装置图 实验现象及分析 铁钉 与硫 酸铜 溶液 反应 ①铁钉表面产生了一种_______色固体,溶液由_________ 色变为 色 ②化学方程式: ③反应后再次称量,天平 (填“平衡”或“不平 衡”) (续表) 红 蓝 Fe+CuSO4 FeSO4+Cu 平衡 浅绿 装置图 实验现象及分析 盐酸 与碳 酸钠 粉末 反应 ①产生了大量 ②化学方程式 : ③反应后再次称量,天平 (填“平衡”或“不平 衡”) (续表) 气泡 Na2CO3+2HCl 2NaCl+H2O+CO2↑ 不平衡 装置图 实验现象及分析 镁条 燃烧 ①发出 ,放出热量,生成一种 色固体 ②化学方程式: ③反应后再次称量,天平 (填“平衡”或“不 平衡”) (续表) 耀眼白光 白 2Mg+O2 2MgO 不平衡 (续表) 装置图 实验现象及分析 注意 (1)在红磷燃烧的实验中:①小气球可防止红磷燃烧产生的热量使瓶内气体 迅速膨胀而冲开橡胶塞;②要等到气球变瘪后再观察天平是否平衡,因为气 球胀大产生的浮力会对天平平衡产生影响 (2)探究质量守恒定律需选择发生化学变化,且现象明显的反应;对于有气体 参加或有气体生成的反应,必须在密闭容器中进行 2.内容: 化学反应的 质量总和,等于反应后生成的 质 量总和。 (1)质量守恒定律只适用于化学变化;强调的是质量守恒,不适合体积守恒。 (2)没有参加反应的物质质量(反应物过量和催化剂等)和与反应无关的物质质量 不计在总和中。 (3)有气体或沉淀参与反应时,质量也不能忽略。 3.微观解释:在化学反应前后,原子的 没有改变, 没有增减, 也 没有改变,所以物质的总质量不变。 参加 各物质 各物质 种类 数目 质量 元素 种类 数目 质量 物质 分子 分子 考点二 化学方程式 1.认识化学方程式 (1)定义:用化学式来表示化学反应的式子。 (2)书写原则 必须以 为基础,遵循 定律。 客观事实 质量守恒 意义 读法(以S+O2 SO2为例) 表示 、 以及反应条件 硫和氧气在点燃条件下反应生成二氧 化硫 表示反应物、生成物之间的___________ 每32份质量的硫和32份质量的氧气 完全反应生成64份质量的二氧化硫 表示反应物、生成物之间的粒子__________ 每1个硫原子和1个氧分子反应生成1 个二氧化硫分子 (3)意义及读法 反应物 生成物 质量比 个数比 (4)书写步骤 写:根据事实写出反应物和生成物的化学式; 配:在化学式前面配上适当的化学计量数,使反应前后各原子的_______、_______ 相同; 注:注明化学反应的反应条件; 标:如果只有生成物中有气体,在气体物质的化学式右边要注“↑”号;溶液中的 反应如果生成物中有固体,在固体物质的化学式右边要注“↓”号;如果反应物 中也有气体或不溶性固体,则不用注明。 种类 数目 2.化学方程式的简单计算 (1)计算依据 化学反应中各物质之间存在固定的 比。 质量 (2)解题格式及解题步骤 [例题]3 g镁在氧气中充分燃烧,求生成的氧化镁的质量。 解:设可生成氧化镁的质量为x。(1)设未知量 2Mg+O2 2MgO (2)写出反应的化学方程式 48 80 (3)写出相关物质的相对分子质量与化学计量数的乘积 3 g x (4)对应列出相关物质的已知量、未知量 x=5 g (5)列出比例式,求解 答:生成氧化镁5 g。 (6)简明写出答案 【注意】 ①所写化学方程式必须配平,然后才能代入数据计算。 ②相关物质的相对分子质量与化学计量数的乘积、已知量、未知量要写在对应 物质化学式的下面。 ③代入化学方程式的量必须是纯净物的质量。 ④代入的数据都是一个完整的物理量,即所设未知数后不带单位,代入的已知量 及求得的未知量均带单位。 考向一 质量守恒定律的应用(6年6考) 1.[2019·潍坊]在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测 得反应前及反应过程中两个时刻各物质的质量如图12-1所示,图中a、b、c、d 分别表示相应物质的质量。下列说法正确的是 ( ) A.b的数值为14 B.该反应为复分解反应 C.反应过程中乙与丁发 生改变的质量比为5:6 D.充分反应后生成丙的 质量为37.5 g 图12-1 [答案] A [解析]根据题意有(26-b):(27-18)=(26-10):(30-18),b=14;反应后甲、乙 质量减小,是反应物,丙、丁质量增大,是生成物,但是不能判断各种物质的种类, 即不能判断是单质还是化合物,因此反应不一定是复分解反应;d=24+26+18 +32-17.2-10-30=42.8,反应过程中乙与丁发生改变的质量比为(26-10): (42.8-32)=40:27;由图中数据可知,充分反应后生成丙的质量为30g-18g= 12g。 考向二 质量守恒定律的实验探究(6年1考) 2.为了研究质量守恒定律,设计了如图12-2“白磷燃烧前后质量测定”的实验, 请分析有关问题。 (1)燃烧前称量锥形瓶的总质量为27.6 g,则托盘天平中游码的读数为 g。 (2)白磷燃烧过程中看到的现象是 , 其化学方程式为 ,气球起 作用。 (3)白磷燃烧 (填“遵守”或“不遵守”)质量 守恒定律,请从微观角度分析其原因:_______________ 。 图12-2 2.6 产生大量白烟 4P+5O2 2P2O5 缓冲 原子的种类、数目和质量都没有发生变化 遵守 化学反应前后 (1)用图12-3甲所示装置研究质量守恒定律。将烧杯放在天平上用砝码平衡,然 后倾斜烧杯使盐酸与碳酸钠粉末接触,一段时间后再把烧杯放在天平上,发现天 平的指针 (填序号)。 a.偏左 b.偏右 c.不偏转 d.无法预测 · 拓展延伸 · 图12-3 b (2)若将本实验中的烧杯替换成带有气球的锥形瓶,如图乙所示,其他操作不变, 装置气密性良好,最后天平仍不平衡,其原因是_____________________________ 。 图12-3 反应产生的二氧化碳使气球 膨胀,会受到浮力的影响 (3)由此可见,在验证质量守恒定律时,若利用有气体参加或有气体生成的化学 反应来设计实验,在装置设计方面应做到 。 (4)实验丙 (填“能”或“不能”)达到实验目的,理由是_____________ __________________________________________________________________________ ______________________________。 图12-3 装置密闭,体积不变 不能 硝酸钾溶液 和氯化钠溶液混合后不满足复分解反应发生的条件,不能发生化学反应,故不能 达到验证质量守恒定律的目的 考向三 化学方程式的书写和意义 3.[2019·吉林]下列化学方程式书写正确的是 ( ) A.2H2O 2H2+O2 B.2KMnO4 K2MnO4+MnO2+O2 C.BaCl2+Na2CO3 2NaCl+BaCO3↓ D.Zn+H2SO4 ZnSO4+H2 [答案] C [解析]A中化学方程式缺少反应条件,氢气、氧气后面没有标注↑,正确的化学 方程式应为2H2O 2H2↑+O2↑;B中化学方程式缺少反应条件,氧气后面没有 标注↑,正确的化学方程式应为2KMnO4 K2MnO4+MnO2+O2↑;C中化学方 程式书写完全正确;D中该化学方程式氢气后面没有标注↑,正确的化学方程式 应为Zn+H2SO4 ZnSO4+H2↑。 4.[2019·雅安]已知4FeS2+11O2 2Fe2O3+8X, 则下列关于该反应说法错误的是 ( ) A.O2与X的相对分子质量之比为1∶2 B.该反应属于置换反应 C.X属于空气污染物之一 D.该反应中硫元素的化合价升高 [答案] B [解析]该反应的生成物中没 有单质,不属于置换反应。 【方法点拨】书写化学方程式的题型一般分两类:第一类是基本型,取材于教材; 第二类是信息给予型。不管哪种形式,解决这类题的关键是要认真阅读、收集、 处理信息,找出反应物、生成物和反应条件,再结合化学方程式的书写方法进行 答题。 考向四 从微观角度理解化学反应(6年6考) 5.[2019·苏州]如图12-4是某反应的微观示意图。下列说法不正确的是( ) A.反应后硫元素化合价升高 B.生成物均为氧化物 C.反应后分子总数减少 D.参加反应的甲、乙分子个数比为1:2 图12-4 [答案] D [解析]由微观反应示意图可知,该反应是由硫化氢与氧气在点燃的条件下反应 生成二氧化硫和水,化学方程式为2H2S+3O2 2SO2+2H2O。硫元素由-2 价变为+4价,反应后硫元素化合价升高,A正确;生成物是二氧化硫和水,均为氧 化物,B正确;由化学方程式可知,反应后分子总数减少,C正确;由化学方程式可 知,参加反应的甲、乙分子个数比为2:3,D不正确。 6.[2019·攀枝花]我国科学家合成了一种特殊的催化剂,使甲烷高效转化为乙烯 获得重大突破,微观示意图如下。 图示中属于单质的物质名称是 ,图示所表示反应的化学方程式为 ,该反应属于基本反应类型中的 反应。 图12-5 [答案]氢气 2CH4 C2H4+2H2 分解 [解析]由图可知,属于单质的物质是 ,名称是氢气;甲烷在催化剂的作用下分 解生成乙烯和氢气;该反应符合“一变多”的形式,属于分解反应。 7.[2019·山西]碱式碳酸铜是孔雀石的主要成分,俗称铜绿,化学式为Cu2(OH)2CO3, 受热可分解生成CuO、水和二氧化碳。 (1)碱式碳酸铜的相对分子质量是 。 (2)铜绿分解生成22 g的二氧化碳的同时,生成CuO的质量是多少? 222 考向五 化学方程式的简单计算(6年6考) 7.[2019·山西]碱式碳酸铜是孔雀石的主要成分,俗称铜绿,化学式为 Cu2(OH)2CO3, 受热可分解生成CuO、水和二氧化碳。 (2)铜绿分解生成22 g的二氧化碳的同时,生成CuO的质量是多少? 解:设生成CuO的质量为x。 Cu2(OH)2CO3 2CuO+CO2↑+H2O 160 44 x 22 g x=80 g 答:铜绿分解生成22 g CO2的同时,生成CuO的质量是80 g。 8.[2019·长沙]为了测定某石灰石矿中碳酸钙的含量,进行了如下实验:称取10 g 石灰石样品,反复灼烧至质量不再改变,称得剩余固体质量为6.7 g(反应的化学 方程式为CaCO3 CaO+CO2↑,假设杂质不参与反应)。请计算: (1)反应生成的CO2的质量为 g。 (2)该石灰石样品中碳酸钙的质量分数。(写出计算过程) 3.3 8.[2019·长沙]为了测定某石灰石矿中碳酸钙的含量,进行了如下实验:称取10 g 石灰石样品,反复灼烧至质量不再改变,称得剩余固体质量为6.7 g(反应的化学 方程式为CaCO3 CaO+CO2↑,假设杂质不参与反应)。请计算: (2)该石灰石样品中碳酸钙的质量分数。(写出计算过程) 解:设10 g该石灰石样品中碳酸钙的质量为x。 CaCO3 CaO+CO2↑ 100 44 x 3.3 g x=7.5 g 该石灰石样品中碳酸钙的质量分数为 ×100%=75%。 答:该石灰石样品中碳酸钙的质量分数为75%。 1.[2019·安徽]图12-6是一种处理汽车尾气的反应微观示意图,有关说法正确的 是 ( ) A.反应前后分子总数不变 B.反应前后原子种类发生变化 C.反应前后均为纯净物 D.该反应可以减少二氧化氮的排放 图12-6 [答案] D [解析]从反应的微观示意图可以看出,反应前分子总数为3,反应后分子总数为 4,反应前后分子总数发生改变;根据质量守恒定律,化学反应前后原子的种类、 数目都不变;反应前有两种分子,为混合物,反应后有三种分子,也为混合物;该 反应过程中二氧化氮、甲烷是反应物,氮气、水和二氧化碳是生成物,因此该 反应可以减少二氧化氮的排放。 2.[2018·安徽]为实现二氧化碳的绿色利用,科学家用固碳酶作催化剂设计了如 图12-7所示的转化过程。下列有关说法正确的是 ( ) A.反应①的化学方程式为CO2+C CO B.固碳酶在反应前后化学性质发生变化 C.X的化学式为CH2 D.该过程实现了无机物向有机物的转化 图12-7 [答案] D [解析]由题给信息可知,反应①是由CO2反应转化为CO的过程,发生反应的化 学方程式为CO2+C 2CO;固碳酶是该过程的催化剂,催化剂在化学反应前 后化学性质不发生变化;由X的微观示意图可知,该化合物的化学式为C2H4;该 过程反应前的物质是无机物CO2,反应后最终所得物质为有机物C2H4,实现了 无机物向有机物的转化。 3.[2017·安徽]科学家发现,利用催化剂可有效消除室内装修材料释放的甲醛,其 反应微观示意图如图12-8所示。下列有关该反应的说法正确是 ( ) A.属于置换反应 B.可解决甲醛带来的室内空气污染问题 C.其中甲醛属于氧化物 D.化学方程式为HCO+O2 CO2+H2O 图12-8 [答案] B [解析]由反应的微观示意图可知,该反应是甲醛和氧气在催化剂条件下反应生 成了二氧化碳和水,反应的化学方程式是HCHO+O2 CO2+H2O;该反应 由一种单质与一种化合物反应生成了两种化合物,生成物中没有单质,不属于 置换反应;甲醛中含有碳、氢、氧三种元素,属于有机物,不是氧化物;甲醛和氧 气在催化剂条件下反应生成了二氧化碳和水,反应中消耗了甲醛,可解决甲醛 带来的室内空气污染问题。 4.[2016·安徽]据报道,中国科学技术大学研究人员利用钴及其氧化物成功研制 了一种新型催化剂,可将二氧化碳高效“清洁”地转化成液体燃料,反应的微观 示意图如图12-9所示。有关该反应的说法正确的是 ( ) A.反应前后原子总数减少 B.反应物和生成物中共有两种氧化物 C.得到的液体燃料的化学式是H2C2O D.可用于减少温室气体的排放 图12-9 [答案] D [解析]根据题意结合微观示意图,可写出反应的化学方程式为CO2+H2 H2CO2。在化学反应前后原子的种类与数量没有改变; 氧化物是由两种元素 组成,且其中一种是氧元素的化合物,反应物中CO2是氧化物,生成物中没有氧 化物;得到的液体燃料的化学式是H2CO2。 5.[2019·安徽]侯德榜是我国著名的化学家,发明了 侯氏制碱法,其反应原理如下: NaCl+CO2+NH3+H2O NaHCO3+NH4Cl。请 计算: (1)氯化铵中氮元素的质量分数。 解:(1)氯化铵中氮元素的 质量分数为 ×100% ≈26.2%。 答:(1)氯化铵中氮元素的 质量分数为26.2%。 5.[2019·安徽]侯德榜是我国著名的化学家,发明了侯氏制碱法,其反应原理如下: NaCl+CO2+NH3+H2O NaHCO3+NH4Cl。请计算: (2)生产8.4 t碳酸氢钠,理论上需要氯化钠的质量。 解:(2)设生产8.4 t碳酸氢钠,理论上需要氯化钠的质量为x。 NaCl+CO2+NH3+H2O NaHCO3+NH4Cl 58.5 84 x 8.4 t x=5.85 t 答:(2)生产8.4 t碳酸氢钠,理论上需要氯化钠的质量为5.85 t。 6.[2018·安徽]尿素[CO(NH2)2]是一种常见的氮肥。 工业上制备反应如下:CO2+2NH3 CO(NH2)2 +H2O。请计算: (1)尿素中氮元素的质量分数。(结果保留到0.1%) (2)生产6 t尿素理论上需要氨的质量是多少? 解:(1)尿素中氮元素的质 量分数为 ×100%≈ 46.7%。 答:(1)尿素中氮元素的质 量分数为46.7%; [解析](1)尿素中氮元素 的质量分数可根据尿素 的化学式计算。 6.[2018·安徽]尿素[CO(NH2)2]是一种常见的氮肥。工业上制备反应如下: CO2+2NH3 CO(NH2)2+H2O。请计算: (2)生产6 t尿素理论上需要氨的质量是多少? 解: (2)设理论上需要氨的质量为x。 CO2+2NH3 CO(NH2)2+H2O 34 60 x 6 t x=3.4 t 答:(2)要制得6 t尿素理论上需要氨的质量为3.4 t。 [解析] (2)根据化学方程式,由生成尿素的质量计算参加反应的氨的质量。查看更多