2019-2020学年河南省开封市五县联考高二上学期期末考试 化学 word版
河南省开封市五县联考2019-2020学年高二上学期期末考试化学
2020.01
考生注意:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分。满分100分,考试时间90分钟。
2.考生作答时,请将答案答在答题卡上。第I卷每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,第II卷请用直径0.5毫来黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
3.本卷命题范围:选修4,选修3第一章。
可能用到的相对原子质量:H1 O16 Na23 K39
第I卷(选择题 共42分)
一、选择题(本大题共14小题,每小题3分,共42分。在每小题列出的四个选项中,只有一项是符合题目要求的)
1.下列状态的镁中,电离最外层一个电子所需能量最大的是
2.有基态原子的外围电子排布式如下:
下列有关推断正确的是
A.原子半径:Y>R>Z>X B.第一电离能:Y
R>X>Y D.X的最高价氧化物对应水化物的酸性比R的强
3.基态X、Y、Z原子的核外电子排布式如下表,则下列化合物中不存在的是
A.Y2ZX3 B.Y2X2 C.YZ D.ZX3
4.第二周期非金属元素X、Y、Z、W、R的原子序数依次增大,它们的基态原子未成对电子数依次为1、2、3、2、1。下列有关上述五种元素的推断正确的是
A.元素Z位于第ⅥA族
B.气态氢化物中最稳定的是HR
C.最高价氧化物对应的水化物中,Y的酸性最强
D.XR3分子中每个原子都达到8电子稳定结构
5.X、Y、Z、W四种金属分别用导线两两相连浸入稀硫酸中组成原电池。X、Y相连时,X为负极;Z、W相连时,电子流向为ZW;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。则这四种金属的活动性顺序是
A.X>Z>W>Y B.Z>X>Y>W C.X>Y>Z>W D.Y>W>Z>X
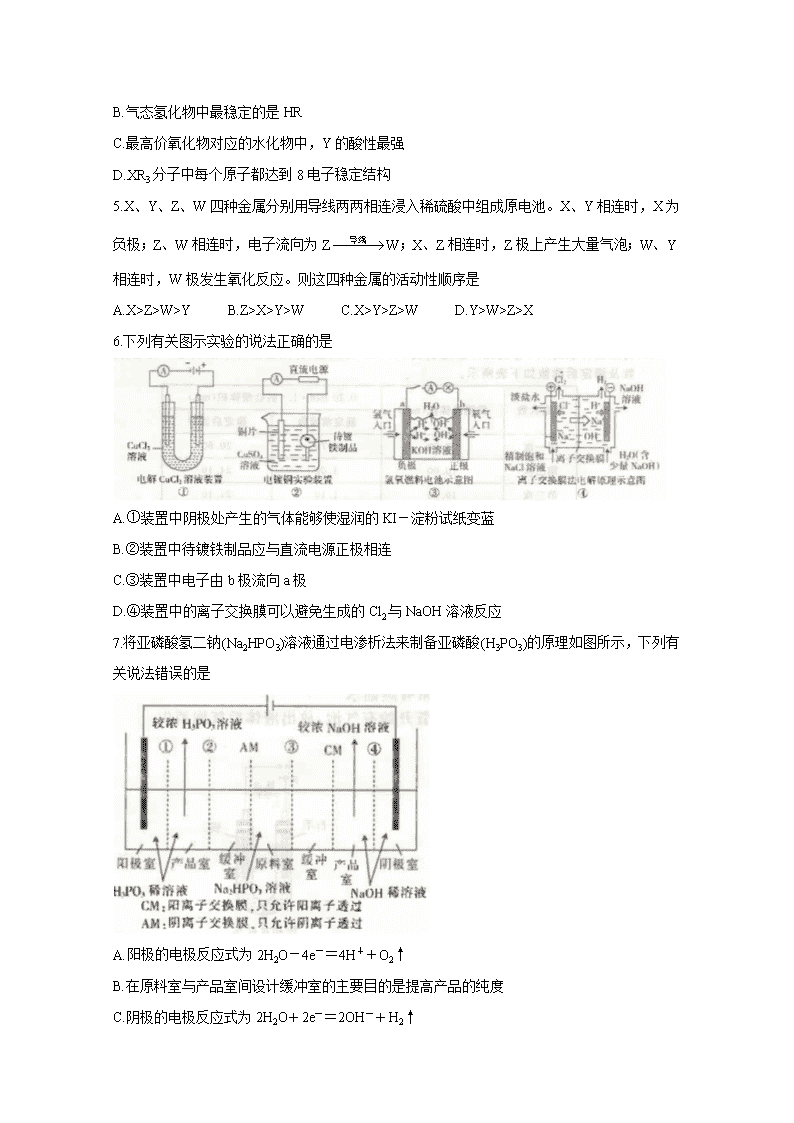
6.下列有关图示实验的说法正确的是
A.①装置中阴极处产生的气体能够使湿润的KI-淀粉试纸变蓝
B.②装置中待镀铁制品应与直流电源正极相连
C.③装置中电子由b极流向a极
D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
7.将亚磷酸氢二钠(Na2HPO3)溶液通过电渗析法来制备亚磷酸(H3PO3)的原理如图所示,下列有关说法错误的是
A.阳极的电极反应式为2H2O-4e-=4H++O2↑
B.在原料室与产品室间设计缓冲室的主要目的是提高产品的纯度
C.阴极的电极反应式为2H2O+2e-=2OH-+H2↑
D.膜①、③、④均为阳离子交换膜
8.H2S气体可以在空气中完全燃烧或不完全燃烧。根据以下三个热化学方程式,判断△H1、△H2、△H3三者关系正确的是
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H1
2H2S(g)+O2(g)=2S(s)+2H2O(l) △H2
2H2S(g)+O2(g)=2S(s)+2H2O(g) △H3
A.△H1>△H2>△H3 B.△H1>△H3>△H2 C.△H3>△H2>△H1 D.△H2>△H1>△H3
9.已知下列热化学方程式:
CH3COOH(I)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3 kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
H2(g)+O2(g)=H2O(l) △H-285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的△H为
A.-488.3 kJ·mol-1 B.-244.15 kJ·mol-1 C.+488.3 kJ·mol-1 D.+244.15 kJ·mol-1
10.下列图示与对应的叙述相符的是
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a点>b点
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
11.室温下,有关下列溶液的说法错误的是
A.水的电离程度:①=②=③=④
B.分别加水稀释10倍,溶液的pH:①>②>③>④
C.①、③两溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.V1L溶液②与V2L溶液③混合,若V1:V2=9:11,则混合后溶液的pH=4(忽略溶液体积变化)
12.下列实验操作能达到相应实验目的的是
13.在催化剂作用下,可逆反应2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)在温度为323K和343K时SiHCl2的转化率随时间变化的结果如图所示(已知:反应速率v=v正-v逆=k正-k逆,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数)。下列说法错误的是
A.343K时,反应的平衡转化率为22%
B.343K时,反应的平衡常数约为0.02
C.323K时,提高反应物压强或浓度可缩短反应达到平衡的时间
D.a处的1.1,且a处的反应速率大于b处的反应速率
14.已知H2X是二元弱酸。常温下,将盐酸滴加到Na2X溶液中,混合溶液的pOH[pOH=-lgc(OH-)]与离子浓度变化的关系如图所示。下列叙述正确的是
A.曲线N表示pOH与的变化关系
B.NaHX溶液中c(X2-)>c(H2X)
C.当混合溶液呈中性时,c(Na+)=c(HX-)+2c(X2-)
D.常温下,Na2X的第一步水解常数Kh1=1.0×10-4
第II卷(非选择题 共58分)
二、非选择题(本大题共6小题,共58分)
15.(7分)尿素[CO(NH2)2]是一种重要的工业原料,在160℃分解生成异氰酸和氨气,化学方程式为CO(NH2)22HCNO+NH3↑。回答下列问题:
(1)上述反应所涉及的各元素中,原子半径最大的是 (填元素符号),其原子核外电子共占据 个原子轨道。
(2)上述元素中有三种元素处于同周期,则:
①最简单气态氢化物的稳定性由大到小的顺序是 (用化学式表示)。
②元素的第一电离能由大到小的顺序是 (用元素符号表示,下同)。
③元素的电负性由大到小的顺序是 。
(3)氰酸有两种结构,一种分子内含有三键,称为氰酸,另一种分子内不含三键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。写出氰酸和异氰酸的结构式: 、 。
16.(8分)在一体积固定的密闭容器中,某化学反应2A(g)B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时问(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)实验1中,在10~20min内,用A表示的该反应的平均速率为 mol·L-1·min-1。
(2)实验2中c2= ,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 (填“>”“<”或“=”,下同)v1,且c3 1.0。
(4)请根据以上实验指出要加快该反应速率可采取的方法: 。(至少列举2种方法)
17.(11分)某研究性学习小组用浓度为0.20 mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。
(1)准确量取一定体积的待测液需要使用的仪器是 。
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为 mL。
(3)用盐酸标准液滴定待测烧碱样品的溶液时, (填“左手”或“右手”,下同)握酸式滴定管的活塞, 摇动锥形瓶,眼睛始终注视 。
(4)滴定时,若以酚酞为指示剂,滴定达到终点的标志是 。
(5)将准确称取的5.0g烧碱样品配制成250mL待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
由实验数据可知,烧碱的纯度为 。
(6)下列操作会导致测得的待测液的浓度偏大的是 (填标号)。
a.部分标准液滴出锥形瓶外 b.用待测溶液润洗锥形瓶
c.锥形瓶洗净后还留有蒸馏水 d.放出碱液的滴定管开始有气泡,放出液体后气泡消失
18.(11分)I.如图所示:
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的 腐蚀(填“吸氧”或“析氢”),正极发生的电极反应式为 。
(2)若开始时开关K与b连接,两极均有气体产生,则N端是电源的 极(填“正”或“负”),电解池总反应的离子方程式为 。
11.用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
(1)X极与电源的 (填“正”或“负”)极相连。氢气从 (填“B”或“C”)口导出。
(2)已知离子交换膜只允许某类离子通过,则M为 (填“阴离子”或“阳离子”)交换膜。
(3)若制得氧气5.6L(标准状况),则生成氢氧化钾的质量是 。
19.(11分)碳酸钾主要用作食品膨松剂,也用于彩色电视机工业。
(1)K2CO3溶液呈 (填“酸”或“碱”)性,其原因是 (用离子方程式表示);请设计一个简单的实验方案证明上述观点: 。
(2)下列有关0.1 mol·L-1的K2CO3溶液的叙述错误的是 (填标号)。
A.c(K+)=2c(CO32-) B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)
C.c(CO32-)+c(HCO3-)=0.1 mol·L-1 D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
(3)室温下将0.1 mol·L-1的K2CO3溶液与0.1 mol·L-1的盐酸等体积混合,所得溶液中各离子的浓度由大到小的顺序为 。
(4)将CO2通入0.1 mol·L-1的K2CO3溶液中至溶液呈中性,则溶液中2c(CO32-)+c(HCO3-)= mol·L-1(忽略溶液体积变化)。
20.(10分)亚硝酞氯(NOCl)是有机合成中的重要试剂,工业上可用NO和Cl2合成。回答下列问题:
(1)已知:①2NO2(g)+NaCl(s)NaNO3(s)+NOCl(g) △H1
②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g) △H2
③2NO(g)+Cl2(g)2NOCl(g) △H3
则△H3= (用含△H1、△H2的代数式表示)。
(2)一定温度下,向2L密闭容器中充入amol NOCl(g),发生反应2NOCl(g)2NO(g)+Cl2(g)。
①已知上述反应中正反应速率的表达式为v正=k·cn(NOCl)。300℃时,测得正反应速率与NOCl的浓度的关系如下表所示:
n= ;k= L·mol-1·s-1;当c(NOCl)=0.50 mol·L-1时,v正= mol·L-1·s-1。
②测得NO的物质的量浓度与温度的关系如图所示(x<0.5a),T1 T2(填“>”“<”或“=”);T2温度下,该反应的平衡常数K= mol·L-1(用含a、x的代数式表示)。