- 2021-08-24 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届山东省寿光现代中学高二10月月考(2016
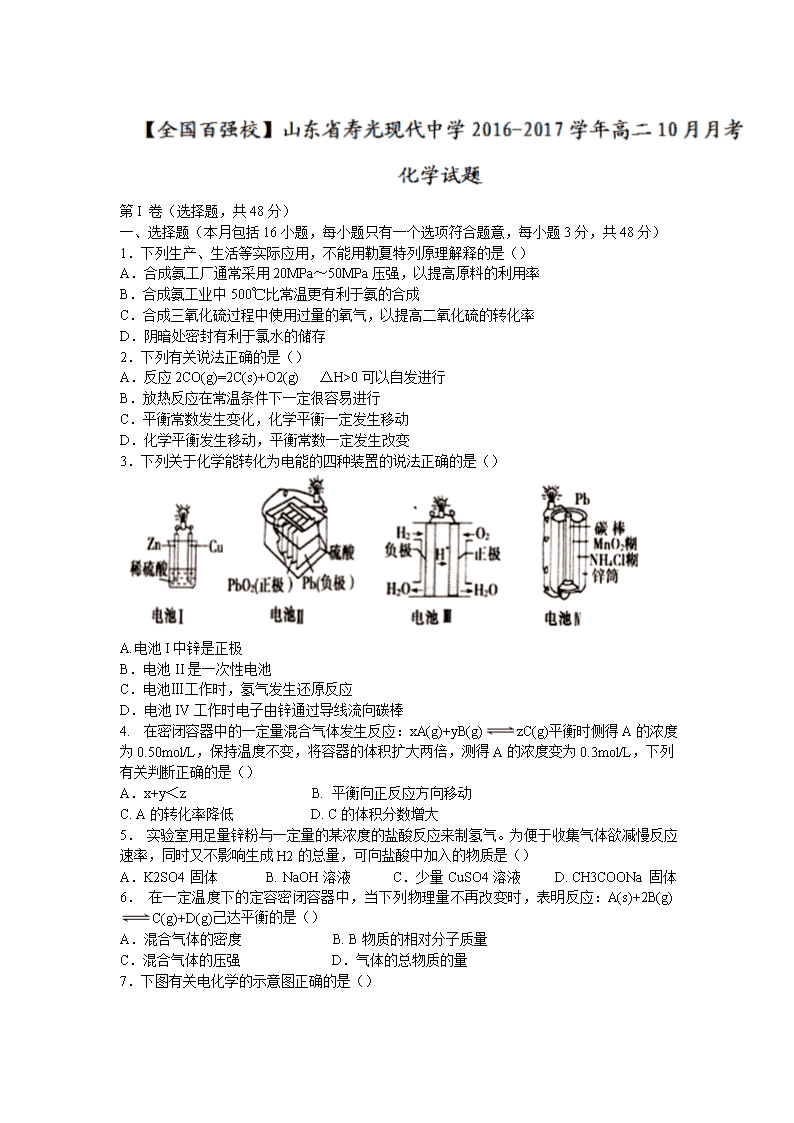
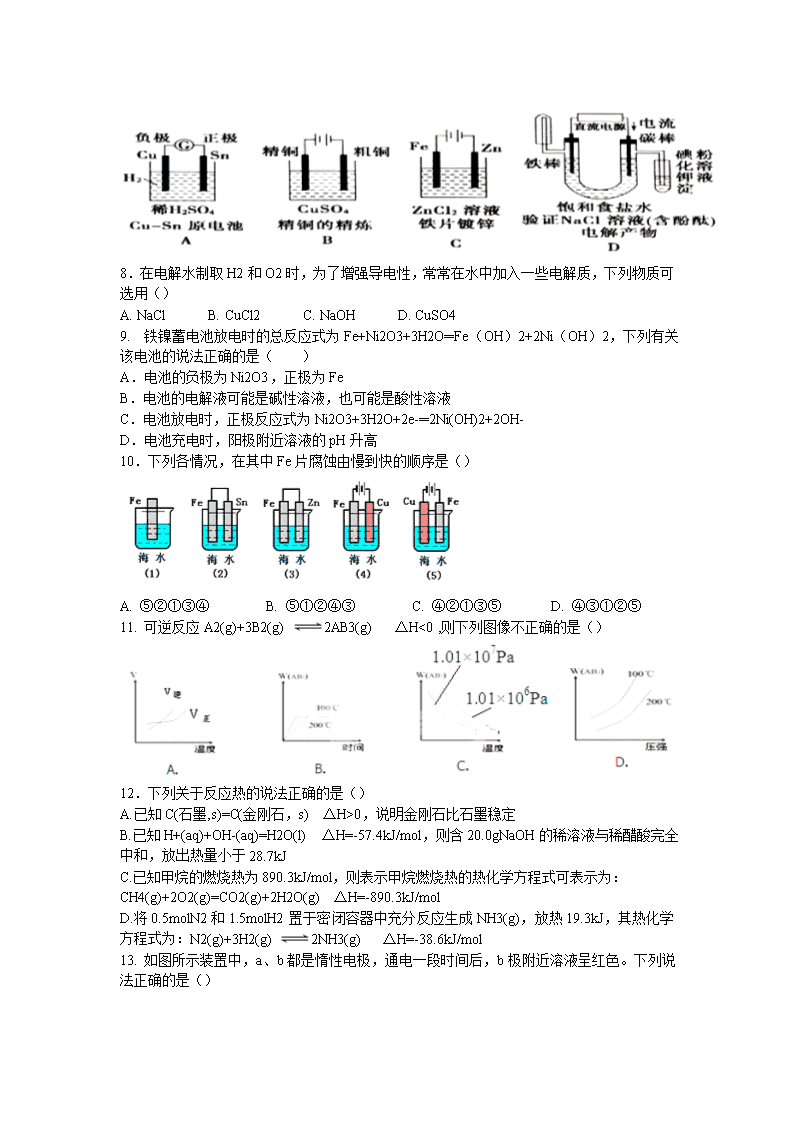
第I 卷(选择题,共48分) 一、选择题(本月包括16小题,每小题只有一个选项符合题意,每小题3分,共48分) 1.下列生产、生活等实际应用,不能用勒夏特列原理解释的是() A.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率 B.合成氨工业中500℃比常温更有利于氨的合成 C.合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率 D.阴暗处密封有利于氯水的储存 2.下列有关说法正确的是() A.反应2CO(g)=2C(s)+O2(g) △H>0可以自发进行 B.放热反应在常温条件下一定很容易进行 C.平衡常数发生变化,化学平衡一定发生移动 D.化学平衡发生移动,平衡常数一定发生改变 3.下列关于化学能转化为电能的四种装置的说法正确的是() A.电池I中锌是正极 B.电池II是一次性电池 C.电池Ⅲ工作时,氢气发生还原反应 D.电池IV工作时电子由锌通过导线流向碳棒 4. 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)zC(g)平衡时侧得A的浓度为0.50mol/L,保持温度不变,将容器的体积扩大两倍,测得A的浓度变为0.3mol/L,下列有关判断正确的是() A.x+y<z B. 平衡向正反应方向移动 C. A的转化率降低 D. C的体积分数增大 5. 实验室用足量锌粉与一定量的某浓度的盐酸反应来制氢气。为便于收集气体欲减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是() A.K2SO4固体 B. NaOH溶液 C.少量CuSO4溶液 D. CH3COONa固体 6. 在一定温度下的定容密闭容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g) C(g)+D(g)己达平衡的是() A.混合气体的密度 B. B物质的相对分子质量 C.混合气体的压强 D.气体的总物质的量 7.下图有关电化学的示意图正确的是() 8.在电解水制取H2和O2时,为了增强导电性,常常在水中加入一些电解质,下列物质可选用() A. NaCl B. CuCl2 C. NaOH D. CuSO4 9. 铁镍蓄电池放电时的总反应式为Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2,下列有关该电池的说法正确的是( ) A.电池的负极为Ni2O3,正极为Fe B.电池的电解液可能是碱性溶液,也可能是酸性溶液 C.电池放电时,正极反应式为Ni2O3+3H2O+2e-═2Ni(OH)2+2OH- D.电池充电时,阳极附近溶液的pH升高 10.下列各情况,在其中Fe片腐蚀由慢到快的顺序是() A. ⑤②①③④ B. ⑤①②④③ C. ④②①③⑤ D. ④③①②⑤ 11. 可逆反应A2(g)+3B2(g) 2AB3(g) △H<0 ,则下列图像不正确的是() 12.下列关于反应热的说法正确的是() A.已知C(石墨,s)=C(金刚石,s) △H>0,说明金刚石比石墨稳定 B.已知H+(aq)+OH-(aq)=H2O(l) △H=-57.4kJ/mol,则含20.0gNaOH的稀溶液与稀醋酸完全中和,放出热量小于28.7kJ C.已知甲烷的燃烧热为890.3kJ/mol,则表示甲烷燃烧热的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ/mol D.将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ/mol 13. 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是() ①X是正极,Y是负极 ②a是阴极,b是阳极 ③CuSO4溶液的pH值逐渐减小 ④NaCl溶液的pH减小 A.①③ B.②③ C.①④ D.②④ 14. 在气体反应中,改变条件①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物⑤加入催化剂。能使反应物中活化分子数和活化分子百分数同时增大的方法是( ) A.①⑤ B.①③ C.②⑤ D.③⑤ 15.已知某可逆反应:mA(g)+nB(g) pC(g) △H=Q kJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是 A.T1<T2 P1>P2 m+n>p ΔΗ<0 B.T1>T2 P1<P2 m+n<p ΔΗ>0 C.T1<T2 P1>P2 m+n<p ΔΗ<0 D.T1 >T2 P1<P2 m+n>p ΔΗ>0 16. 一定温度下,在固定容积、体积为2L的密闭容器中充入1molN2和3molH2发生反应,当反应进行到10s末时达到平衡,此时容器中c(NH3)=0.15mol·L-1。下列有关判断不正确的是() A.反应达平衡时N2的转化率为7.5% B.反应进行到10s末时,H2的平均反应速率是0.0225mol·(L·s)-1 C.该反应达到平衡时的标志是容器中气体密度不再改变 D.再往该容器中充入1molN2和3molH2,重新达到平衡时c(NH3)=0.30mol/L 第II卷(非选择题,共52分) 二、非选择题 17.(14分)如下图所示装置中,当线路接通时,发现M 滤纸(用Na2SO4溶液的石蕊试液浸润过)的a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化。回答: (1)甲、乙分别是什么装置? _____、______。 (2)写出A、B、C、D的电极名称以及电极材料和电极反应式。 A极:____________________; B极:______________________; C极:______________________; D极:________________________。 18.(18分)运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。 (1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1, ①该反应在低温下________(填“能”或“不能”)自发进行。 ②写出该反应的平衡常数表达式_________________。 (2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)的K=0.5。 ①在400℃时,2NH3(g) N2(g)+3H2(g)的K′=________(填数值)。 ②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正________ v(N2)逆(填“>”、“<”、“=”或“不能确定”)。 ③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡________移动(填“向左”、“向左”或“不”);反应的ΔH(填“增大”、“减小”或“不改变”)。 (3)水煤气转化反应CO(g)+H2O(g) CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下两组教据: ① 实验l中以CO2表示的反应速率为v(CO2)=_________; ② 实验1的平衡常数K1 _实验2的平衡常数K2 (填“大于””小于,“等于”“不能确定”)。 ③ 该反应正方向为__ (填“吸”或‘放”)热反应; 19.(10分)(1)在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇;CO(g)+2H2(g) CH3OH(g) ① 则该反应的△S_____O,△H______O (填“<”、“>”或“=”)。 ② 若容器容积不变,下列措施可提高CO转化率的是_. A.升高温度 B.将CH3OH从体系中分离 C.充入He,使体系总压强增大 D.再充入lmolCO和3 molH2 (2)以CH4和H2O为原料,通过下列反应来制备甲醇。 I:CH4(g)+ H2O(g) CO(g)+3H2(g) △H =+206.0kJ/mol II:CH3OH(g)CO(g)+2H2(g) △H =+129.0kJ/mol CH4(g)和 H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为__________。 (3)在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)2HI(g) △H<0。改变下列条件能加快化学反应速率的是_____ (a)保持容器容积不变,向其中加入1molH2。 (b)保持容器容积不变,向其中加入1molN2。(N2不参加反应)。 (c)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应)。 (d)保持容器内气体压强不变,向其中加入1molH2(g)和1molN2(g)。 (e)提高起始的反应温度。 20. (10分)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和02,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行惰性电极电解饱和氯化钠溶液实验。回答下列问题: (1)甲烷燃料电池正极的电极反应为______、负极的电极反应为______。 (2)下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子 通过。电解氯化钠溶液的离子反应方程式为______________。 (3)精制饱和食盐水从图中____位置补充,浓氢氧化钠溶液从图中__位置流出。(选填“a”、“b ”、“c ”或“d” ) (4)若甲烷通入量为lL(标准状况),且反应完全,则最多能产生的氯气体积为_____ L (标准状况)。 1-5:BCDCD 6-10:ADCCD 11-16:CBACB B 17.(14分)(电极反应式2分,其余l分) (1)甲为原电池,乙为电解池; (2)A极:(负极Zn ): Zn-2e-=Zn2+ B极(正极Ag):Cu2++2e-=Cu C极(阳极Pt): 4OH-+4e-=2H2O+O2↑ D极(阴极Cu):2H++2e-=H2↑ 18.(18分)(每空2分) (1)①不能②; (2)① 2 ;②=;③逆向、不变; (3)①0.16mol/(L·min);②大于;③放。 19.(10分)(每空2分) (1)① <, <② BD ; (2)CH4(g)+ H2O(g)CH3OH(g)+H2(g) △H =+77kJ/mol; (3)ae 。 20.(10分)(每空2分) (1)O2+2H2O+4e-=4OH-、CH4+10OH--8e-=CO32-+7H2O; (2)2Cl-+2H2O2OH-+H2↑+Cl2↑ (3)a、d;(4)4查看更多