- 2021-08-24 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年重庆长寿中学高二下学期第三次月考化学试题 Word版
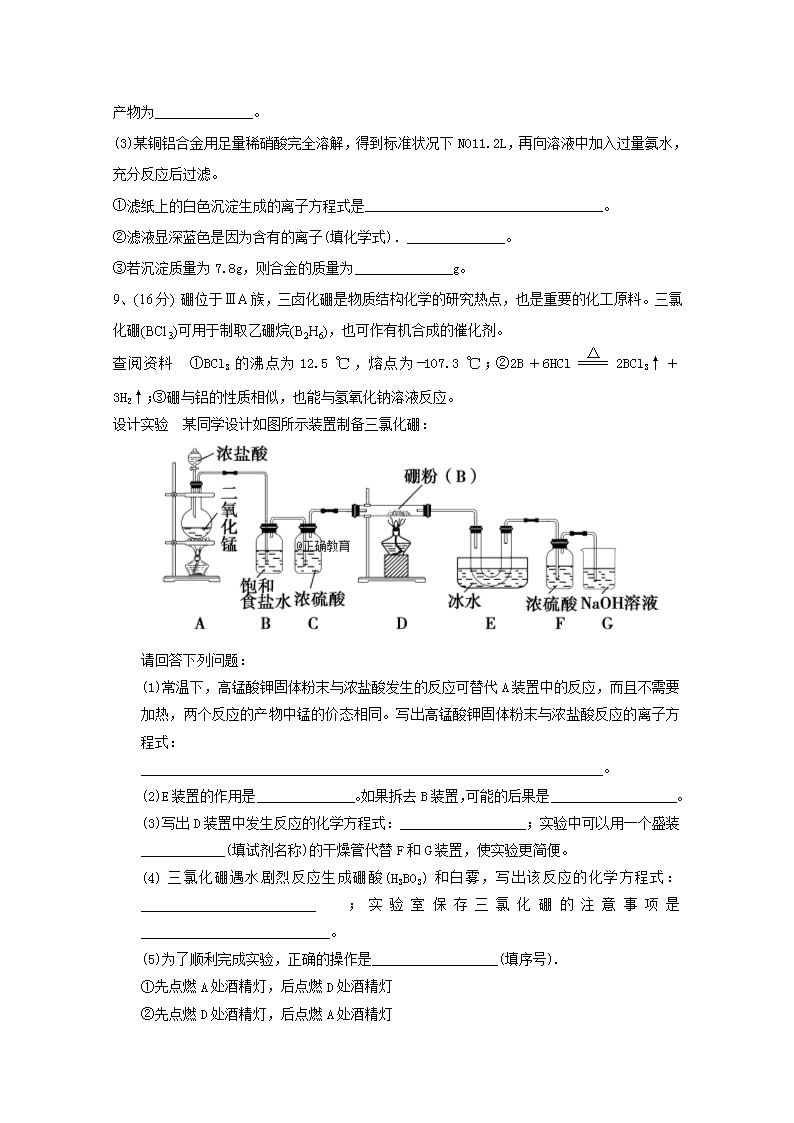
2017-2018学年重庆长寿中学高二下学期第三次月考 化学试题 可能用到的相对原子质量:H-1 O-16 Al-27 Cu-64 1.下列解释实验过程或事实的反应方程式不正确的是 A.在稀氨水中通入过量CO2:NH3·H2O+CO2===NH+HCO B.向K2S溶液中滴加硫酸酸化的双氧水,溶液中有黄色沉淀生成: S2﹣+H2O2+2H+=S↓+2H2O C.镁条着火后,不能用CO2灭火:2Mg+CO2 2MgO+C D.Cu溶于FeCl3溶液: Fe3++Cu=Cu2++Fe2+ 2、下列选项操作错误或不能达到实验目的的是( ) A、可用25ml酸式滴定管量取20.00ml KMnO4溶液 B、从碘水中提取单质碘,不能用无水乙醇代替CCl4 C、石蕊试纸和PH试纸使用前用蒸馏水润湿 D、CO2中混有少量SO2,除杂试剂和方法为:KMnO4(H+)、浓硫酸,洗气 3、X、Y、Z、W、R为原子序数递增的5种短周期元素,已知X的离子为一个质子,Y原子最外层电子数比内层电子数多4个,Y与R同主族,Z的最外层电子数等于其周期序数,W是制造太阳能电池的常用材料.下列说法正确的是( ) A.原子半径按X、Y、Z、R、W依次递增 B.Z与Y形成的化合物可作为耐火材料 C.WY2能与强碱反应,但不能与任何酸反应 D.热稳定性:X2R>X2Y 4、下表中列出了25℃、101kPa时一些物质的燃烧热数据 物质 H2 C2H4 CH4 燃烧热/kJ·mol﹣l 285.8 1375.6 890.3 已知键能:C—H键:413.4 kJ·mol﹣1、H—H键:436.0 kJ·mol﹣1。 则下列叙述正确的是 A.C=C键能为615.0 kJ·mol﹣1 B.C—H键键长小于H—H键 C.2H2(g)+O2(g)=2H2O(g) △H=﹣571.6 kJ·mol﹣1 D.2CH4(g)=C2H4(g) +2H2(g) △H=﹣376.4 kJ·mol﹣1 5、药物A的结构如图,下列有关药物A的叙述正确的是( ) A.药物A的分子式为C17H16O3 B.A的水解产物不可能发生聚合反应 C.A不能使FeCl3溶液发生显色反应 D.1molA与NaOH溶液反应,最多消耗3molNaOH 6、下列说法错误的是( ) A.常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得pH≠7,则混合溶液的pH>7 B.在Na2S中存在:C(OH-)=C(HS-)+2C(H2S)+C(H+) C.某单质X能从盐的溶液中置换出Y,当X是金属时,Y可能是金属,也可能是非金属 D.常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp不变 7、下列图示与对应叙述相符的是( ) A.图①表示向20 mL 0.1 mol/L氢氧化钠溶液中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化 B.图②表示压强对可逆反应2A(g)+3B(g)5C(g)+nD(s)的影响,乙的压强比甲的压强大 C.图③中曲线表示反应3A(g) + B(g)2C(g)△H<0,正、逆反应的平衡常数K随温度的变化 D.据图④,若要除去CuSO4溶液中的Fe3+,可加入浓NaOH溶液至pH在4左右 8、(14分)尽管氮元素在地壳中的丰度较低(主要以硝酸盐的形式存在),在所有元素中仅排31位,但是大气中有丰富的氮气,这为氨和硝酸的广泛应用提供了可能。 (1)氮气的电子式为_______,工业上合成氨的化学反应方程式为______________。 (2)食物蕴含的营养物质中,含氮的高分子化合物是______________ (填名称),其水解的最终产物为______________。 (3)某铜铝合金用足量稀硝酸完全溶解,得到标准状况下NO 11.2 L,再向溶液中加入过量氨水,充分反应后过滤。 ①滤纸上的白色沉淀生成的离子方程式是__________________________________。 ②滤液显深蓝色是因为含有的离子(填化学式).______________。 ③若沉淀质量为7.8g,则合金的质量为______________g。 9、(16分) 硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。 查阅资料 ①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。 设计实验 某同学设计如图所示装置制备三氯化硼: 请回答下列问题: (1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,而且不需要加热,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式: __________________________________________________________________。 (2)E装置的作用是______________。如果拆去B装置,可能的后果是__________________。 (3)写出D装置中发生反应的化学方程式:__________________;实验中可以用一个盛装____________(填试剂名称)的干燥管代替F和G装置,使实验更简便。 (4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:_________________________;实验室保存三氯化硼的注意事项是___________________________。 (5)为了顺利完成实验,正确的操作是__________________(填序号). ①先点燃A处酒精灯,后点燃D处酒精灯 ②先点燃D处酒精灯,后点燃A处酒精灯 ③同时点燃A、D处酒精灯 (6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:___________________________________。 10(14分)、我国科研人员从天然姜属植物分离出的一种具有显著杀菌、消炎、解毒作用的化合物H。H的合成路线如下: 已知: (1) A→B的反应类型是 。 (2) 化合物B中的含氧官能团为 和 (填官能团名称)。 (3) 写出同时满足下列条件的B的一种同分异构体的结构式: 。 Ⅰ. 苯环上有两个取代基 Ⅱ. 分子中有6种不同化学环境的氢 Ⅲ. 既能与FeCl3溶液发生显色反应,又能发生银镜反应,水解产物之一也能发生银镜反应 (4) 实现F→G的转化中,加入的化合物X(C12H14O3)的结构简式为 。 (5) 化合物是合成紫杉醇的关键化合物,请写出以和CH3CHO为原料制备该化合物的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: CH2CH2CH3CH2OHCH3CHO 11(14分)2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。 (1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)2CO2(g)+ N2(g)。△H<0 ①该反应平衡常数表达式 ②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。 (2)若将NO 和CO按物质的量之比为2:1投入恒温、恒容的密闭容器中,压强变为原来的0.9倍,则NO的转化率为__________________________ (3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变). ①甲烷燃料电池的负极反应式: 。 ②电解后溶液的pH= (忽略氯气与氢氧化钠溶液反应) ③阳极产生气体的体积在标准状况下是 L 参考答案 D、C、B、A、C、A、B 8、(14分) (1):N::N:(2分),N2+3H22NH3(条件:高温高压催化剂,可逆符号)(2分) (2)蛋白质 氨基酸(各1分) (3) ①AL3+ + 3NH3.H2O=AL(OH)3↓+3NH4(3分) ②[Cu(NH3)4]2+(2分) ③41.1g(3分) 9、(16分) (1)2KMnO4+10Cl-+16H+===2Mn2++8H2O+5Cl2↑+2K+(3分) (2)冷却和收集三氯化硼(2分) 硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸(2分) (3)2B+3Cl2====2BCl3(2分) 碱石灰(1分) (4)BCl3+3H2O===H3BO3+3HCl↑(2分) 密封保存(1分) (5)① (1分) (6)取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉(2分) 10(14分)、(1)(2)(3)题各2分.(4)题3分(5)题5分 11(14分)(1)①略(2分) ② bd (2分) (2)30%(2分) (3)①CH4 —8e— + 2H2O =CO2 + 8H+ (3分) ②14 (2分) ③ 1.68L(3分)查看更多