- 2021-08-24 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年江西省吉安市永丰中学高二上学期期中考试化学试题 Word版
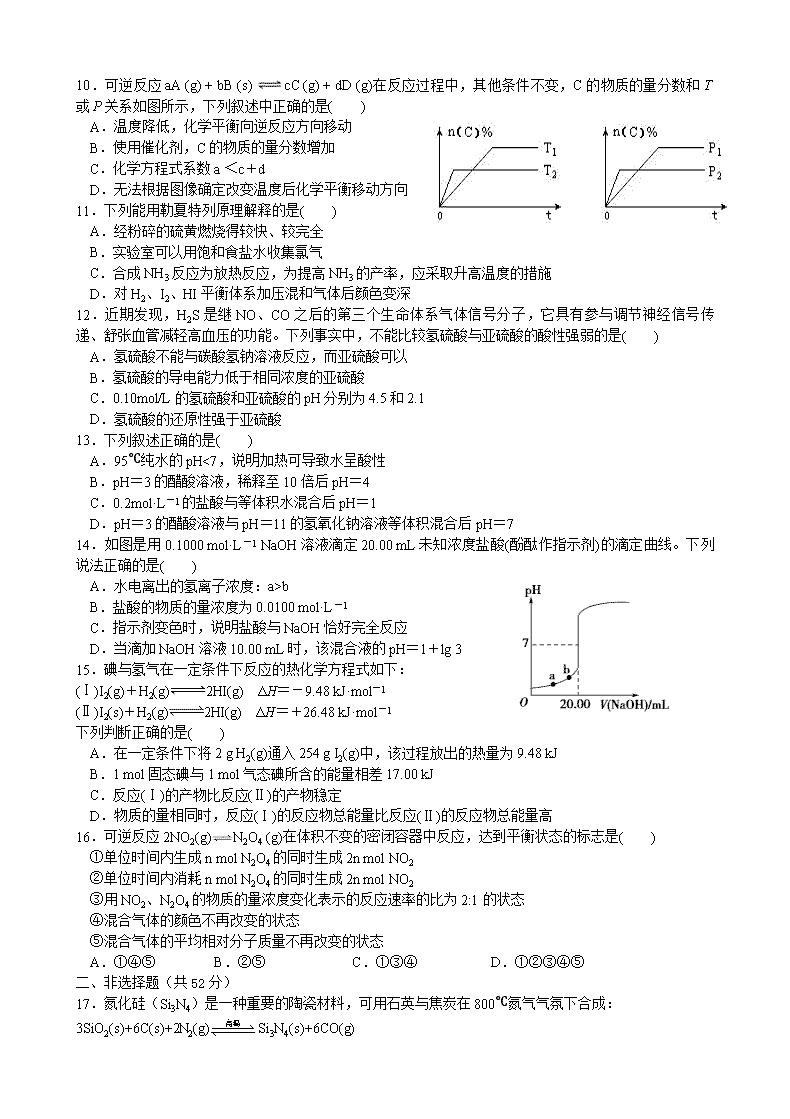
永丰中学2019-2020学年第一学期高二期中考试 化 学 试 卷 时间:90分钟 总分:100分 可能用到的相对原子质量:H-1 C-12 N-14 S-32 Cr-52 I-127 一、单项选择题(本题包括16小题,每小题3分,共48分) 1.《中国诗词大会》不仅弘扬了中国传统文化,还蕴含着许多化学知识,下列分析不正确的是( ) A.诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能 B.诗句“千淘万漉虽辛苦,吹尽狂沙始到金”,金性质稳定可通过物理方法得到 C.诗句“爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应 D.诗句“日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华的现象 2.下列食品添加剂中,其使用目的与反应速率有关的是( ) A.着色剂 B.调味剂 C.抗氧化剂 D.增稠剂 3.以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+O2 (g)→2CO2 (g)+H2O(l) △H =-1300kJ/mol 的说法中,正确的是( ) A.当有NA个水分子生成且为液体时,吸收1300kJ的能量 B.当有10 NA个电子转移时,该反应放出1300kJ的能量 C.当有2 NA个碳氧共用电子对生成时,放出1300kJ的能量 D.当有4 NA个碳氧共用电子对生成时,放出1300kJ的能量 4.对可逆反应2A(s)+3B(g)C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( ) ①增加A的量,平衡向正反应方向移动②升高温度,反应速率增大,平衡向逆反应方向移动③压缩容器增大压强,平衡不移动,v正、v逆不变④增大B的浓度,v正>v逆⑤加入催化剂,B的转化率提高 A. ①② B. ②④ C. ①③ D. ② 5.在一密闭的容器中,反应aA(g)bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( ) A.物质A的转化率提高了 B.平衡向逆反应方向移动了 C.物质B的质量分数减少了 D.a>b 6.为达到预期的实验目的,下列操作中正确的是( ) A.用玻璃棒蘸取待测液滴在润湿的pH试纸上,测得其pH为12 B.向Fe(OH)3胶体中逐滴滴加盐酸溶液至过量,现象是先有沉淀生成后沉淀溶解 C.中和热测定的实验中使用的玻璃仪器只有2种 D.在滴定时,左手操作锥形瓶,右手操作滴定管开关 7.常温下,下列各组离子一定能在指定溶液中大量共存的是( ) A.使紫色石蕊变红色的溶液中:Na+、Al3+、I-、NO2- B.=10-13mol·L-1的溶液中:NH 4+、Ca2+、Cl-、NO3- C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- D.由水电离产生的c(H+)=1×10-13mol•L-1的溶液:K+、Fe2+、Cl-、NO3- 8.一定条件下,将10molH2和1molN2充入一密闭容器中,发生反应:N2(g)+3H2(g)2NH3(g),达到平衡时,H2的转化率可能是( ) A.25% B.30% C.35% D.75% 9.已知:N2(g)+3H2(g) 2 NH3(g) ΔH=-92.4 kJ·mol-1。一定条件下,现有容积相同且恒容的密闭容器甲与乙:①向甲中通入1 mol N2和3 mol H2,达到平衡时放出热量Q1 kJ;②向乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2 kJ。则下列关系式正确的是( ) A.Q1=2Q2=92.4 B.92.4=Q1<2Q2 C.92.4>Ql>2Q2 D.Q1=2Q2<92.4 10.可逆反应aA (g) + bB (s) cC (g) + dD (g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( ) A.温度降低,化学平衡向逆反应方向移动 B.使用催化剂,C的物质的量分数增加 C.化学方程式系数a <c+d D.无法根据图像确定改变温度后化学平衡移动方向 11.下列能用勒夏特列原理解释的是( ) A.经粉碎的硫黄燃烧得较快、较完全 B.实验室可以用饱和食盐水收集氯气 C.合成NH3反应为放热反应,为提高NH3的产率,应采取升高温度的措施 D.对H2、I2、HI平衡体系加压混和气体后颜色变深 12.近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是( ) A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B.氢硫酸的导电能力低于相同浓度的亚硫酸 C.0.10mol/L的氢硫酸和亚硫酸的pH分别为4.5和2.1 D.氢硫酸的还原性强于亚硫酸 13.下列叙述正确的是( ) A.95℃纯水的pH<7,说明加热可导致水呈酸性 B.pH=3的醋酸溶液,稀释至10倍后pH=4 C.0.2mol·L-1的盐酸与等体积水混合后pH=1 D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 14.如图是用0.1000 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞作指示剂)的滴定曲线。下列说法正确的是( ) A.水电离出的氢离子浓度:a>b B.盐酸的物质的量浓度为0.0100 mol·L-1 C.指示剂变色时,说明盐酸与NaOH恰好完全反应 D.当滴加NaOH溶液10.00 mL时,该混合液的pH=1+lg 3 15.碘与氢气在一定条件下反应的热化学方程式如下: (Ⅰ)I2(g)+H2(g)2HI(g) ΔH=-9.48 kJ·mol-1 (Ⅱ)I2(s)+H2(g)2HI(g) ΔH=+26.48 kJ·mol-1 下列判断正确的是( ) A.在一定条件下将2 g H2(g)通入254 g I2(g)中,该过程放出的热量为9.48 kJ B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ C.反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定 D.物质的量相同时,反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高 16.可逆反应 2NO2(g)N2O4 (g)在体积不变的密闭容器中反应,达到平衡状态的标志是( ) ①单位时间内生成 n mol N2O4的同时生成 2n mol NO2 ②单位时间内消耗 n mol N2O4的同时生成 2n mol NO2 ③用NO2、N2O4的物质的量浓度变化表示的反应速率的比为2:1 的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的平均相对分子质量不再改变的状态 A.①④⑤ B.②⑤ C.①③④ D.①②③④⑤ 二、非选择题(共52分) 17.氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在800℃氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)Si3N4(s)+6CO(g) (1)该反应的平衡常数表达式K=____________。已知平衡常数:K(800℃)>K(850℃),则正反应是__________反应(填“放热”或“吸热”) (2)任写两种能提高二氧化硅转化率的措施________________、_________________。 (3)一定温度下,在2 L密闭容器内,充入一定量的反应物,5分钟时达到平衡,测得容器内气体增加了0.4 mol,用CO表示该反应时间内的反应速率为_________________。 (4)环境中常见的重金属污染物有汞、铅、锰、铬、镉。处理工业废水中含有的Cr2O和CrO常用的方法是还原沉淀法,该法的工艺流程为CrOCr2OCr3+Cr(OH)3。 其中第①步存在平衡:2CrO(黄色)+2H+Cr2O(橙色)+H2O。 关于第①步反应,下列说法正确的是________(填序号)。 A.通过测定溶液的pH可以判断反应是否已达到平衡状态 B.该反应为氧化还原反应 C.在强酸性环境下,溶液的颜色为橙色 (5)第③步反应除生成Cr(OH)3沉淀外,还可能生成的沉淀为________。 18.(12分)“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5 5CO2+I2。其实验步骤如下: ①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应; ②用水—乙醇液充分溶解产物I2,配制100 mL溶液; ③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。(已知淀粉溶液遇I2变蓝色) 第一次 第二次 第三次 滴定前读数/mL 2.10 2.50 1.40 滴定后读数/mL 22.00 22.50 21.50 (1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。 (2)Na2S2O3标准液应装在________滴定管中。 (3)判断达到滴定终点的现象是______________________________________________________。 (4)气体样品中CO的体积分数为________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2===2NaI+Na2S4O6)。 (5)下列操作会造成所测CO的体积分数偏大的是________(填字母)。 a.滴定终点俯视读数b.锥形瓶用待测溶液润洗 c.滴定前有气泡,滴定后没有气泡d.配制100 mL待测溶液时,有少量溅出 19.为解决大气中CO2的含量增大的问题,某科学家提出把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,再转变为燃料甲醇的“绿色自由”构想,其部分技术流程如图: (1) 吸收池中主要反应的离子方程式为____________________________________________________。 (2) 合成塔中合成1mol CH3OH(g)的反应热是ΔH1,则该反应的热化学方程式为:____________________________________________________;工业上CO也可用于合成甲醇,已知: 2CO(g)+O2(g)=2CO2(g) ΔH2;2H2(g)+O2(g)=2H2O(g) ΔH3;则CO(g)+2H2(g)=CH3OH(g) ΔH4=____________________________(用ΔH1、ΔH2、ΔH3表示)。 (3) 一定温度下,向2L恒容密闭容器中加入1molCH3OH(g),发生反应CH3OH(g)CO(g)+2H2(g),CO的体积分数随时间的变化如图所示。 ①反应达到平衡状态的标志是_________________(填序号)。 A.气体的密度保持不变 B.气体的平均摩尔质量保持不变 C . 2v正(H2)=v逆(CO) D.c(CH3OH):c(CO):c(H2)=1:1:2的时候 E.气体的体积分数保持不变 ②在该温度下,此反应的化学平衡常数K=__________________,若在t1时刻再加入1mol CH3OH(g),在t2时刻重新达到平衡,则在t2时刻CO的体积分数____________0.25(填“>”、“<”或“=”)。 20.氮氧化物和碳氧化合物的综合治理是当前的重要课题之一。 已知:ⅰ.NO(g)+CO2(g)NO2(g)+CO(g) ΔH1=+234 kJ·mol-1 ⅱ.2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH2=-745 kJ·mol-1 (1)NO2(g)与CO(g)反应生成两种无毒气体的热化学方程式为______________。 (2)反应ⅰ的正反应的活化能E_____ΔH1(填“>”、“<”或“=”)。 (3)一定压强下,密闭容器中发生反应ⅰ和反应ⅱ。达到平衡后,保持其他条件不变,升高温度,CO(g)的体积分数________(填“增大”、“减少”或“无法确定”),原因为__________________________________。 (4)向起始温度为t℃、容积为10 L的恒容绝热的密闭容器中充入2molNO(g)和1molCO2(g),发生反应ⅰ。5min时达到平衡。则: ①下列事实能说明该反应达到平衡状态的是________(填选项字母) A.混合气体温度不变 B.混合气体的压强不变 C.NO2和CO的浓度之比为1: 1 D.混合气体的平均相对分子质量不变 ②t℃时,向另一容积为10 L的恒温恒容的密闭容器中充入2 mol NO(g)和1 mol CO2(g),发生反应i。达到平衡的时间______5 min(填“>”、“<”或“=”)。 21.水体的酸碱性对人类生产生活影响深远,某兴趣小组进行下列不同的研究: (1)对PM 2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表(H+与OH-未列出): 离子 K+ Na+ NH4+ SO42- NO3- Cl- 浓度(mol/L) 4×10-6 6×10-6 2×10-5 4×10-5 3×10-5 2×10-5 根据表中数据判断PM 2.5试样的pH值=______________。 (2)某温度下,有等体积、等pH值的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系为_______________;将等浓度、等体积的Al2(SO4)3溶液分别加入足量的上述三种碱溶液中,产生沉淀物质的量分别为n1、n2、n3,则三者的大小关系为________________。 (3)常温下,已知酸的电离平衡常数:HClO (K=3.0×10-8) H2CO3(K1=4.4×10-7 K2=4.7×10-11),请写出足量CO2通入NaClO溶液中的离子反应方程式:______________________________。 (4)双氧水(H2O2)和水都是极弱电解质,但H2O2比水更显酸性。 ①若把H2O2看成是二元弱酸,请写出它在水中的主要电离方程式:_____________________________。 ②水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离方程式为:____________________________________________________。 永丰中学2019-2020学年第一学期高二期中考试 化学参考答案 一、单项选择题(共48分) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 D C B B A B B A C C B D C D D A 二、非选择题(共52分) 17(10分)(1) c(CO)6/c(N2)2(1分) 放热 (1分) (2) 补充 N2(1分)、 移去CO(1分) (2) 0.06mol/(L·min)(2分) (3) AC(2分) (4) Fe(OH)3(2分) 18(8分)(1)100 mL容量瓶(1分) (2)碱式 (1分) (3) 滴加最后一滴标准液,溶液由蓝色变为无色且半分钟内不恢复原色(2分) (4) 17.92%(2分) (5) b c(2分) 19(12分)(1)CO32-+CO2+H2O=2HCO3-(2分) (2) CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH1(2分) ΔH1+ΔH2-ΔH3(2分) (3) ①BE(2分) ②0.25mol2·L-2(2分) <(2分) 20(10分)(1)2NO2(g)+4CO(g)N2(g)+4CO2(g) ΔH=-1213 kJ·mol-1(2分) (2) >(1分) (3) 增大(1分)升高温度,反应i的平衡正向移动,反应ii的平衡逆向移动,均使CO体积分数增大(2分) (4) ①A B(2分) ②<(2分) 21(12分)(1)4(2分) (2) V1=V2查看更多