- 2021-08-24 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年福建省厦门市湖滨中学高二下学期期中考试化学试题 Word版
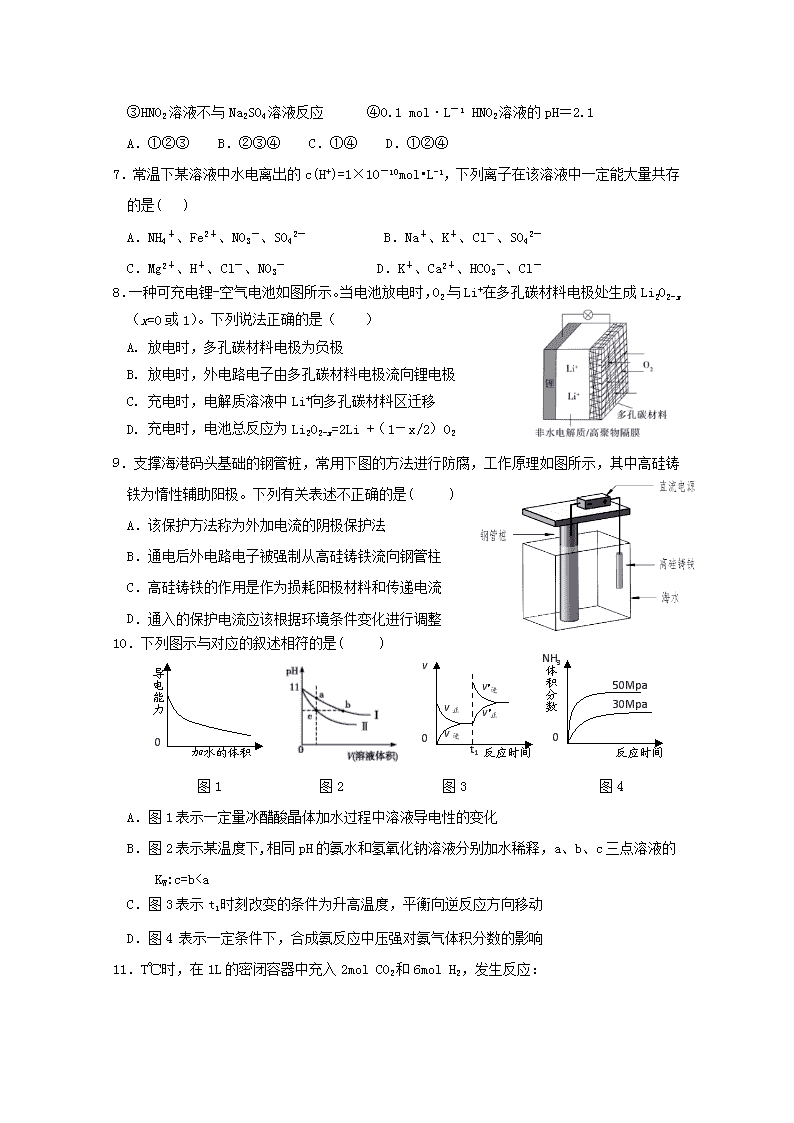
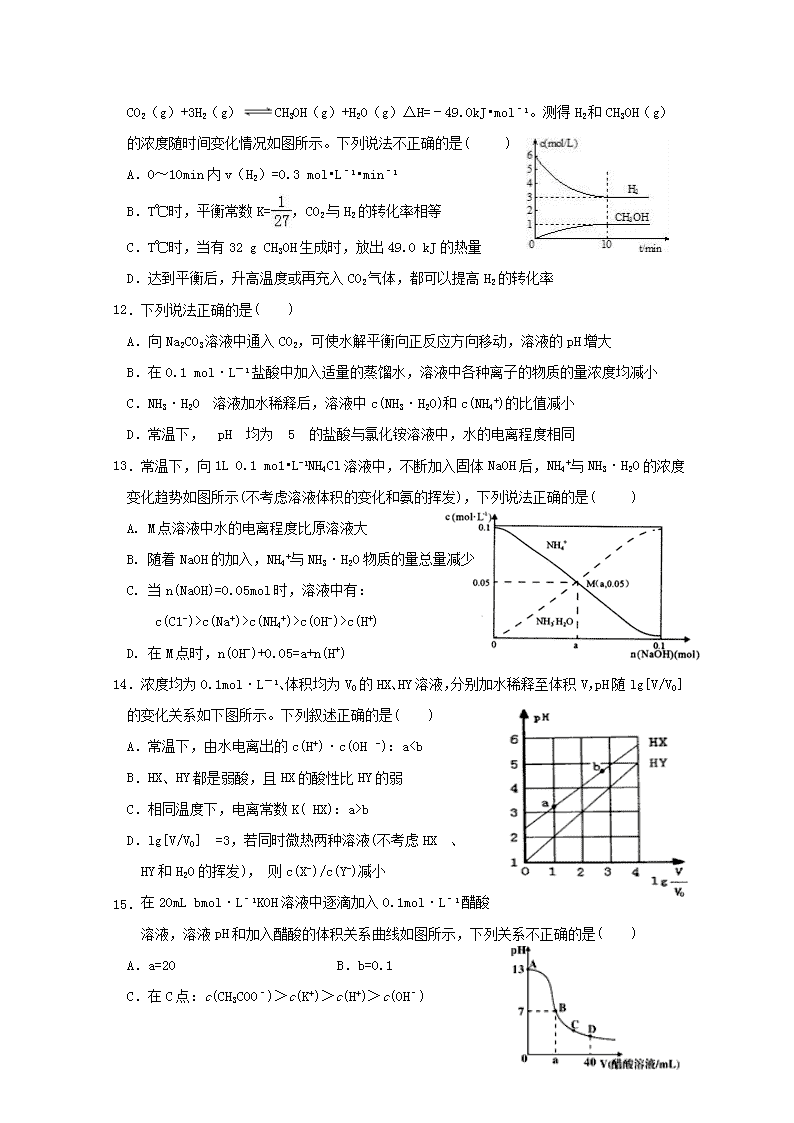
厦门市湖滨中学2018---2019学年第二学期期中考 高二化学试卷 可能用到的相对原子质量:C-12 H-1 O-16 N-14 Cu-64 Fe-56 一、单选题(共15题,每小题3分,共45分) 1.下列对生产、生活中的有关问题认识正确的是( ) A.用新能源代替化石燃料,可以减少雾霾天气的发生 B.采用催化转换技术提高汽车尾气中有害气体的转化率 C.明矾、活性炭、氯化铁等净水剂,使用时均利用了水解的原理 D.氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理 2.下列说法正确的是( ) A.碳燃烧的热化学方程式为C(s)+1/2O2(g)=CO(g) ΔH=+110.5 kJ·mol-1 B.镀锌铁皮发生电化学腐蚀时,负极反应式为:Zn-2e–= Zn2+ C.NaHS水解的离子方程式是:HS﹣+H2OS2﹣+H3O+ D.溶液中碳酸的电离方程式为:H2CO32H++ CO32– 3.在CH3COOHH++CH3COO﹣的电离平衡中,要使电离平衡向左移动,应采取的措施是( ) A.加冰醋酸 B.加CH3COONa C.加水 D.加NaOH 4.设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.常温下,pH=1的盐酸中,含H+ 的数目为0.1NA B.含有1mol NH4Cl和少量NH3·H2O的中性溶液中,NH4+数目为NA C.密闭容器中,2 mol SO2与1 mol O2充分反应后生成SO3的分子数为2NA D.电解饱和食盐水,当阴极产生2.24L H2时,转移的电子数一定为0.2NA 5.下列说法中正确的是( ) A.盐酸的导电能力一定比醋酸的导电能力强 B.一定量的锌粒与足量稀硫酸反应,向反应混合液中加入醋酸钠固体,产生H2速率减小,H2体积减小 C.同温度下,0.1 mol·L-1氨水中NH的浓度比0.1 mol·L-1 NH4Cl溶液中NH的浓度小 D.将CuCl2溶液在蒸发皿中加热蒸干并灼烧可得到CuCl2固体 6.下列事实能说明亚硝酸是弱电解质的是( ) ①25 ℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗 ③HNO2溶液不与Na2SO4溶液反应 ④0.1 mol·L-1 HNO2溶液的pH=2.1 A.①②③ B.②③④ C.①④ D.①②④ 7.常温下某溶液中水电离出的c(H+)=1×10-10 mol•L-1,下列离子在该溶液中一定能大量共存的是( ) A.NH4+、Fe2+、NO3-、SO42- B.Na+、K+、Cl-、SO42- C.Mg2+、H+、Cl-、NO3- D.K+、Ca2+、HCO3-、Cl- 8.一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( ) A. 放电时,多孔碳材料电极为负极 B. 放电时,外电路电子由多孔碳材料电极流向锂电极 C. 充电时,电解质溶液中Li+向多孔碳材料区迁移 D. 充电时,电池总反应为Li2O2-x=2Li +(1-x/2)O2 9.支撑海港码头基础的钢管桩,常用下图的方法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( ) A.该保护方法称为外加电流的阴极保护法 B.通电后外电路电子被强制从高硅铸铁流向钢管柱 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 10.反应时间 0 v v正 v正 v逆 ’ v逆 ’ t1 体积分数 0 反应时间 30Mpa 50Mpa NH3 下列图示与对应的叙述相符的是( ) 导电能力 0 加水的体积 图1 图2 图3 图4 A.图1表示一定量冰醋酸晶体加水过程中溶液导电性的变化 B.图2表示某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,a、b、c三点溶液的KW:c=bc(Na+)>c(NH4+)>c(OH-)>c(H+) D. 在M点时,n(OH-)+0.05=a+n(H+) 14. 浓度均为0.1mol·L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg[V/V0] 的变化关系如下图所示。下列叙述正确的是( ) A.常温下,由水电离出的c(H+)·c(OH -):ab D.lg[V/V0] =3,若同时微热两种溶液(不考虑HX 、 HY和H2O的挥发), 则c(X-)/c(Y-)减小 15. 在20mL bmol·L﹣1KOH溶液中逐滴加入0.1mol·L﹣1醋酸 溶液,溶液pH和加入醋酸的体积关系曲线如图所示,下列关系不正确的是( ) A.a=20 B.b=0.1 C.在C点:c(CH3COO﹣)>c(K+)>c(H+)>c(OH﹣) D.在D点:c(CH3COO﹣)+c(CH3COOH)=2c(K+) 二、填空题(共5题,55分) 16.(10分)电化学应用广泛。请回答下列问题: (1)自发进行的氧化还原反应可以设计成原电池。若电池放电时的反应式为:2Cu+2H2SO4+O2= 2CuSO4+2H2O,该电池的负极材料为_________;正极的电极反应式为____________ 。 (2)燃料电池和二次电池的应用非常广泛。 ①如图为甲烷燃料电池的示意图, 则负极的电极反应式为 ; ②铅蓄电池为生活中常用的二次电池。放电时的反应为: PbO2 + Pb+ 2H2SO4 === 2PbSO4 + 2H2O,铅蓄电池负极的电极反应式为 ;充电时,铅蓄电池的PbO2极应与外加直流电源的_____极相连。 (3)以铅蓄电池为电源精炼粗铜(含Fe、Pb、Ag、Au及其他不反应物质)时,以硫酸铜溶液为电解质溶液,粗铜做_____极;精炼一段时间后,当阴极增重128 g时,铅蓄电池参加反应的硫酸的物质的量为______mol。 17.(16分)I:电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃): 化学式 电离平衡常数 HCN K=4.9×10-10 CH3COOH K=1.8×10-5 H2CO3 K1=4.4×10-7,K2=4.7×10-11 (1)25 ℃时,等浓度的三种溶液【A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液】的pH由大到小的顺序为__________________ (填写序号) (2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的离子方程式为 ; (3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 (填标号)。 A.c(H+)>c(OH-) B.c(H+)查看更多