- 2021-08-24 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江西省新干县第二中学2018-2019学年高二上学期(尖子班)第一次段考化学试题 Word版缺答案
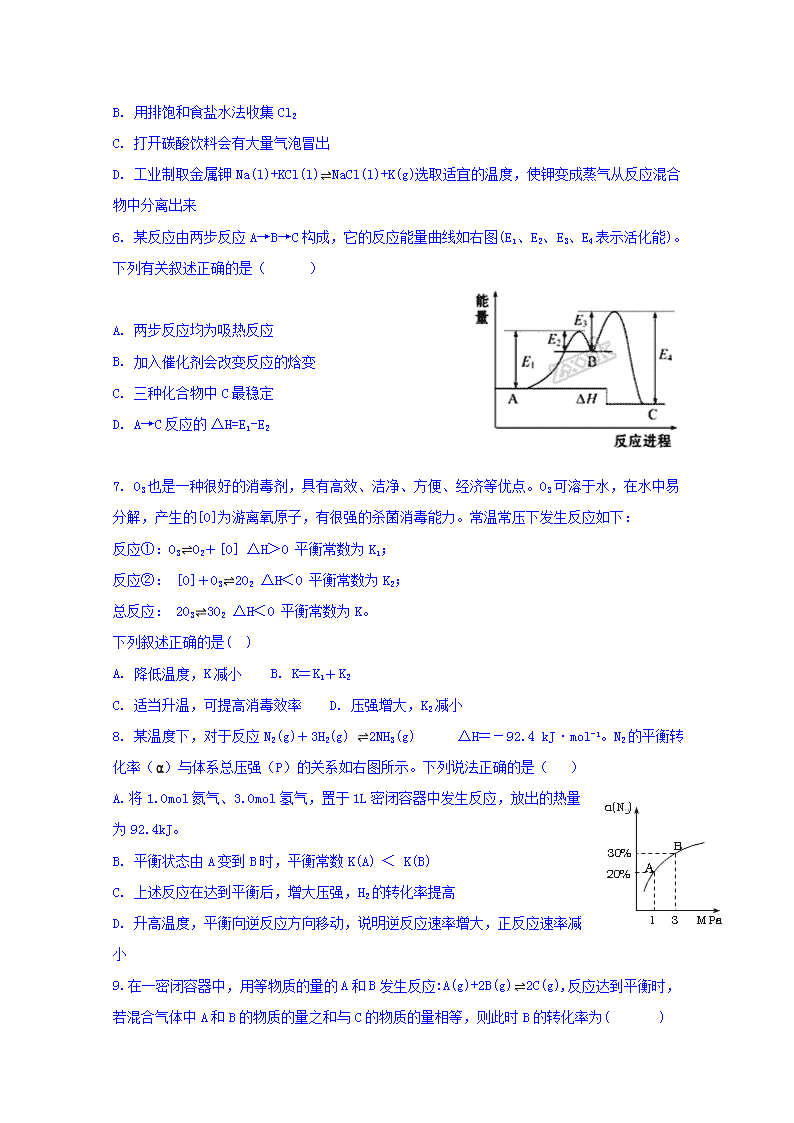
新干二中高二年级第一次月考化学(理尖)试卷 一、选择题(3×16=48分) 1. 下列说法中正确的是( ) A. 在化学反应过程中,发生物质变化的同时不一定发生能量变化 B. 破坏生成物全部化学健所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为吸热反应 C. 生成物的总焓大于反应物的总焓时,反应吸热,△H>0 D. △H的大小与热化学方程式的化学计量数无关 2. 根据以下三个热化学方程式: 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=Q1 kJ·mol-1 2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=Q2 kJ·mol-1 2H2S(g)+O2(g) =2S(s)+2H2O(g) △H=Q3 kJ·mol-1 判断Q1、Q2、Q3三者关系正确的是( ) A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3 3. 下列热化学方程式正确的是( ) A. 表示硫的燃烧热的热化学方程式S(s)+O2(g)=SO3(g);ΔH=-315 kJ·mol-1 B. 表示中和热的热化学方程式NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.3 kJ·mol-1 C. 表示H2燃烧热的热化学方程式H2(g)+O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1 D. 表示CO燃烧热的热化学方程式2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1 4. 下列有关说法不正确的是( ) A. Na与H2O的反应是熵增的放热反应,该反应能自发进行 B. 某吸热反应能自发进行,因此该反应一定是熵增反应 C. 通常情况下,一个放热且熵增的反应也有可能非自发进行 D. 反应NH3(g)+HCl(g)====NH4Cl(s)在室温下可自发进行,则该反应的ΔH <0 5. 下列事实不能用勒夏特列原理解释的是( ) A. 温度控制在500℃有利于合成氨反应 B. 用排饱和食盐水法收集Cl2 C. 打开碳酸饮料会有大量气泡冒出 D. 工业制取金属钾Na(l)+KCl(l)NaCl(l)+K(g)选取适宜的温度,使钾变成蒸气从反应混合物中分离出来 6. 某反应由两步反应A→B→C构成,它的反应能量曲线如右图(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是( ) A. 两步反应均为吸热反应 B. 加入催化剂会改变反应的焓变 C. 三种化合物中C最稳定 D. A→C反应的ΔH=E1-E2 7. O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下: 反应①:O3O2+[O] ΔH>0 平衡常数为K1; 反应②: [O]+O32O2 ΔH<0 平衡常数为K2; 总反应: 2O33O2 ΔH<0 平衡常数为K。 下列叙述正确的是( ) A. 降低温度,K减小 B. K=K1+K2 C. 适当升温,可提高消毒效率 D. 压强增大,K2减小 8. 某温度下,对于反应N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1。N2的平衡转化率()与体系总压强(P)的关系如右图所示。下列说法正确的是( ) A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ。 B. 平衡状态由A变到B时,平衡常数K(A) < K(B) C. 上述反应在达到平衡后,增大压强,H2的转化率提高 D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 9. 在一密闭容器中,用等物质的量的A和B发生反应: A(g)+2B(g) 2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则此时B的转化率为( ) A. 40% B. 50% C. 60% D. 80% 10. 某温度下,浓度都是1mol·L—1的两种气体X2和Y2,在密闭容器中反应生成气体Z,反应2 min后,测得参加反应的X2为0.6 mol·L—1,用Y2浓度变化表示的化学反应速率v(Y2)=0.1 mol·(L·min)—1,生成的c(Z)为0.4 mol·L—1,则该反应的反应式可以表示为( ) A. X2+2Y22XY2 B. 2X2+Y22X2Y C. 3X2+Y22X3Y D. X2+3Y22XY3 11. 某化学研究小组探究外界条件对化学反应mA(g)+nB(g) pC(g)的速率和平衡的影响图像如下,下列判断正确的是( ) A. 由图1可知,T1<T2,该反应正反应为吸热反应 B. 由图2可知,该反应m+n﹤p C. 图3中,表示反应速率v正>v逆的是点3 D. 图4中,若m+n=p,则a曲线一定使用了催化剂 12. 在一个温度恒定、容积固定的密闭容器中,发生可逆反应 mA(s)+nB(g) pC(g)+qD(g),已知n=p+q,且该反应为放热反应,反应达到平衡的标志是( ) ①体系的压强不再改变 ②气体的密度不再改变 ③各气体的浓度不再改变 ④各气体的质量分数不再改变 ⑤反应速率v(C)∶v(D)=p∶q ⑥单位时间内n mol B断键反应,同时p mol C也断键反应 A. ②③④⑥ B. ①②③④ C. ①②③④⑥ D. ④⑤⑥ 13. 把下列4种X的溶液分别加入4个盛有10m L 2 mol·L—1盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸缓慢地进行反应.其中反应速率最大的是( ) A. 20mL 3 mol·L—1的X溶液 B. 20mL 2 mol·L—1的X溶液 C. 10mL 4mol·L—1的X溶液 D. 10mL 2 mol·L—1的X溶液 14. 一定条件下,CO2与H2O可以合成甲醇,反应的方程式为CO2(g)+2H2O(g) CH3OH(g)+O2(g),表示该反应的反应过程中的能量变化正确的是( ) A B C D A. A B. B C. C D. D 15. 常温下1mol化学键分解成气态原子所需要的能量用E表示。根据表中信息判断下列说法错误的是( ) 共价键 H-H F-F H-F H-Cl H-I E(kJ•mol-1) 436 157 568 432 298 A. 298 kJ•mol-1查看更多
- 当前文档收益归属上传用户