- 2021-08-24 发布 |
- 37.5 KB |
- 45页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习晶体的类型与性质课件(45张)(全国通用)
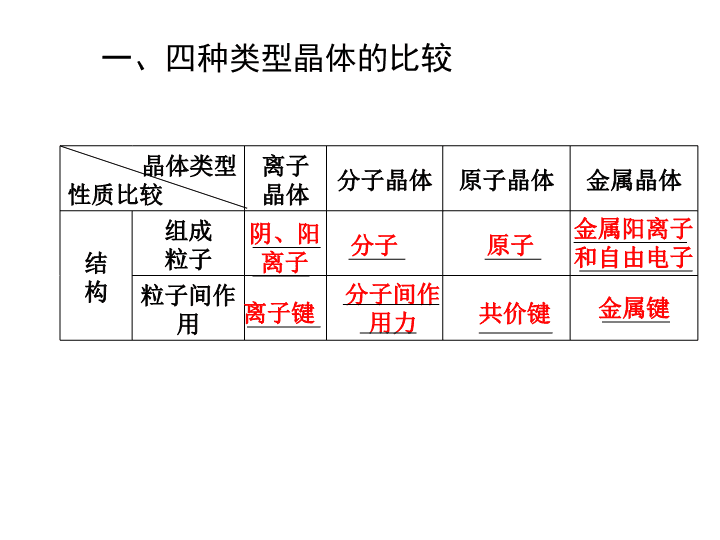
晶体的类型与性质 1 .判断晶体类型及比较熔沸点的高低。 2 .考查常见晶体的结构 (NaCl 、 CsCl 、金刚石 ) 及简单计算。 3 .提供信息判断晶体的类型,进而推知性质及结构的特点。 高考考纲 · 展示 一、四种类型晶体的比较 晶体类型 性质比较 离子晶体 分子晶体 原子晶体 金属晶体 结 构 组成 粒子 粒子间作用 阴、阳 离子 分子 原子 金属阳离子 和自由电子 离子键 分子间作 用力 共价键 金属键 晶体类型 性质比较 离子晶体 分子晶体 原子晶体 金属晶体 物 理 性 质 熔、 沸点 . . . 差别较大 硬度 . . . 有大有小、有 . 溶解性 易溶于 ,难溶于 . 极性分子易溶于极性溶剂 不溶于任何溶剂 难溶 ( 钠等与水反应 ) 导电性 不导电; 状态时导电 不良 . 良好 较高 低 很高 硬而脆 小 大 延展性 极性溶剂 非极性溶剂 晶体 熔融 不良 晶体类型 性质比较 离子晶体 分子晶体 原子晶体 金属晶体 曲型实例 NaCl 、 NaOH 、 Na 2 O 、 CaCO 3 干冰、白磷、冰、硫黄 金刚石、 SiO 2 、晶体硅、 SiC Na 、 Mg 、 Al 、 Fe 、 Cu 、 Zn 二、几种常见晶体的结构分析 1 .氯化钠 ( 离子晶体 ) 在氯化钠晶体中 (1) 与每个 Na + 等距紧邻的 Cl - 有 个。 (2) 与每个 Na + 等距紧邻的 Na + 有 个。 (3) 每个氯化钠晶胞中含有 个 Na + 和 个 Cl - 。 (4) 与每个 Na + 等距紧邻的 6 个 Cl - 围成的空间构型为 。 6 12 4 4 正八面体 2 .氯化铯 ( 离子晶体 ) 在氯化铯晶体中: (1) 与每个 Cs + 等距紧邻的 Cl - 有 个。 (2) 与每个 Cs + 等距紧邻的 Cs + 有 6 个。 (3) 每个氯化铯的晶胞中含有 个 Cs + 和 个 Cl - 。 8 8 8 3 .金刚石 ( 原子晶体 ) 在金刚石的晶体结构中: (1) 每个碳原子与周围的 个碳原子形成 ,条碳碳单键,这 5 个碳原子形成的是 结构。两条 C — C 键的夹角为 109°28′( 类似甲烷 ) 。 (2) 晶体中最小的环为六原子环,但碳原子不在同一平面上。 (3) 碳原子数∶碳碳键数= 1∶2 。 4 4 正四面体 4 .石墨 ( 原子晶体 ) (1) 石墨是一种混合型晶体,层内存在 ,层间以 结合。 (2) 在层内每个 C 原子通过共价单键与另 3 个 C 原子结合,构成 。 (3) 在石墨晶体中,碳原子数和碳碳共价键数之比为 。 共价键 分子间作用力 正六边形 2∶3 5 .干冰 ( 分子晶体 ) (1) 与每个 CO 2 分子相邻且等距的 CO 2 分子数为 个。 (2) 每个晶胞中含有 CO 2 的分子数为 个。 12 4 四 . 金属晶体 通过金属键形成的晶体,叫做 金属晶体 。 五、晶体熔、沸点高低的比较 1. 不同晶体类型物质的熔、沸点: 原子晶体>离子晶体>分子晶体 金属晶体熔沸点有高有低 2. 同种晶体类型的物质 ( 1 )原子晶体: 原子半径越小,键长越短,键能越大,共价键越牢固,晶体熔沸点越高 金刚石>水晶 (SiO 2 ) > SiC >晶体硅 ( 2 )离子晶体: 阴、阳离子电荷数越多,离子半径越小,离子键越强,晶体熔、沸点越高 MgO > MgCl 2 > NaCl > CsCl ( 3 )分子晶体: ①组成和结构相似的物质,相对分子质量越大,熔、沸点越高 ②组成和结构不相似的物质,相对分子质量相等时,极性大,则熔、沸点高(如 CO > N 2 ) ③有机物同分异构体中,支链越多,熔、沸点越低(如正戊烷>异戊烷>新戊烷) ④芳香烃及其衍生物的同分异构体中,熔、沸点规律为:邻位>间位>对位 ⑤组成和结构相似的有机物,一般含碳碳双键多的熔沸点低 〔 如硬酯酸甘油酯(脂肪)>油酸甘油酯(油) 〕 3 、金属键的强弱判断 (1) 金属的价电子数越多 , 离子所带的电荷越大 , 与自由电子间电性引力越大 , 金属键越强 . ( 2) 金属的离子半径 越小 , 与自由电子间电性引力越大 , 金属键越强 . ( 4 )金属晶体: 金属原子半径越小,阳离子所带电荷越多,金属键越强,晶体熔、沸点越高 Al > Mg > Na > K 六、四种晶体对比 晶体类型 离子晶体 原子晶体 分子晶体 金属晶体 构成微粒 阳阴离子 原子 分子 金属离子和自由电子 微粒间 作用力 肯定有离子键可能有共价键 共价键 分子间:范德瓦耳斯力 分子内:共价键 金属键 是否有 分子存在 只有气态时,存在单个分子固态、液态时,只有化学式 无分子、是巨大网状结构 有分子 无 导电性 熔化时或水溶液 导电 无或差 熔化不导电 导电 熔化时键 的变化 断开离子键、共价键不一定断 断键 不断键 减弱 物质种类 大多数盐、强碱、活泼金属氧化物 金刚石、 Si 、 SiO 2 、 SiC 、 B 气体、多数非金属单质 . 酸 . 多数有机物 金属 七、晶胞的计算方法(均摊法) 一个晶胞中各粒子占有 顶点的 1/8 棱中点的 1/4 面心的 1/2 体心的 1 物质 晶胞粒子数 配位数 其它特征粒子数 NaCl 4 个 Na + ,4 个 Cl - 6 每个 Na + ( Cl - )周围与它最接近等距的 Na + ( Cl - )有 12 个 CsCl 1 个 Cs + ,1 个 Cl - 8 每个 Cs + ( Cl - )周围与它最接近等距的 Cs + ( Cl - )有 6 个 金刚石 8 个 C 4 最小的环为 6 元环,每个 C 原子为 12 个六元环共有,每个 C - C 键共有 6 个六元环 , 石墨 4 个 C 3 每个六边形占有 2 个碳原子 石英 SiO 2 8 个 Si , 16 个 O 4 , 2 最小环有 12 个原子 干冰 CO 2 4 个 CO 2 12 等距相邻有 12 个 CO 2 分子 八、晶体里的粒子数 氯化钠的结构 ρ= m V n • M V 晶胞中粒子数 ×M a 3 ×N A = = 九、晶体密度的计算方法 ρ= m V n • M V 4×M(NaCl) a 3 ×N A = = ρ= m V n • M V 1×M(CsCl) a 3 ×N A = = NaCl CsCl a 代表晶胞的边长 1 下列说法中正确的是 ( ) A .离子晶体中每个离子周围均吸引着 6 个带相反电荷的离子 B .金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动 C .分子晶体的熔、沸点很低,常温下都呈液态或气态 D .原子晶体中的各相邻原子都以共价键相结合 解析: 离子晶体的结构不同,每个离子周围吸引的带相反电荷的离子的数目不同, A 项错误;金属是由金属阳离子和自由电子构成的,但自由电子并不是在外加电场的作用下才产生的, B 项错误;分子晶体在常温下也有呈固态的, C 项错误;组成原子晶体的元素是非金属元素,非金属元素间以共价键结合, D 项正确。 答案: D 2 .各类晶体中,是否原子晶体的熔点最高,分子晶体的熔点最低? 答案: 不一定,这只是一般结论,原子晶体的熔、沸点也有低于离子晶体或金属晶体的,而分子晶体的熔、沸点也有高于金属晶体的。 一、晶体类型的判断 1 . 依据组成晶体的粒子和粒子间的作用力判断 (1) 若粒子是阴、阳离子,粒子间的作用力是离子键,则该晶体是离子晶体。 (2) 若粒子是原子,粒子间的作用力是共价键,则该晶体是原子晶体。 (3) 若粒子是分子,粒子间的作用力是分子间作用力,则该晶体是分子晶体。 (4) 若粒子是金属阳离子和自由电子,粒子间的作用力是金属键,则该晶体是金属晶体。 方法规律 · 归纳 2 .依据物质的类别判断 (1) 金属氧化物,强碱、绝大多数的盐类是离子晶体。 (2) 大多数非金属单质、气态氢化物、非金属氧化物 ( 除 SiO 2 外 ) 、酸、绝大多数有机物 ( 除有机盐外 ) 是分子晶体。 (3) 金刚石、晶体硅、碳化硅 (SiC) 、二氧化碳等是原子晶体。 (4) 金属单质与合金是金属晶体。 3 .依据晶体的熔点判断 (1) 离子晶体的熔点较高,常在几百至 1000 余度。 (2) 原子晶体的熔点高,常在 1000 至几千度。 (3) 分子晶体的熔点低,常在几百度以下甚至很低温度。 (4) 多数金属晶体的熔点高,部分较低。 4 .依据导电性判断 (1) 离子晶体溶于水及熔融状态时能导电。 (2) 原子晶体一般为非导体。 (3) 分子晶体为非导体。 (4) 金属晶体是电的良导体。 5 . 依据硬度和机械性能判断 (1) 离子晶体硬度较大或略硬而脆。 (2) 原子晶体硬度大。 (3) 分子晶体硬度小且较脆 (4) 金属晶体多数硬度大,但有的较小,且绝大多数有较好的延展性。 二、晶体熔、沸点的比较 1 . 不同类型晶体的熔沸点高低的规律 一般为:原子晶体>离子晶体>分子晶体。金属晶体的熔沸点有的很高 ( 如钨 ) ,有的很低 ( 如汞 ) 。 2 . 同种类型晶体的熔沸点高低的规律 (1) 原子晶体 一般原子半径越小,熔沸点越高。例如:金刚石 (C — C) >二氧化硅 (Si — O) >碳化硅 (Si — C) >晶体硅 (Si — Si) 。 (2) 离子晶体 离子所带电荷越高,离子半径越小,则离子键越强,熔沸点越高,例如: Al 2 O 3 > MgO > NaCl > CsCl 。 (3) 金属晶体 金属阳离子所带电荷越多,半径越小,金属键越强,熔沸点越高。例如:第 3 周期的金属单质熔点: Al > Mg > Na ,再如:元素周期表中第 ⅠA 族的金属单质熔点: Li > Na > K > Rb > Cs 。 (4) 分子晶体 分子间作用力越强,熔沸点越高。 ①组成和结构相似的分子晶体,一般相对分子质量越大,分子间作用力越强,熔沸点越高,例如:元素周期表中第 ⅦA 族的元素单质其熔沸点变化规律为: I 2 > Br 2 > Cl 2 > F 2 。 ② 若分子间的氢键,则分子间作用力比结构相似的同类型晶体大,故熔沸点较高。例如,沸点: HF > HI > HBr > HCl 。 晶体中的几个不一定 (1) 离子晶体除含离子键外不一定不含其他化学键。如铵盐中除含离子键,还含极性键和配位键; Na 2 O 2 中除含离子键还含有非极性键。 (2) 离子晶体不一定含金属阳离子,如 NH 4 Cl 中含的阳离子是 NH ( 凡是铵盐,肯定同时含极性键、配位键和离子键 ) 。 (3) 离子晶体的熔点不一定低于原子晶体,如 MgO 的熔点高于 SiO 2 。 (4) 含有阳离子的晶体不一定是离子晶体,如金属晶体中就含有金属阳离子。 (5) 离子晶体中不一定不含分子,如 CuSO 4 · 5H 2 O 就含水分子 (CuSO 4 · 5H 2 O 是纯净物,是化学式而不是分子式,因为该晶体中不存在 CuSO 4 分子 ) 。 (6) 金属与非金属形成的化合物不一定都是离子化合物,如 AlCl 3 就是共价化合物。 (7) 具有金属光泽且能导电的单质不一定就是金属,如石墨具有金属光泽且能导电,却是非金属。 【 真题 1 】 有关晶体的下列说法中正确的是 ( ) A .晶体中分子间作用力越大,分子越稳定 B .原子晶体中共价键越强,熔点越高 C .冰融化时分子中共价键发生断裂 D .氯化钠熔化时离子键未被破坏 [ 分析 ] 本题主要考查对晶体类型与化学键类型的关系的理解。分子的稳定性强弱,只与分子内所含化学键的强弱有关,化学键越强,含该键的分子就越稳定而与分子间作用力无关, A 不正确;原子晶体是相邻原子间以共价键结合而成的空间网状结构的晶体, 共价键越强,熔点越高, B 正确;冰是由水分子形成的分子晶体,融化时被坏的是分子间作用力, C 不正确;氯化钠是由 Na + 和 Cl - 构成的离子晶体,在熔化时离子间距离发生了变化,离子键也发生了变化而被破坏, D 不正确。 [ 答案 ] B 【 真题 2 】 某离子晶体晶胞的结构如图所示。 X 用 · 表示,位于立方体顶点, Y 用 ° 表示,位于立方体中心。试分析: (1) 晶体中每个 Y 同时吸引着最近的 ________ 个 X ,每个 X 同时吸引着最近的 ________ 个 Y ,该晶体的化学式是 ________ 。 (2) 晶体中每个 X 周围与它最近且距离相等的 X 共有 ________ 个。 (3) 晶体中距离最近的 2 个 X 与一个 Y 形成的夹角∠ XYX 度数是 ________ 。 [ 分析 ] (1) 从图中可知, Y 位于正方体的中心, X 位于正方体的 4 个顶点,故 1 个 Y 同时吸引着最近的 X 有 4 个,每个 X 同时吸引着最近的 8 个 Y ,由此确定其化学式。 (2) 由于顶点 X 是 8 个正方体共有,每个面是 2 个立方体共享,故晶体中每个 X 周围与它最近且距离相等的 X 应有 8 ×3 × = 12( 个 ) 。 (3) 可将图中 4 个 X 分别与 Y 连线,形成的构型类同于 CH 4 分子,∠ XYX = 109°28′ 。 [ 答案 ] (1)4 8 XY 2 或 Y 2 X (2)12 (3)109°28 ′ 1. ( 真题 1 对应练 ) 下列叙述中错误的是 ( ) A .在原子晶体中可能存在极性共价键 B .在离子晶体中可能存在非极性共价键 C .含有阳离子的晶体中,不一定含有阴离子 D .在分子晶体中一定含有共价键 解析: 对 A 项,原子晶体 SiO 2 中 Si — O 键为极性键,金刚石中 C — C 键为非极性键;对 B 项,离子晶体 Na 2 O 2 中 O — O 键为非极性键;对 C 项,金属晶体中只有阳离子,无阴离子;对 D 项,分子晶体氖是单原子分子,不存在共价键。 答案: D 2 . 下列各组物质的晶体中,化学键类型相同、晶体类型、物质发生状态变化所克服的粒子间的相互作用也相同的是 ( ) A . SO 3 和 HCl B . KCl 和 Mg C . NaCl 和 H 2 O D . CCl 4 和 SiO 2 解析: 本题考查粒子间的作用力及晶体类型, CCl 4 、 HCl 、 H 2 O 、 SO 3 是分子晶体,发生状态变化需要克服分子间作用力, H 2 O 还需要克服氢键; SiO 2 是原子晶体,发生状态变化克服共价键; NaCl 、 KCl 是离子晶体,发生状态变化克服离子键, Mg 是金属晶体,发生状态变化克服金属键。 答案: A 3 .表中给出了几种化合物的熔点和沸点: 以下关于表中所列四种物质的说法中正确的是 ( ) ① 丙加热时升华;②丁属于分子晶体;③丙是典型的离子晶体;④乙熔化时,只破坏分子间作用力 A .①②④ B .①② C .③④ D .①②③④ 数据 甲 乙 丙 丁 熔点 ( ℃ ) 801 712 190 - 68 沸点 ( ℃ ) 1465 1418 180 57 解析: 根据数据表知,丙、丁熔沸点低,是分子晶体,而甲、乙是离子晶体, 丙的熔点高于沸点,所以,加热丙时发生升华现象。乙熔化时电离出阴、阳离子。 答案: B 4 .下图是从 NaCl 或 CsCl 晶体结构图中分割出来的部分结构图,其中属于从 NaCl 晶体中分割出来的结构图是 ( ) A .图①和图③ B .图②和图③ C .图①和图④ D .只有图④ 解析: 根据 NaCl 的晶体结构,在每个 Na + 周围最近的等距离的 Cl - 有 6 个 ( 上、下、左、右、前、后 ) ,故①是;从 NaCl 晶胞中分割 1/8 可得图④的结构。 答案: C 5 .现有四种晶体,其离子排列方式如图所示,其中化学式不属于 AB 型的是 ( ) 答案: B查看更多