- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年宁夏长庆高级中学高二上学期期末考试化学试题 Word版
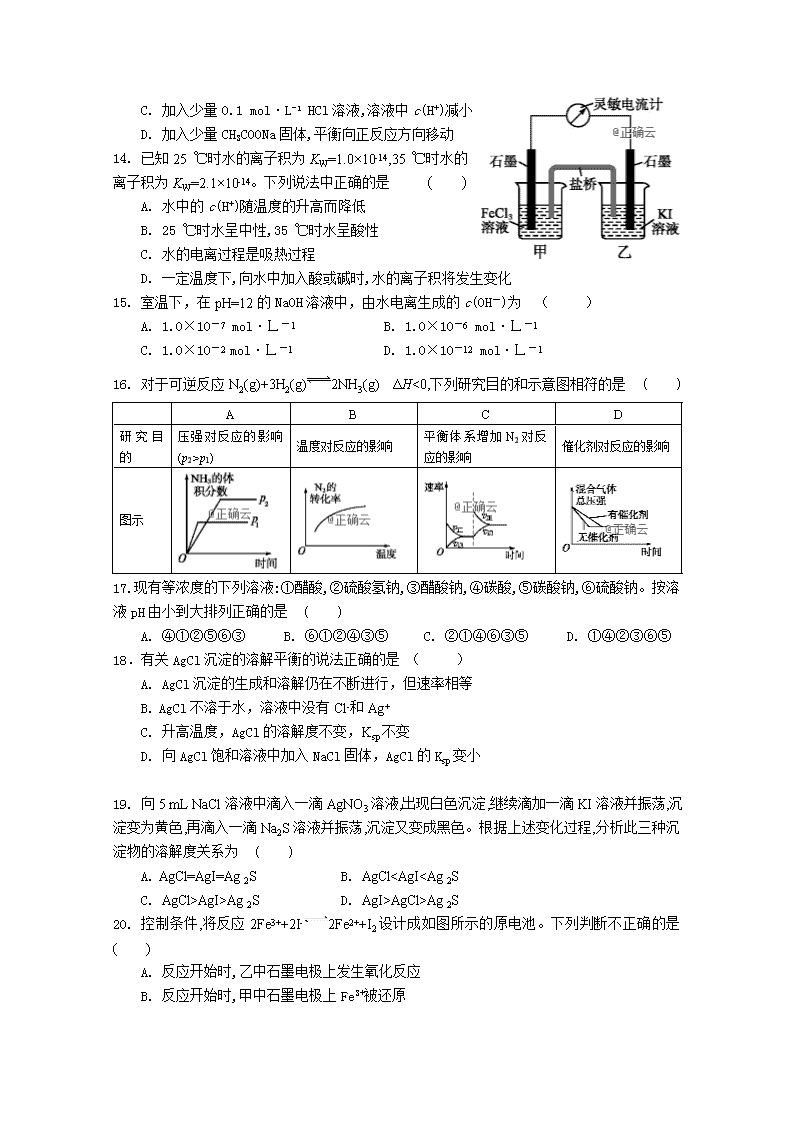
宁夏长庆高级中学2018—2019学年第一学期 高二化学期末试卷 满分:100分,考试时间:100分钟 命题人:马 俭 可能用到的相对原子质量 H-1 C-12 O-16 Na-23 Cu-64 一、选择题(在下列四个选项中,只有一个选项是符合题意,每小题2分,共50分) 1.下列说法正确的是 ( ) A. 原电池是把电能转化为化学能的装置 B. 原电池中电子流出的一极是正极,发生氧化反应 C. 原电池的两极发生的反应均为氧化还原反应 D. 形成原电池后,原电池中的阳离子向正极移动 2.下列叙述正确的是 ( ) A. 强电解质只能在水溶液里完全电离 B. 固体氯化钠不导电,氯化钠是非电解质 C. CO2的水溶液能导电,但CO2是非电解质 D. 氯水能导电,所以Cl2是电解质 3. 准确量取25.00ml 高锰酸钾溶液,可选用的仪器是 ( ) A. 25ml酸式滴定管 B. 有刻度的50ml烧杯 C. 25ml碱式滴定管 D. 25ml量筒 4. 钢铁发生吸氧腐蚀时,正极上发生的电极反应是 ( ) A. 2H++2e-=H2 B. Fe2++2e-=Fe C. 2H2O+O2+4e-=4OH- D. Fe3++e-=Fe2+ 5. 如图所示装置,电流计G发生偏转,同时A极逐渐变粗、B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的 ( ) A. A是Zn, B是Cu, C为稀硫酸 B. A是Cu, B是Zn, C为稀硫酸 C. A是Fe, B是Ag, C为AgNO3溶液 D. A是Ag, B是Fe, C为AgNO3溶液 6.下列有关反应:4NH3 (g)+5O2 (g) === 4NO(g)+6H2O(g) △H= -905 kJ·mol-1 的描述不正确的是 ( ) A. 该反应为放热反应 B. 该反应中每4 mol NH3(g)被氧化,放出905 kJ热量 C. 生成物的总能量小于反应物的总能量 D. 生成物的总键能小于反应物的总键能 7.下列关于热化学反应的描述中正确的是 ( ) A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1, 则H2SO4和Ca(OH)2反应的中和热 ΔH=2×(-57.3) kJ·mol-1 B.CO(g)的燃烧热是283 kJ/mol,则2CO(g)+O2(g) ==2CO2(g)反应的ΔH=-566 kJ·mol-1 C.需要加热才能发生的反应一定是吸热反应 D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 8. 已知在250C时下述反应的有关数据: C(s)+1/2 O2(g) = CO(g) △H1 = -110.5 kJ• mol-1 C(s)+O2(g) = CO2(g) △H2= -393.5 kJ• mol-1 则C(s)+CO2(g) = 2CO(g) 的△H 为 ( ) A. +283.5 kJ• mol-1 B. +172.5 kJ• mol-1 C. -172.5 kJ• mol-1 D. -504 kJ• mol-1 9. 一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2OCH3COOH+4H+。下列有关说法正确的是 ( ) A. 电池反应的化学方程式为CH3CH2OH+O2CH3COOH+H2O B. 若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 C. 检测时,电解质溶液中的H+向负极移动 D. 正极上发生的反应为O2+4e-+2H2O4OH- 10.化学反应C(s)+H2O(g) CO(g)+H2(g) △H>0 达到平衡,下列叙述正确的是 ( ) A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 B.加入固体炭,平衡向正反应方向移动 C.加入水蒸气,平衡向逆反应方向移动 D.扩大容器的容积,平衡向正反应方向移动 11. 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是 ( ) A. Ⅱ为盐酸稀释时的pH变化曲线 B. b点溶液的导电性比c点溶液的导电性强 C. a点KW的数值比c点KW的数值大 D. b点H+的浓度大于a点H+的浓度 12. 25℃时,将稀氨水逐滴加入到稀盐酸中,当溶液的pH=7时,下列关系正确的是 ( ) A. c(NH4+) = c(Cl-) B. c(NH4+)=2c(Cl-) C. 2c(NH4+)=c(Cl-) D. c(OH-)+c(Cl-) = c(H+) 13. 在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+。对于该平衡,下列叙述正确的是 ( ) A. 加入水时,平衡向逆反应方向移动 B. 加入少量NaOH固体,平衡向正反应方向移动 C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 D. 加入少量CH3COONa固体,平衡向正反应方向移动 14. 已知25 ℃时水的离子积为KW=1.0×10-14,35 ℃时水的离子积为KW=2.1×10-14。下列说法中正确的是 ( ) A. 水中的c(H+)随温度的升高而降低 B. 25 ℃时水呈中性,35 ℃时水呈酸性 C. 水的电离过程是吸热过程 D. 一定温度下,向水中加入酸或碱时,水的离子积将发生变化 15. 室温下,在pH=12的NaOH溶液中,由水电离生成的c(OH-)为 ( ) A. 1.0×10-7 mol·L-1 B. 1.0×10-6 mol·L-1 C. 1.0×10-2 mol·L-1 D. 1.0×10-12 mol·L-1 16. 对于可逆反应N2(g)+3H2(g)2NH3(g) ΔH<0,下列研究目的和示意图相符的是 ( ) A B C D 研究目的 压强对反应的影响(p2>p1) 温度对反应的影响 平衡体系增加N2对反应的影响 催化剂对反应的影响 图示 17. 现有等浓度的下列溶液:①醋酸,②硫酸氢钠,③醋酸钠,④碳酸,⑤碳酸钠,⑥硫酸钠。按溶液pH由小到大排列正确的是 ( ) A. ④①②⑤⑥③ B. ⑥①②④③⑤ C. ②①④⑥③⑤ D. ①④②③⑥⑤ 18.有关AgCl沉淀的溶解平衡的说法正确的是 ( ) A. AgCl沉淀的生成和溶解仍在不断进行,但速率相等 B. AgCl不溶于水,溶液中没有Cl-和Ag+ C. 升高温度,AgCl的溶解度不变,Ksp不变 D. 向AgCl饱和溶液中加入NaCl固体,AgCl的Ksp变小 19. 向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色。根据上述变化过程,分析此三种沉淀物的溶解度关系为 ( ) A. AgCl=AgI=Ag2S B. AgCl查看更多