2018届二轮复习水溶液中的离子平衡学案(全国通用)(2)
第10讲 水溶液中的离子平衡
[最新考纲]
1.了解电解质的概念,了解强电解质和弱电解质的概念。2.理解电解质在水中的电离以及电解质溶液的导电性。3.理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算。4.了解水的电离、离子积常数。5.了解溶液pH的含义及其测定方法,能进行pH的简单计算。6.了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。7.了解难溶电解质的沉淀溶解平衡。理解溶度积(Ksp)的含义,能进行相关的计算。
水及其它弱电解质的电离
1.[2017·课标全国Ⅰ,28(1)]下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是________(填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
解析 H2SO3能和NaHCO3反应放出CO2,说明酸性:H2SO3>H2CO3,而H2S不能和NaHCO3反应,说明酸性:H2S
c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
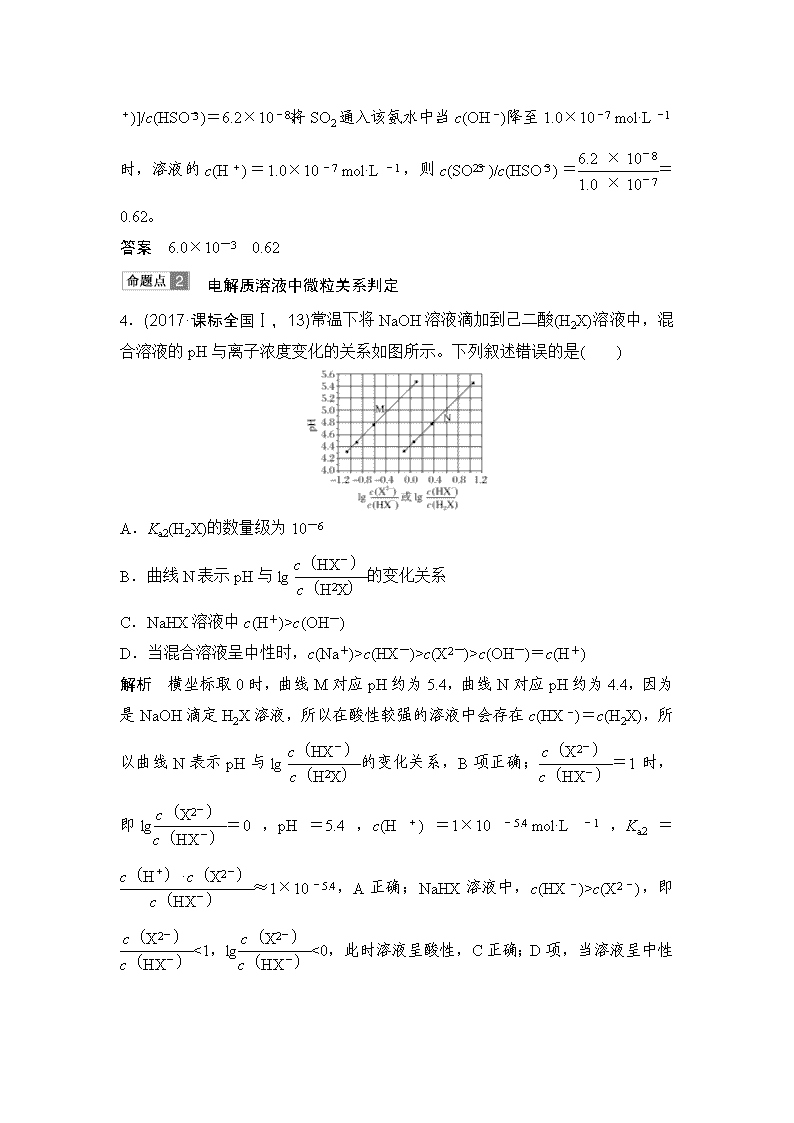
解析 横坐标取0时,曲线M对应pH约为5.4,曲线N对应pH约为4.4,因为是NaOH滴定H2X溶液,所以在酸性较强的溶液中会存在c(HX-)=c(H2X),所以曲线N表示pH与lg的变化关系,B项正确;=1时,即lg=0,pH=5.4,c(H+)=1×10-5.4 mol·L-1,Ka2=≈1×10-5.4,A正确;NaHX溶液中,c(HX-)>c(X2-),即<1,lg<0,此时溶液呈酸性,C正确;D项,当溶液呈中性时,由曲线M可知lg>0,>1,即c(X2-)>c(HX-),错误。
答案 D
5.(2017·课标全国Ⅱ,12)改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=]。
下列叙述错误的是( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
解析 A项,根据图像,pH=1.2时,H2A和HA-物质的量分数图像相交,则有c(H2A)=c(HA-),正确;B项,根据pH=4.2点,K2(H2A)=c(H+)·c(A2-)/c(HA-)=c(H+)=10-4.2 mol·L-1,正确;C项,根据图像,pH=2.7时,H2A和A2-物质的量分数图像相交,则有c(H2A)=c(A2-),正确;D项,根据pH=4.2时,c(HA-)=c(A2-),且物质的量分数约为0.48,而c(H+)=10-4.2 mol·L-1,可知c(HA-)=c(A2-)>c(H+),错误。
答案 D
6.(2016·课标全国Ⅰ,12)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
解析 A项,盐酸滴定氨水时,滴定终点溶液为NH4Cl溶液,呈酸性,故指示剂应选甲基橙,错误;B项,一水合氨属于弱碱,与盐酸正好反应生成NH4
Cl时溶液呈酸性,故二者等浓度反应时,若溶液的pH=7,盐酸的体积应小于氨水的体积,即小于20.0 mL,错误;C项,根据电荷守恒可知溶液中:c(NH)+c(H+)=c(Cl-)+c(OH-),M点溶液的pH=7,即c(H+)=c(OH-),则c(NH)=c(Cl-),由于水的电离是微弱的,故c(NH)=c(Cl-)>c(H+)=c(OH-),错误;D项,由图可知,N点即为0.10 mol·L-1氨水,由其电离度为1.32%,可知0.10 mol·L-1氨水中c(OH-)=0.001 32 mol·L-1,故该氨水中111
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不变
解析 A项,=,加水稀释,c(CH3COO―)减小,Ka不变,所以比值增大,错误;B项,=(Kh为水解常数),温度升高水解常数Kh增大,比值减小,错误;C项,向盐酸中加入氨水至中性,根据电荷守恒:c(NH)+c(H+)=c(Cl―)+c(OH―),此时c(H+)=c(OH―),故c(NH)=c(Cl―),所以=1,错误;D项,在饱和溶液中=,温度不变溶度积Ksp不变,则溶液中不变,正确。
答案 D
Ksp的理解与应用
8.(2017·课标全国Ⅲ,13)在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
A.Ksp(CuCl)的数量级为10-7
B.除Cl-反应为Cu+Cu2++2Cl-===2CuCl
C.加入Cu越多,Cu+浓度越高,除Cl-效果越好
D.2Cu+=== Cu2++Cu平衡常数很大,反应趋于完全
解析 A项,根据CuCl(s)Cu+(aq)+Cl-(aq)可知Ksp(CuCl)=c(Cu+)·c(Cl-),从Cu+图像中任取一点代入计算可得Ksp(CuCl)≈10-7,正确;B项,由题干中“可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-”可知Cu、Cu2+与Cl― 可以发生反应生成CuCl沉淀,正确;C项,Cu(s)+Cu2+(aq)2Cu+(aq),固体对平衡无影响,故增加固体Cu的物质的量,平衡不移动,Cu+的浓度不变,错误;D项,2Cu+(aq)Cu(s)+Cu2+(aq),反应的平衡常数K=,从图中两条曲线上任取横坐标相同的c(Cu2+)、c(Cu+)两点代入计算可得K≈106,反应平衡常数较大,反应趋于完全,正确。
答案 C
9.(2013·课标全国卷Ⅰ,11)已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO B.CrO、Br-、Cl-
C.Br-、Cl-、CrO D.Br-、CrO、Cl-
解析 要产生AgCl沉淀,c(Ag+)> mol·L-1=1.56×10-8 mol·L-1;
要产生AgBr沉淀,c(Ag+)> mol·L-1=7.7×10-11 mol·L-1;
要产生Ag2CrO4,需c2(Ag+)·c(CrO)>Ksp(Ag2CrO4)=9.0×10-12,
即c(Ag+)> mol·L-1=3.0×10-5 mol·L-1;
显然沉淀的顺序为Br-、Cl-、CrO。
答案 C
10.(1)[2016·课标全国Ⅰ,27(3)]在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)为________mol·L-1,此时溶液中c(CrO)等于________mol·L-1(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(2)[2015·课标全国Ⅰ,28(2)]上述浓缩液中主要含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中为________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)[2015·海南化学,15(2)]已知Ksp(AgCl)=1.8×10-10,若向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,混合后溶液中Ag+的浓度为________ mol·L-1,pH为________。
解析 (1)根据Ksp(AgCl)=c(Ag+)·c(Cl-)=2.0×10-10,可计算出当溶液中Cl-恰好完全沉淀(即浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)=2.0×10-5 mol·L-1,然后再根据Ksp(Ag2CrO4)=c2(Ag+)·c(CrO)=2.0×10-12,又可计算出此时溶液中c(CrO)=5×10-3 mol·L-1。(2)AgI的溶度积小于AgCl,当滴加AgNO3溶液时,AgI沉淀先生成,AgCl开始沉淀时,AgI已经沉淀完全,则===4.7×10-7。(3)根据反应中HCl和AgNO3的物质的量可知HCl过量,则剩余的氯离子的物质的量浓度为(0.02-0.018) mol/L/2=0.001 mol/L,根据AgCl的溶度积即可计算出c(Ag+);因为该反应中氢离子未参加反应,溶液的体积变为100 mL时,则氢离子的浓度为0.01
mol/L,则pH=2。
答案 (1)2.0×10-5 5×10-3 (2)4.7×10-7
(3)1.8×10-7 2
分析评价
题型:选择题 填空题
评析:从近几年考查情况来看,Ⅰ卷常借助图像考查对水的电离或弱电解质电离的理解;以及反应过程中电解质溶液中的微粒变化,Ⅱ卷常以Ksp运用为主,有时也涉及到Ka(Kb)的计算。
启示:二轮复习时,应特别重点关注酸、碱反应过程中微粒变化及有关Ksp、Ka(Kb)的计算。
高频考点一 电离平衡及溶液的酸碱性
[考点精要]
1.准确判断水电离的c(H+)或c(OH-)
(1)溶质为酸的溶液:
H+来源于酸和水的电离,而OH-只来源于水。如计算pH=2的盐酸中水电离出的c(H+):方法是先求出溶液中的c(OH-)=10-12 mol·L-1,即水电离出的c(H+)=c(OH-)=10-12 mol·L-1。
(2)溶质为碱的溶液:
OH-来源于碱和水的电离,而H+只来源于水。如pH=12的NaOH溶液中,c(H+)=10-12 mol·L-1,即水电离产生的c(OH-)=c(H+)=10-12 mol·L-1。
(3)水解呈酸性或碱性的正盐溶液:
H+和OH-均由水电离产生。
如pH=2的NH4Cl溶液中由水电离出的c(H+)=10-2 mol·L-1;
如pH=12的Na2CO3溶液中由水电离出的c(OH-)=10-2 mol·L-1。
2.溶液酸、碱性及pH判断的常见误区
误区一:不能正确理解酸、碱的无限稀释规律
常温下任何酸或碱溶液无限稀释时,溶液的pH都不可能大于7或小于7,只能接近7。
误区二:不能正确理解弱酸、弱碱的稀释规律
溶液
稀释前溶液pH
加水稀释到原来体积的10n倍
稀释后溶液pH
酸
强酸
pH=a
pH=a+n
弱酸
a<pH<a+n
碱
强碱
pH=b
pH=b-n
弱碱
b-n<pH<b
误区三:不能正确掌握混合溶液的定性规律
pH=n(n<7)的强酸和pH=14-n的强碱溶液等体积混合,pH=7;pH=n(n<7)的醋酸和pH=14-n的氢氧化钠溶液等体积混合,混合溶液pH<7;pH=n(n<7)的盐酸和pH=14-n的氨水等体积混合,混合溶液pH>7。
3.弱电解质的电离平衡的再认识
(1)溶液加水稀释:弱电解质溶液的浓度减小,电离程度增大;但在弱酸溶液中c(H+)减小,弱碱溶液中c(OH-)减小。
(2)加热:电离是吸热的,加热使电离平衡向右移动,溶液中弱电解质分子数减小,溶液中离子浓度增大。
(3)相同离子:当向弱电解质溶液中加入的物质含有与弱电解质相同的离子时,由于同种离子的相互影响,使电离平衡向左移动,弱电解质的电离程度减小。
(4)加入能反应的物质:当向弱电解质溶液中加入的物质能和弱电解质电离出的离子反应时,电离平衡向右移动,参加反应的离子浓度减小,其他的离子浓度增大。
[考法指导]
水的电离和溶液的酸碱性(难度系数☆☆)
【考法训练1】 已知T ℃时,水的离子积常数为Kw。该温度下,将等浓度的一元酸HA的溶液与一元碱BOH的溶液等体积混合,下列叙述正确的是( )
A.混合溶液的pH=7
B.若混合溶液中c(H+)= mol·L-1,则溶液呈中性
C.若混合溶液的pH=4,则水电离出的c(H+)=1.0×10-10 mol·L-1
D.若HA为强酸,则混合后溶液中各离子浓度的大小关系一定为:c(A-)>c(B+)>c(H+)>c(OH-)
解析 混合后得到BA溶液,由于HA、BOH的酸碱性强弱未知,故BA溶液可能为酸性,可能为中性,也可能为碱性,A项错误;若混合溶液中c(H+)= mol·L-1,则c(H+)=c(OH-),溶液呈中性,B项正确;若混合溶液的pH=4,则BA为强酸弱碱盐,B-水解促进水的电离,由水电离出的c(H+)=1.0×10-4 mol·L-1,C项错误;若HA为强酸,BOH为强碱,则混合后溶液中各离子浓度的大小关系为:c(A-)=c(B+)>c(H+)=c(OH-),D项错误。
答案 B
【考法训练2】 (2017·安徽合肥质检)常温下,下列有关电解质溶液的叙述中错误的是( )
A.某H2SO4溶液中=1.0×10-8,由水电离出的c水(H+)=1×10-11 mol·L-1
B.将0.02 mol·L-1盐酸与0.02 mol·L-1 Ba(OH)2溶液等体积混合后,溶液pH约为12
C.将一定体积稀盐酸与稀氨水混合,当溶质为NH3·H2O和NH4Cl时,溶液的pH≥7
D.向0.1 mol·L-1 Na2CO3溶液中逐滴滴加0.1 mol·L-1稀盐酸,溶液中c(HCO)先增大后减小
解析 A项,结合Kw进行计算,c(H+)=10-3 mol·L-1,则水电离的c水(H+)=c(OH-)=1×10-11 mol·L-1,正确;B项,等体积混合后c(OH-)= mol·L-1=0.01 mol·L-1,正确;D项,Na2CO3溶液中滴加稀盐酸,发生反应依次为:CO+H+===HCO、HCO+H+===CO2↑+H2O,故c(HCO)先增大后减小,正确;C项,氨水和稀盐酸混合,当溶质为NH3·H2O和NH4Cl时,因两者相对量的不同,溶液的pH可能大于7、可能等于7也可能小于7,错误。
答案 C
弱电解质及其电离平衡(难度系数☆☆☆)
【典例演示1】 浓度均为0.1 mol/L、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg的变化关系如图所示。下列叙述正确的是( )
A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常温下,由水电离出的c(H+)·c(OH-):a<b
C.相同温度下,电离常数K(HX):a>b
D.当lg=3时,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
eq f(c(X-),c(Y-))减小
解析 根据题图分析,当lg=0时,HX溶液的pH>1,说明HX部分电离,为弱电解质,HY溶液的pH=1,说明其完全电离,为强电解质,A错误;酸或碱抑制水的电离,酸中的氢离子浓度越小,其抑制水电离的程度越小,根据题图分析,b点溶液中氢离子浓度小于a点,则水的电离程度a<b,所以由水电离出的氢离子和氢氧根离子浓度的乘积a<b,B正确;酸的电离平衡常数只与温度有关,所以相同的温度下,电离常数a=b,C错误;当lg=3时,若同时微热两种溶液,X-的物质的量增多,Y-的物质的量不变,溶液的体积相等,所以比值变大,D错误。
答案 B
【考法训练3】 (2017·重庆十一中月考)已知等体积、浓度均为0.2 mol·L-1的三种溶液:
①HA溶液、②HB溶液、③NaHCO3溶液。将①、②分别与③混合,实验测得所产生的CO2气体体积[V(CO2)]随时间(t)的变化如图所示。下列说法不正确的是( )
A.酸性:HB>HA>H2CO3
B.反应结束后所得的两溶液中:c(A-)>c(B-)
C.上述三种溶液中由水电离出的c(OH-)的相对大小:NaHCO3>HA>HB
D.HA溶液和NaHCO3溶液反应所得的溶液中:c(A-)+c(HA)=0.1 mol·L-1
解析 HA溶液和HB溶液均能与NaHCO3溶液反应生成CO2,则HA、HB的酸性均强于H2CO3,根据题图,HB溶液与NaHCO3溶液反应生成CO2的速率比HA溶液与NaHCO3溶液反应生成CO2的速率快,故HB的酸性强于HA,A项正确;酸性:HB>HA,则A-比B-更易水解,故反应结束后所得的两溶液中:c(A-)<c(B-),B项错误;NaHCO3溶液由于HCO
水解促进水的电离,HA溶液、HB溶液由于电离抑制水的电离,且酸性:HB>HA,HB对水的电离的抑制程度更大,故上述三种溶液中由水电离出的c(OH-)的相对大小:NaHCO3>HA>HB,C项正确;根据物料守恒,HA溶液和NaHCO3溶液反应所得的溶液中c(A-)+c(HA)=0.1 mol·L-1,D项正确。
答案 B
【考法训练4】 (1)在一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L-1的醋酸与b mol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=________________(用含a和b的代数式表示)。
(2)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数值为____________(已知:N2H4+H+N2H的K=8.7×107;Kw=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为
___________________________________________________________________。
解析 (1)根据2c(Ba2+)+c(H+)=c(OH-)+c(CH3COO-)
由于c(CH3COO-)=2c(Ba2+)=b mol·L-1
所以c(H+)=c(OH-)
溶液呈中性
CH3COOHCH3COO-+H+
-b b 10-7
Ka==。
(2)联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离的方程式为N2H4+H2ON2H+OH-,再根据已知:N2H4+H+N2H的K=8.7×107及Kw=1.0×10-14,故联氨第一步电离平衡常数为K===×c(OH-)·c(H+)=8.7×107×1.0×10-14=8.7×10-7;联氨为二元弱碱,酸碱发生中和反应生成盐,则联氨与硫酸形成酸式盐的化学式为N2H6(HSO4)2。
答案 (1) (2)8.7×10-7 N2H6(HSO4)2
酸碱中和滴定及其拓展应用(难度系数☆☆☆)
【典例演示2】 (2017·天津理综,9)用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.246 8 g(0.0250 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.100 0 mol·L-1 NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.100 0 mol·L-1 AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.100 0 mol·L-1 NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有_________________________________________________________________。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是__________________________________________________________________。
(3)滴定应在pH<0.5的条件下进行,其原因是
__________________________________________________________________。
(4)b和c两步操作是否可以颠倒________,说明理由___________________
_________________________________________________________________。
(5)所消耗的NH4SCN标准溶液平均体积为________ mL,测得c(I-)=________
mol·L-1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为_________________________________________________________________。
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果________。
解析 (1)配制AgNO3标准溶液,所使用的仪器除烧杯和玻璃棒外还有250 mL(棕色)容量瓶、胶头滴管。(2)因AgNO3见光易分解,所以AgNO3标准溶液应放在棕色细口试剂瓶中并避光保存。(3)NH4Fe(SO4)2为强酸弱碱盐,且Fe3+的水解程度很大,为防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解)所以滴定应在pH<0.5的条件下进行。(4)因Fe3+能与I-发生氧化还原反应,而使指示剂耗尽,无法判断滴定终点,所以b和c两步操作不能颠倒。(5)由三次测定数据可知,第1组数据误差较大,应舍去,所以所消耗的NH4SCN标准溶液平均体积为=10.00 mL,测得c(I-)=[n(AgNO3)-n(NH4SCN)]/V[NaI(aq)]=(25.00×10-3 L×0.100 0 mol·L-1-10.00×10-3 L×0.100 0 mol·L-1)/25.00×10-3L=0.060 0 mol·L-1。(6) 在滴定管中装入NH4SCN标准溶液的前一步,用NH4SCN标准溶液润洗滴定管2~3次。(7)①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,造成溶质减少,则使配制AgNO3标准溶液的浓度偏低,则使消耗的n(NH4SCN)偏小,由c(I-)=[n(AgNO3)-n(NH4SCN)]/V[NaI(aq)]可推断,对c(I-)测定结果影响将偏高。②若在滴定终点读取滴定管刻度时,俯视标准液液面,使读取的NH4SCN标准溶液的体积偏低,由c(I-)=[n(AgNO3)-n(NH4SCN)]/V[NaI(aq)]可推断,对c(I-)测定结果影响将偏高。
答案 (1)250 mL(棕色)容量瓶、胶头滴管
(2)避免AgNO3见光分解
(3)防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解)
(4)否(或不能) 若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点
(5)10.00 0.060 0
(6)用NH4SCN标准溶液润洗滴定管2~3次
(7)偏高 偏高
【考法训练5】 水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg·L-1。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。
Ⅰ.测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH-===2MnO(OH)2↓,酸性条件下,MnO(OH)2将I-氧化为I2:②MnO(OH)2+I-+H+―→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2,③2S2O+I2===S4O+2I-。
Ⅱ.测定步骤:
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200 mL水样。
c.向烧瓶中依次迅速加入1 mL MnSO4无氧溶液(过量)2 mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d.搅拌并向烧瓶中加入2 mLH2SO4无氧溶液,至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00 mL溶液,以淀粉作指示剂,用0.010 00 mol·L-1 Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配制以上无氧溶液时,除去所用溶剂水中氧的简单操作为________。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为________。
①滴定管 ②注射器 ③量筒
(3)搅拌的作用是________。
(4)配平反应②的方程式,其化学计量数依次为________。
(5)步骤f为________________________________________________________。
(6)步骤e中达到滴定终点的标志为________。若某次滴定消耗Na2S2O3溶液4.50 mL,水样的DO=________mg·L-1(保留一位小数)。作为饮用水源,此次测得DO是否达标:________(填“是”或“否”)。
(7)步骤d中加入H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)_______________________________________________________________
_________________________________________________________________。
解析 (1)气体在水中的溶解度随着温度升高而减小,将溶剂水煮沸可以除去所用溶剂水中的氧气。(2)在橡胶塞处加入水样及有关试剂,应选择注射器。(3)搅拌可以使溶液混合均匀,加快反应速率。(4)Mn元素的化合价由+4价降低到+2价,碘元素的化合价由-1价升高到0价,根据化合价升降总数相等,反应②配平后化学方程式为MnO(OH)2+2I-+4H+===Mn2++I2+3H2O,故其化学计量数依次为1,2,4,1,1,3。(5)为了减小实验的误差,滴定操作一般需要重复操作2~3次,因此步骤f为重复步骤e的操作2~3次。(6)I-被氧化为I2后,再用Na2S2O3溶液滴定,将I2还原为I-,因此滴定结束,溶液的蓝色消失且半分钟不恢复原色;n(Na2S2O3)=0.010 00 mol/L×0.004 5 L=4.5×10-5 mol,根据反应①②③有O2~2MnO(OH)2~ 2I2~4S2O,n(O2)=n(Na2S2O3)=1.125×10-6 mol,该河水的DO= mg/L=9.0 mg/L>5 mg/L,达标。(7) Na2S2O3在酸性条件下发生歧化反应,生成的SO2也能够被生成的I2氧化,同时空气中的O2也能够将I-氧化,反应的离子方程式有2H++S2O===S↓+SO2↑+H2O,SO2+I2+2H2O===4H++SO+2I-,4H++4I-+O2===2I2+ 2H2O。
答案 (1)将溶剂水煮沸后冷却 (2)② (3)使溶液混合均匀,快速完成反应 (4)1,2,4,1,1,3 (5)重复步骤e的操作2~3次 (6)溶液蓝色褪去且半分钟内不恢复原色 9.0 是 (7)2H++S2O===S↓+SO2↑+H2O,SO2+I2
+2H2O===4H++SO+2I-,4H++4I-+O2===2I2+2H2O(任写其中2个)
【考法训练6】 准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1NaOH溶液滴定,下列说法正确的是( )
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
解析 A项,滴定管用水洗涤后,还要用待装溶液润洗,否则将要引起误差,错误;B项,在用NaOH溶液滴定盐酸的过程中,锥形瓶内溶液由酸性逐渐变为中性,溶液的pH由小变大,正确;C项,用酚酞作指示剂,锥形瓶中溶液应由无色变为粉红色,且半分钟内不恢复原色时才能停止滴定,错误;D项,滴定达终点时,发现滴定管尖嘴部分有悬滴,则碱液的体积偏大,测定结果偏大,错误。
答案 B
【考法训练7】 某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级
一级
配料
食盐、碘酸钾、抗结剂
碘含量(以I计)
20~50 mg·kg-1
已知:IO+5I-+6H+===3I2+3H2O,I2+2S2O===2I-+S4O。
某学生拟测定食用精制盐的碘(KIO3)含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全。
(1)判断c中恰好完全反应所依据的现象是______________________________
___________________________________________________________________。
(2)b中反应所产生的I2的物质的量是________ mol。
(3)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)________ mg·kg-1。
解析 碘的淀粉溶液显蓝色,碘与Na2S2O3
溶液恰好反应完全时,溶液由蓝色变为无色,且半分钟内不变色。计算的关系式为KIO3~3I2~6S2O。n(I2)=n(S2O)=×2.0×10-3 mol·L-1×10.0×10-3 L=1.0×10-5 mol,n(I)=n(KIO3)=n(I2),食用精制盐的碘含量=≈ mg·kg-1。
答案 (1)滴最后一滴溶液,溶液由蓝色恰好变为无色,且半分钟内不变色 (2)1.0×10-5 (3)
【当场指导】
氧化还原反应滴定法
是指氧化剂与还原剂之间的相互滴定,该滴定方法在仪器使用、实验操作上与中和滴定一样,常见的试剂有KMnO4、I2、铁盐,复习中应明确使用的指示剂及终点时颜色变化。
滴定方法
还原剂滴定KMnO4
KMnO4滴定还原剂
I2滴定还原剂
还原剂滴定I2
铁盐滴定还原剂
还原剂滴定铁盐
指示剂
KMnO4
KMnO4
淀粉
淀粉
KSCN
KSCN
终点时颜色变化
粉(浅)红色→无色
无色→粉(浅)红色
无色→蓝色→
蓝色→无色
溶液变红色
红色消失
高频考点二 盐类的水解及其应用
[考点精要]
1.盐类水解的3个误区
误区1:误认为水解平衡向正向移动,离子的水解程度一定增大。如向FeCl3溶液中,加入少量FeCl3固体,平衡向水解方向移动,但Fe3+的水解程度减小。
误区2:误认为弱酸强碱盐都因水解而显碱性。如NaHSO3溶液显酸性。
误区3:误认为可水解的盐溶液在蒸干后都得不到原溶质。对于水解程度不大且水解产物不离开平衡体系的情况[如Al2(SO4)3]来说,溶液蒸干仍得原溶质。
2.盐类水解的3个要素
要素1:盐类水解的规律。谁弱谁水解,越弱越水解,谁强显谁性。
要素2:盐类水解离子方程式的书写。注意多元弱酸根的分步水解,“”的使用。
要素3:水解平衡的影响因素。升温、加水、加入相应离子对平衡的影响。
[考法指导]
水解原理及影响因素(难度系数☆☆)
【考法训练1】 常温下,现有0.01 mol·L-1 NaHY(酸式盐,Y表示原子或原子团)溶液,下列说法正确的是( )
A.溶液一定呈酸性
B.溶液中一定存在:Y2-+H2OOH-+HY-
C.溶液加水稀释,离子浓度都减小
D.溶液中:c(Na+)≥c(Y2-)
解析 A项,溶液的酸碱性取决于HY-水解程度和电离程度的大小;B项,HY-不一定是弱酸的酸式根;C项,若溶液呈酸性,c(OH-)增大,若溶液呈碱性,c(H+)增大。
答案 D
【考法训练2】 某同学探究溶液的酸碱性对FeCl3水解平衡的影响,实验方案如下:配制50 mL 0.001 mol·L-1 FeCl3溶液、50 mL对照组溶液X,向两种溶液中分别滴加1滴1 mol·L-1 HCl溶液、1滴1 mol·L-1 NaOH溶液,测得溶液pH随时间变化的曲线如图所示。下列说法不正确的是( )
A.依据M点对应的pH,说明Fe3+发生了水解反应
B.对照组溶液X的组成可能是0.003 mol·L-1 KCl
C.依据曲线c和d说明Fe3+水解平衡发生了移动
D.通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向
解析 FeCl3溶液的pH小于7,溶液显酸性,原因是FeCl3是强酸弱碱盐,Fe3+在溶液中发生了水解,故A项正确;对照组溶液X加碱后溶液的pH的变化程度比加酸后的pH的变化程度大,而若对照组溶液X的组成是0.003 mol·L-1 KCl,则加酸和加碱后溶液的pH的变化应呈现轴对称的关系,故B项错误;在FeCl3溶液中加碱、加酸后,溶液的pH的变化均比对照组溶液X的变化小,因为加酸或加碱均引起了Fe3+水解平衡的移动,故溶液的pH的变化比较缓和,故C项正确;FeCl3溶液水解出Fe(OH)3,故溶液的浑浊程度变大,则水解被促进,否则被抑制,故D项正确。
答案 B
盐类水解的综合应用(难度系数☆☆☆)
【典例演示】 室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入物质
结论
A
50 mL 1 mol·L-1H2SO4
反应结束后,c(Na+)=c(SO)
B
0.05 mol CaO
溶液中增大
C
50 mL H2O
由水电离出的c(H+)·c(OH-)不变
D
0.1 mol NaHSO4固体
反应完全后,溶液pH减小,c(Na+)不变
解析 Na2CO3溶液中存在水解平衡CO+H2OHCO+OH-,所以溶液呈碱性。A项,向溶液中加入50 mL 1 mol·L-1H2SO4,Na2CO3与H2SO4 恰好反应生成0.05 mol Na2SO4,根据物料守恒可得c(Na+)=2c(SO),错误;B项,向Na2CO3溶液中加入0.05 mol CaO后,发生反应:CaO+H2O===Ca(OH)2,生成0.05 mol Ca(OH)2,恰好与Na2CO3反应:Ca(OH)2+Na2CO3===CaCO3↓+2NaOH,则c(CO)减小,c(OH-)增大,c(HCO)减小,所以增大,正确;C项,加入50 mL H2O,CO的水解平衡正向移动,但c(OH-)减小,溶液中的OH-全部来源于水的电离,由于水电离出的H+、OH-浓度相等,故由水电离出的c(H+)·c(OH-)减小,错误;D项,加入的0.1 mol NaHSO4固体与0.05 mol Na2CO3恰好反应生成0.1 mol Na2SO4,溶液呈中性,故溶液pH减小,加入NaHSO4 ,引入Na+
,所以c(Na+)增大,错误。
答案 B
【考法训练3】 (2017·安徽池州模拟)常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a。下列说法正确的是( )
A.点O溶液、点b溶液、点d溶液的pH都大于7
B.点b溶液中:c(Na+)+c(H+)=c(CO)+c(OH-)+c(HCO)+c(Cl-)
C.点O溶液中:c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H2CO3)
D.点a溶液中:c(Na+)>c(CO)>c(HCO)>c(Cl-)>c(OH-)>c(H+)
解析 Na2CO3与盐酸恰好完全反应生成NaCl、CO2和H2O,CO2溶于水生成H2CO3,所以溶液显酸性,即d点pH小于7,故A错误;点b溶液中NaHCO3和NaCl,溶液中电荷守恒为c(Na+)+c(H+)=2c(CO)+c(OH-)+c(HCO)+c(Cl-),故B错误;Na2CO3溶液中CO发生两步水解,以第一步为主,第一步水解生成HCO和OH-,第二步水解生成H2CO3和OH-,所以溶液中c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H2CO3),故C正确;点a溶液中溶质等物质的量的Na2CO3、NaHCO3和NaCl,CO水解程度大于HCO,所以c(HCO)>c(CO),则c(Na+)>c(HCO)>c(Cl-)>c(CO)>c(OH-)>c(H+),故D错误。
答案 C
【考法训练4】 NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________________________
_________________________________________________________________
_________________________________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2中的c(NH)________(填“等于”“大于”或“小于”)0.1 mol·L-1NH4HSO4中的c(NH)。
(3)如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是_____________________________________
___________________________________________________________________。
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2中2c(SO)-c(NH)-3c(Al3+)=________。
答案 (1)Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2OAl(OH)3(胶体)+3H+,Al(OH)3形成的胶体吸附悬浮颗粒使其沉降从而净化水
(2)小于
(3)①Ⅰ NH4Al(SO4)2水解,溶液呈酸性,升高温度使其水解程度增大,pH减小 ②10-3 mol·L-1
【当场指导】
c(H2CO3)+c(H+)=c(OH-)+c(CO)。
溶液中粒子浓度关系:
c(Na+)>c(HCO)>c(OH-)>c(H2CO3)>c(H+)>c(CO)。
高频考点三 沉淀溶解平衡
[考点精要]
1.沉淀溶解平衡中理解误区
(1)把沉淀溶解平衡误认为电离平衡。实际上如BaSO4(s)Ba2+(aq)+SO(aq)是溶解平衡,因为BaSO4是强电解质,不存在电离平衡。
(2)一定温度下,误认为溶解度受溶液中相同离子浓度的影响,因而Ksp会随之改变。实际上Ksp只受温度影响,温度不变则Ksp不变,如Mg(OH)2在MgCl2溶液中的溶解度要小于在纯水中的溶解度,而Ksp[Mg(OH)2]不变。
(3)对于不同类型的物质,当Ksp相差不大时不能直接作为比较依据,可通过比较饱和溶液溶质的物质的量浓度确定溶解能力的强弱,如常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,不能判断前者溶解度大。
2.溶解度曲线的全面认识
(1)不同物质在各温度时的溶解度不同。
(2)曲线交点的含义:表示两物质在某温度时有相同的溶解度。
(3)能很快比较出两种物质在某温度范围内溶解度的大小。
(4)多数物质溶解度随温度升高而增大(如KNO3)、有的变化不大(如NaCl);少数随温度升高而降低[如Ca(OH)2]。
(5)判断结晶的方法
①溶解度受温度影响较小的(如NaCl)采取蒸发结晶的方法;
②溶解度受温度影响较大的采取蒸发浓缩、冷却结晶的方法;
③
带有结晶水的盐,一般采取蒸发浓缩、冷却结晶的方法,特别应注意的是若从FeCl3溶液中结晶出FeCl3·6H2O晶体,应在HCl气氛中蒸发浓缩、冷却结晶。
[考法指导]
溶解平衡的理解与应用(难度系数☆☆)
【考法训练1】 下列说法中正确的是( )
A.饱和石灰水中加入一定量生石灰,溶液温度明显升高,pH增大
B.AgCl悬浊液中存在平衡:AgCl(s)Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度减小
C.AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI)
D.硬水中含有较多的Ca2+、Mg2+、HCO、SO,加热煮沸可以完全除去其中的Ca2+、Mg2+
解析 饱和石灰水中加入一定量生石灰,溶液温度明显升高,但Ca(OH)2的溶解度降低,溶液中c(OH-)减小,溶液的pH减小,A错;AgCl悬浊液中加入少量NaCl粉末,平衡向左移动,但离子的总浓度增大,B错;由沉淀的转化规律可得,Ksp(AgCl)>Ksp(AgI),C对;加热煮沸硬水,只能软化具有暂时硬度的硬水,D错。
答案 C
【考法训练2】 (2017·山西考前质检)室温时,向含有AgCl和AgBr固体的悬浊液中加入少量NaBr固体,下列各项中增大的是( )
A.c(Ag+) B.
C.c(Cl-) D.
解析 向含有AgCl和AgBr固体的悬浊液中加入少量NaBr固体,溴离子浓度增大,使AgBr的溶解平衡逆向移动,c(Ag+)减小,A错误;B项的比例式上下同乘c(Ag+),则转化为溶度积常数之比,溶度积常数只与温度有关,B错误;c(Ag+)减小,使AgCl的溶解平衡正向移动,c(Cl-)增大,C正确;c(Ag+)·c(Br-)不变,c(Cl-)增大,D项减小。
答案 C
【当堂指导】
Ksp与物质溶解度的关系判断
(1)对于组成形式相同的物质来说,Ksp越小,物质越难溶解或溶解度越小;组成形式(AmBn)不同的物质,Ksp越小且(m+n)越小的物质越难溶。
(2)Ksp的大小与沉淀转化的关系:组成形式相同的难溶物质,Ksp较大的沉淀易转化为Ksp较小的沉淀,但当二者Ksp相差不大时,反过来也可转化;对于组成形式(AmBn)不同的物质来说,一般情况下,Ksp较大且(m+n)也较大的物质易转化为Ksp较小且(m+n)也较小的物质。其他情况则需要通过计算才能确定。
溶解度曲线及Ksp的应用(难度系数☆☆☆)
【典例演示】 (2017·揭阳一中、金山中学联考)已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg[c(Ag+)],纵坐标Y=-lg[c(X-)],下列说法正确的是( )
A.该温度下AgCl的Ksp约为1×10-15
B.a点可表示AgCl的过饱和溶液
C.b点时c(Ag+)=c(I-)
D.该温度下AgCl和AgBr的饱和溶液中:c(Cl-)<c(Br-)
解析 由题图可知,该温度下p(Ag+)=-lg[c(Ag+)]=5时,Y=-lg[c(Cl-)]=5,则c(Ag+)=c(Cl-)=10-5 mol·L-1,AgCl的Ksp约为1×10-10,A项错误;a点在AgCl的沉淀溶解平衡曲线下方,表示AgCl的过饱和溶液,B项正确;b点表示AgI的不饱和溶液,c(Ag+)>c(I-),C项错误;该温度下AgCl和AgBr的饱和溶液中:c(Cl-)>c(Br-),D项错误。
答案 B
【考法训练3】 两种不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解需要吸收热量。下列说法正确的是( )
A.温度大小:T1>T2
B.加入BaCl2固体,可使溶液由a点变到c点
C.c点对应溶液在T1、T2温度下均有固体析出
D.a点和b点对应溶液的Ksp相等
解析 溶解吸热,则温度越高,溶度积越大,故T1<T2,A项错误;加入BaCl2固体,c(Ba2+)增大,但温度不变,Ksp不变,最终该点还在T1对应的曲线上,B项错误;T1时,c点对应溶液中有固体析出,T2时,c点对应溶液没有达到饱和状态,无固体析出,C项错误;a、b两点对应溶液的温度均为T1,温度不变,溶度积常数不变,D项正确。
答案 D
【考法训练4】 氨水在工业上常用作沉淀剂。已知25 ℃时,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Al(OH)3]=1.0×10-32。向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水。当溶液中Fe3+和Al3+沉淀完全[c(Fe3+)、c(Al3+)均小于1×10-5 mol·L-1]时,调节溶液的pH应略大于( )
A.3 B.5
C.9 D.11
解析 溶液中Fe3+恰好沉淀完全时,c(OH-)==1×10-11 mol·L-1,pH=3;溶液中Al3+恰好沉淀完全时,c(OH-)==1×10-9 mol·L-1,pH=5。故当溶液中Fe3+和Al3+沉淀完全时,调节溶液的pH应略大于5,B项正确。
答案 B
【当堂指导】
溶解度曲线解题要点
(1)沉淀溶解平衡曲线类似于溶解度曲线,曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和,此时有沉淀析出,曲线下方的任一点均表示不饱和溶液。
(2)从图像中找到数据,根据Ksp公式计算得出Ksp的值。
(3)比较溶液的Qc与Ksp的大小,判断溶液中有无沉淀析出。
(4)涉及Qc的计算时,所代入的离子浓度一定是混合溶液中的离子浓度,因此计算离子浓度时,所代入的溶液体积也必须是混合溶液的体积。
[模型示例]
【示例1】 (2016·江苏化学)H2C2O4为二元弱酸。20 ℃时,配制一组c(H2C2O4)+c(HC2O)+c(C2O)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是(双选)( )
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O)>c(HC2O)
B.c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O)
C.c(HC2O)=c(C2O)的溶液中:c(Na+)>0.100 mol·L-1+c(HC2O)
D.pH=7.0的溶液中:c(Na+)>2c(C2O)
[分析建模]
[模型解题]
答案 BD
【示例2】 (2017·江西八所重点中学联考)在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )
A.a点Kw=1.0×10-14
B.水的电离程度:b>c>a>d
C.b点:c(NH)>c(Cl-)>c(H+)>c(OH-)
D.25 ℃时NH4Cl水解平衡常数为(n-1)×10-7(用n表示)
[分析建模]
向弱酸(或强酸)溶液中逐滴滴入强碱(或弱碱)溶液,离子浓度、pH有一定的变化规律。现以向CH3
COOH溶液中逐滴加入NaOH溶液为例进行分析,以能够对该类题有一个整体把握。
上图一目了然,可以很清楚地得出不同情况下溶液中的pH、离子浓度的关系。
[模型解题]
答案 D
[当堂应用]
【应用1】 25 ℃条件下,下列溶液中的粒子浓度关系正确的是( )
A.浓度相同的①CH3COONa溶液、②NaClO溶液、③NaCl溶液的c(H+):②>①>③
B.NaHC2O4溶液中,c(H+)+c(Na+)=c(OH-)+c(C2O)+c(HC2O)
C.NaOH溶液和NH4Cl溶液混合至溶液呈中性,则混合后的溶液中,c(Cl-)=c(NH)+c(Na+)
D.pH=6的NaHSO3溶液中:c(SO)-c(H2SO3)=9.9×10-6 mol·L-1
解析 CH3COONa和NaClO在溶液中均水解,但后者水解程度大,溶液碱性较强,即c(H+)较小,NaCl不水解,c(H+)最大,故c(H+):③>①>②,A项错误;根据电荷守恒得c(H+)+c(Na+)=c(OH-)+2c(C2O)+c(HC2O),B项错误;根据电荷守恒得:c(Cl-)+c(OH-)=c(NH)+c(H+)+c(Na+),溶液呈中性:c(OH-)=c(H+),故c(Cl-)=c(NH)+c(Na+),C项正确;pH=6的NaHSO3溶液中,根据电荷守恒得:c(Na+)+c(H+)===2c(SO)+c(OH-)+c(HSO),根据物料守恒得:
c(Na+)=c(SO)+c(HSO)+c(H2SO3),联立得质子守恒式:c(H2SO3)+c(H+)=c(SO)+c(OH-),则c(SO)-c(H2SO3)=c(H+)-c(OH-)=10-6 mol·L-1-10-8 mol·L-1=9.9×10-7 mol·L-1,D项错误。
答案 C
【应用2】 25 ℃时,c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的CH3COOH、CH3COONa的混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列叙述正确的是( )
A.25 ℃时,CH3COOH的电离常数K=5×10-2.75
B.随pH增大,增大
C.pH=4的混合溶液中c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
D.pH=5的混合溶液中c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol·L-1
解析 25 ℃时、pH=4.75时,混合溶液中c(H+)=1×10-4.75 mol·L-1,c(CH3COO-)=c(CH3COOH)=0.050 mol·L-1,则CH3COOH的电离常数K==1×10-4.75,A项错误;由K=可得:=,随pH增大,c(H+)减小,K保持不变,故减小,B项错误;由题图可知,pH=4的混合溶液中c(CH3COOH)>c(CH3COO-),C项错误;根据电荷守恒,pH=5的混合溶液中存在:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则有:c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=c(CH3COO-)+c(OH-)+c(CH3COOH)-c(OH-)=c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1,D项正确。
答案 D
一、选择题
1.下列说法正确的是( )
A.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的NaOH的物质的量相等
B.若NaHA溶液中pH<7,则H2A一定是强酸
C.将NaOH溶液加入到NH4Cl溶液至中性时,溶液中c(NH)=c(Cl-)
D.常温下,将pH=11的Ba(OH)2溶液加水稀释10倍后,溶液的pH=12
解析 A项,由题意可知n(HCl)=n(CH3COOH),所以二者消耗的NaOH的物质的量相等,正确;B项,NaHA溶液的pH<7,只能说明HA-的电离程度大于水解程度,并不能说明H2A一定是强酸,例如NaHSO3溶液的pH<7,H2SO3不是强酸,错误;C项,将NaOH溶液加入到NH4Cl溶液至中性时,溶液中c(H+)=c(OH-),根据电荷守恒有c(Na+)+c(NH)=c(Cl-),错误;D项,强碱溶液稀释10倍,pH应该减小1,错误。
答案 A
2.(2017·银川模拟)下列说法不正确的是( )
A.常温下,在0.1 mol·L-1的HNO3溶液中,由水电离出的c(H+)<
B.浓度为0.1 mol·L-1的NaHCO3溶液:c(H2CO3)>c(CO)
C.25 ℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
D.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
解析 在0.1 mol·L-1的HNO3溶液中,由水电离出的c(H+)为10-13 mol·L-1<,A正确;浓度为0.1 mol·L-1的NaHCO3溶液水解大于电离,c(H2CO3)>c(CO),B正确;温度不变,AgCl固体的溶度积不变,C正确;冰醋酸中逐滴加水,溶液的导电性先增大后减小,醋酸的电离程度增大,溶液的pH先减小后增大,D错误。
答案 D
3.某温度下,有pH相同的H2SO4溶液和Al2(SO4)3溶液,在H2SO4溶液中由水电离出的H+浓度为10-amol·L-1,在Al2(SO4)3溶液中由水电离的H+浓度为10-bmol·L-1,由此温度下的Kw为( )
A.1×10-14 B.1×10-2a
C.1×10-(7+a) D.1×10-(a+b)
解析 根据描述,H2SO4溶液中,c(H+)==,H2SO4溶液和Al2(SO4)3溶液的pH相同,即=10-b,可求出此温度下的Kw。
答案 D
4.某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。据图判断错误的是( )
A.a一定大于9
B.Ⅱ为氨水
C.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
D.恰好完全中和相同体积、pH=11的两溶液时,消耗相同浓度的稀硫酸的体积:V(NaOH)<V(氨水)
解析 pH=11的氨水和NaOH溶液分别加水稀释100倍,氨水稀释过程中电离程度增大,pH变化较小,故Ⅰ为NaOH溶液,Ⅱ为氨水,B项正确;pH=11的NaOH溶液稀释100倍后溶液的pH=9,故a>9,A项正确;稀释后氨水电离出的c(OH-)大于NaOH溶液电离出的c(OH-),故氨水中水的电离程度小于NaOH溶液中水的电离程度,C项错误;pH=11的氨水和NaOH溶液,NH3·H2O的物质的量浓度大于NaOH的物质的量浓度,则恰好完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积:V(NaOH)<V(氨水),D项正确。
答案 C
5.(2016·河南洛阳三月统考)常温下,醋酸和NH3·H2O的电离平衡常数均为1.8×10-5。向10 mL 0.1 mol·L-1的氨水中滴加相同浓度的CH3COOH溶液(温度变化忽略不计),在滴加过程中( )
A.水的电离程度始终增大
B.c(NH)与c(NH3·H2O)之和始终保持不变
C.始终减小
D.当加入CH3COOH溶液的体积为10 mL时,溶液pH>7
解析 开始时,溶液的碱性逐渐减弱,c(OH-)减小,水的电离程度逐渐增大,当醋酸过量后,溶液中氢离子浓度逐渐增大,水的电离程度逐渐减小,A错误;溶液的体积增大,n(NH)与n(NH3·H2O)的和不变,所以c(NH)与c(NH3·H2O)之和减小,B错误;已知Ka=,Ka只与温度有关,加醋酸,溶液中c(OH-)减小,则c(H+)增大,所以减小,C正确;当加入CH3COOH溶液的体积为10 mL时,醋酸和一水合氨的物质的量相等,由于两者的电离常数相等,所以溶液显中性,D错误。
答案 C
6.常温下,浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lgc(H+)/c(OH-)随加入NaOH的物质的量的变化如图所示。下列叙述正确的是( )
A.HX的酸性弱于HY
B.a点由水电离出的c(H+)=10-12 mol·L-1
C.c点溶液中:c(Y-)>c(HY)
D.b点时酸碱恰好完全反应
解析 未加氢氧化钠时,相同浓度溶液中,HX的lg=12,而HY的lg<9,由于c(H+)×c(OH-)=Kw,则HX溶液中氢离子浓度更大,故HX的酸性强于HY,故A错误;a点溶液lg=12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=10-13 mol·L-1,水电离出的c(H+)等于溶液中c(OH-),即a点由水电离出的c(OH-)=10-13 mol·L-1,故B错误;c点溶液lg=6,结合c(H+)×c(OH-)=10-14,可知c(H+)=10-4 mol·L-1
,溶液呈酸性,此时溶液为等浓度的HY、NaY混合溶液,说明HY的电离程度大于Y-的水解程度,则c点溶液中:c(Y-)>c(HY),故C正确;HY为0.01 mol,b点加入NaOH为0.008 mol,二者按物质的量1∶1反应,故HY有剩余,故D错误。
答案 C
7.关于FeCl3进行的实验,下列预测或解释正确的是( )
选项
实验
预测或解释
A
蒸发FeCl3溶液
得到FeCl3固体
B
在黄色的FeCl3溶液中加入FeCl3固体,溶液黄色加深
FeCl3的水解程度变大,FeCl3浓度减小
C
将黄色的FeCl3溶液微热,溶液呈红褐色
水解反应ΔH>0
D
在FeCl3溶液中,加入KHCO3溶液
有CO2产生,但无Fe(OH)3沉淀生成
解析 FeCl3水解且生成的HCl易挥发,蒸干最终得到的是Fe(OH)3而不是FeCl3固体,A项错误;加入FeCl3固体,使FeCl3的水解平衡正向移动,虽然FeCl3浓度增大,但是水解程度变小,B项错误;红褐色液体为Fe(OH)3胶体,说明加热促进了FeCl3的水解,C项正确;Fe3+与HCO发生相互促进的水解反应,生成CO2,也生成Fe(OH)3沉淀,D项错误。
答案 C
8.已知:H2SO3HSO+H+ Ka1、HSOSO+H+ Ka2。常温下,向某浓度的H2SO3溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SO3、HSO、SO三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
A.曲线3表示的微粒是SO
B.溶液的pH=4.2时:c(Na+)+c(H+)=c(OH-)+2c(SO)
C.常温下,=1 000
D.溶液的pH=1.2时:c(Na+)+c(H+)=c(OH-)+c(H2SO3)
解析 由题图可知,曲线1、2、3表示的微粒分别是H2SO3、HSO、SO,A项正确;溶液的pH=4.2时,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HSO)+2c(SO),B项错误;溶液的pH=1.2时,c(H2SO3)=c(HSO),Ka1==1×10-1.2,溶液的pH=4.2时,c(HSO)=c(SO),Ka2==1×10-4.2,则=1 000,C项正确;溶液的pH=1.2时,c(H2SO3)=c(HSO),且c(SO)=0,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HSO),则有:c(Na+)+c(H+)=c(OH-)+c(H2SO3),D项正确。
答案 B
9.(2017·湖南郴州质检)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20 mL、浓度均为0.1 mol·L-1的盐酸和HX溶液,溶液的pH随加入NaOH溶液体积变化如图。下列说法中正确的是( )
A.HX为强酸
B.M点c(HX)<c(X-)
C.N点c(Na+)>c(X-)且有c(Na+)=c(X-)+c(HX)
D.P点c(Cl-)=0.05 mol·L-1
解析 未滴定时,0.1 mol·L-1盐酸pH为1,由图可知,0.1 mol/L HX溶液的pH>5,则HX为弱酸,A错误;M点为等浓度NaX、HX混合溶液,假如不考虑水解和电离,则c(HX)=c(X-),根据溶液呈碱性,说明X-
的水解程度大于HX的电离程度,故c(HX)>c(X-),B错误;N点溶质为NaX,X-会发生水解,故c(Na+)>c(X-),由物料守恒可知,c(Na+)=c(X-)+c(HX),C正确;P点c(Cl-)==0.067 mol·L-1,D错误。
答案 C
10.(2017·江苏化学,14改编)常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.76×10-5,下列说法正确的是( )
A.浓度均为0.1 mol·L-1的HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者小于后者
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C.0.2 mol·L-1 HCOOH与0.1 mol·L-1 NaOH等体积混合后的溶液中:
c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)
D.0.2 mol·L-1 CH3COONa与0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7):
c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
解析 A项,由电荷守恒有c(Na+) +c(H+) =c(HCOO-) +c(OH-),c(Cl-) +c(OH-) =c(NH ) +c(H+),因Kb(NH3·H2O)<Ka(HCOOH),同浓度的HCOONa和NH4Cl溶液,前者HCOO-水解程度小于后者NH 的水解程度,即前者水解产生的c(OH-)小于后者水解产生的c(H+),有前者溶液中c(H+)大于后者溶液中c(OH-),c(Na+) =c(Cl-),则c(Na+) +c(H+) >c(Cl-) +c(OH-) ,错误;B项,CH3COOH的酸性比HCOOH弱,同pH时,c(CH3COOH)>c(HCOOH),用NaOH滴定时,CH3COOH消耗的NaOH多,错误;C项,此时为等浓度的HCOOH和HCOONa溶液,质子守恒式有c(HCOO-) + 2c(OH-) = 2c(H+) +c(HCOOH)[可由电荷守恒式c(Na+) +c(H+) =c(HCOO-) +c(OH-)和物料守恒式2c(Na+)=c(HCOO-) +c(HCOOH)处理得到],错误;D项,当两者等体积混合时,得等浓度CH3COOH、CH3COONa、NaCl的混合溶液,若不考虑CH3COOH的电离和CH3COO-的水解,有c(CH3COO-)=c(Cl-)=c(CH3COOH),溶液呈酸性,说明CH3COOH的电离(CH3COOH CH3COO-+ H+)大于CH3COO-的水解,有c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),正确。
答案 D
11.某些盐能溶解沉淀,利用下表三种试剂进行实验,相关分析不正确的是( )
编号
①
②
③
分散质
Mg(OH)2
HCl
NH4Cl
备注
悬浊液
1 mol·L-1
1 mol·L-1
A.向①中加入酚酞,溶液显红色说明物质的“不溶性”是相对的
B.分别向少量Mg(OH)2沉淀中加入适量等体积的②和③,沉淀均能快速彻底溶解
C.①③混合后发生反应:Mg(OH)2(s)+2NHMg2++2NH3·H2O
D.向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动
解析 A项,使酚酞显红色的溶液呈碱性,说明Mg(OH)2在水中有一定的溶解,电离的OH-使溶液呈碱性,正确;B项,Mg(OH)2与NH4Cl溶液反应速率较小,沉淀不能快速彻底溶解,错误;C项,NH结合Mg(OH)2悬浊液中的OH-,促进Mg(OH)2的沉淀溶解平衡正向移动,促使Mg(OH)2沉淀溶解,正确;D项,盐酸能够与Mg(OH)2发生中和反应,促使Mg(OH)2的沉淀溶解平衡正向移动,正确。
答案 B
12.(2016·黄冈模拟)在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是( )
A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点
C.T ℃时,Ag2CrO4的Ksp为1×10-8
D.图中a=×10-4
解析 一种物质的Ksp只与温度有关,A正确;向饱和Ag2CrO4溶液中加入固体K2CrO4后,沉淀溶解平衡向左移动,导致c(Ag+)减小,而图像中由Y点变成X
点的过程中,c(Ag+)保持不变,B正确;T ℃时,Ag2CrO4的Ksp=c(CrO)·c2(Ag+)=(1×10-5)×(1×10-3)2=1×10-11,C错误;温度不变Ksp=c(CrO)·c2(Ag+)=(1×10-5)×(1×10-3)2=a2×5×10-4,解得a=×10-4,D正确。
答案 C
二、非选择题
13.(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3 COONa固体,溶液中=________(填“增大”“减小”或“不变”)。
(2)常温下,将V mL 0.100 0 mol·L-1氢氧化钠溶液逐滴加入20.00 mL 0.100 0 mol·L-1醋酸溶液中,充分反应。当溶液pH=7,此时V的取值________20.00(填“>”“<”或“=”),此时溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为____________________。(忽略溶液体积的变化)
(3)常温下,向20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液c(H+)变化的情况如下图,回答下列问题:
若将Na2CO3和NaHCO3混合物配成溶液,则此溶液的pH的取值范围是________。
解析 (1)醋酸的电离平衡常数K=,只与温度有关。
(2)若氢氧化钠溶液与醋酸等体积混合,溶液呈碱性,如果溶液pH=7,则V<20.00;因溶液的pH=7,所以得c(Na+)=c(CH3COO-)>c(H+)=c(OH-)。
(3)根据图象分析Na2CO3和NaHCO3共存时溶液的pH为8<pH<12。
答案 (1)不变
(2)< c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
(3)8<pH<12
14.(2017·湛江模拟)弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:
H2A===H++HA-,HA-H++A2-。
(1)常温下NaHA溶液的pH________(填字母),原因是
_______________________________________________________________。
A.大于7 B.小于7
C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)Ca2-(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O。为了使废水的排放达标,进行如下处理:
Cr2OCr3+、Fe3+Cr(OH)3、Fe(OH)3
(1)该废水中加入绿矾和H+,发生反应的离子方程式为
_________________________________________________________________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为________。(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
答案 Ⅰ.(1)B NaHA只能发生电离,不能发生水解
(2)BC (3)BD
Ⅱ.(1)Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O
(2)3.0×10-6 mol·L-1
15.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
(1)毒重石用盐酸浸取前需充分研磨,目的是________。实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
Ca2+
Mg2+
Fe3+
开始沉淀时的pH
11.9
9.1
1.9
完全沉淀时的pH
13.9
11.1
3.2
加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是_________________________。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO+2H+===Cr2O+H2O Ba2++CrO===BaCrO4↓
步骤Ⅰ 移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的________(填“上方”或“下方”)。BaCl2溶液的浓度为________ mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将________(填“偏大”或“偏小”)。
解析 (1)充分研磨的目的是增大反应物的接触面积,从而使反应速率加快。配制一定质量分数的溶液,可以算出所需37%的盐酸及水的体积,然后在烧杯中稀释,为加速溶解,要用玻璃棒进行搅拌。(2)根据流程图及表格中数据可知,加入NH3·H2O调节pH=8时,只有Fe3+完全沉淀而除去。加入NaOH,调pH=12.5,对比表格中数据可知,此时Mg2+完全沉淀,Ca2+部分沉淀,所以滤渣Ⅱ中含Mg(OH)2、Ca(OH)2。根据Ksp(BaC2O4)=1.6×10-7,H2C2O4过量时Ba2+会转化为BaC2O4沉淀,从而使BaCl2·2H2O的产量减少。(3)“0”刻度位于滴定管的上方。由题意可得关系式BaCl2~CrO~H+,则有c(BaCl2)×y×10-3L=b mol·L-1×(V0-V1)×10-3 L,解得c(BaCl2)= mol·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则V1变小,Ba2+浓度测量值将偏大。
答案 (1)增大接触面积从而使反应速率加快 ac
(2)Fe3+ Mg(OH)2、Ca(OH)2 H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少
(3)上方 偏大
加练6 反应过程中粒子变化
1.电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
A.曲线①代表滴定HCl溶液的曲线
B.A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C.在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A
D.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
解析 A项,由分析可知,曲线①代表滴定CH3COOH溶液的曲线,错误;B项,根据电荷守恒得:c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.05 mol·L-1
,错误;C项,酸或碱抑制水电离,含有弱离子的盐促进水电离,C点溶质为NaCl,A点溶质为CH3COONa,促进水电离,B点为等物质的量浓度的CH3COONa和NaOH,NaOH会抑制水的电离,所以在相同温度下,水电离的c(H+):B<C<A,错误;D项,D点溶液中,c(Na+)=1.5c(Cl-),溶液中电荷守恒为:c(Cl-)+c(OH-)=c(Na+)+c(H+),则c(Cl-)=2c(OH-)-2c(H+),正确。
答案 D
2.25 ℃时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1 NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是( )
A.曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(OH-)-c(H+)]
C.曲线Ⅱ:滴加溶液在10~20 mL之间存在:c(NH)=c(Cl-)>c(OH-)=c(H+)
D.曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH)>c(H+)>c(NH3·H2O)>c(OH-)
解析 曲线Ⅰ为向氨水中滴加盐酸:滴加盐酸到10 mL时溶液呈碱性,A错;c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],B错;曲线Ⅱ是向醋酸中滴加氢氧化钠溶液,C错。
答案 D
3.常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列说法中不正确的是( )
A.MOH为一元弱碱
B.MA稀溶液pH<7
C.N点水的电离程度大于K点水的电离程度
D.K点对应的溶液的pH=10,则c(MOH)+c(OH-)-c(H+)=0.01 mol·L-1
解析 A项,0.01 mol·L-1 HA溶液中pH=2,则HA是强酸,与50 mL MOH溶液恰好反应后,溶液呈酸性,与51 mL MOH溶液反应后,恰好呈中性,说明MOH为弱碱,故A正确;B项,HA是强酸,MOH为弱碱,MA是强酸弱碱盐,其稀溶液pH<7,故B正确;C项,由图像可知,N点溶液呈中性,水电离的H+为10-7 mol·L-1,K点溶液呈碱性,MOH电离的OH-抑制了水电离,水电离的H+小于10-7mol·L-1,所以N点水的电离程度大于K点水的电离程度,故C正确;D项,在K点时混合溶液体积是碱溶液的2倍,根据物料守恒结合溶液体积变化知,c(MOH)+c(M+)=0.01 mol·L-1,根据电荷守恒得:c(M+)+c(H+)=c(OH-)+c(A-),c(MOH)+c(OH-)-c(H+)=c(M+)-c(A-)+c(MOH)=0.01 mol·L-1-0.005 mol·L-1=0.005 mol·L-1,故D错误。
答案 D
4.(2016·天津理综,6)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( )
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
解析 A项,根据图像知,在未滴加NaOH溶液时,0.1 mol·L-1的三种酸(HA、HB和HD)溶液的pH,说明三种酸均为弱酸,且HA的pH最小、酸性最强,HD的pH最大、酸性最弱,因酸性越强,电离常数越大,故KHA>KHB>KHD,正确; B项,滴定至P点时,溶液中未反应的HB与生成的NaB的浓度相等,且溶液呈酸性,说明HB的电离程度大于B-水解程度,故c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),正确;C项,pH=7时,三种离子的浓度分别等于c(Na+),然而三种溶液中阴离子水解程度不同,加入的NaOH的体积不同,故三种阴离子的浓度也不同,错误;D项,根据质子守恒即可得出,三种溶液混合后溶液的质子守恒关系:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),正确。
答案 C
5.(2017·邯郸模拟)25 ℃时,向100 mL 1 mol·L-1 H2SO3溶液中逐渐滴入1 mol·L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pK=-1g K,25 ℃时,H2SO3的pKa1=1.85,pKa2=7.19)。下列说法不正确的是( )
A.pH=1.85时,c(H2SO3)=c(HSO)
B.pH=6时,c(Na+)>c(HSO)>c(SO)
C.pH=7.19时,c(Na+)+c(H+)=c(HSO)+2c(SO)+c(OH-)
D.加入150 mL NaOH溶液时,3c(Na+)=2c(H2SO3)+2c(HSO)+2c(SO)
解析 A项,含硫酸物质的分布分数为δ为0.50时c(H2SO3)=c(HSO
),pH=1.85,故A正确;B项,pH=6时溶液中主要的离子是HSO和少量SO,溶液显酸性,c(Na+)>c(HSO)>c(SO),故B正确;C项,pH=7.19时溶液为Na2SO3和NaHSO3的混合溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(HSO)+2c(SO)+c(OH-),故C正确;D项,加入150 mL NaOH溶液时溶液中为等物质的量的Na2SO3和NaHSO3的混合溶液,溶液中存在物料守恒,分析可知:2c(Na+)=3c(H2SO3)+3c(HSO)+3c(SO),故D错误;故选D。
答案 D
6.25 ℃时,向盛有50 mL pH=3的HA溶液的绝热容器中加入1.0 mol·L-1 pH=14的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是( )
A.HA溶液的物质的量浓度为0.10 mol·L-1
B.a→b的过程中,混合溶液中不可能存在:c(A-)=c(Na+)
C.b→c的过程中,温度降低的主要原因是溶液中A-发生了水解反应
D.25 ℃时,HA的电离常数K约为1.25×10-6
解析 NaOH溶液和HA溶液恰好完全中和时,所得混合溶液的温度最高,则恰好完全中和时消耗NaOH溶液的体积为40 mL,故HA溶液的物质的量浓度为=0.80 mol·L-1,A项错误;0.80 mol·L-1 HA溶液的pH=3,说明HA为弱酸,a→b的过程中,混合溶液的溶质为NaA和HA,则混合溶液可能呈中性,存在:c(A-)=c(Na+),B项错误;b→c的过程中,温度降低的主要原因是在b点恰好完全中和,继续滴加氢氧化钠溶液不再发生反应,溶液温度逐渐降低(相当于向热水中加冷水),C项错误;25 ℃时,HA的电离常数K==≈1.25×10-6,D项正确。
答案 D
7.常温常压下,将a mol CO2气体通入1 L b mol/L的NaOH溶液中,下
列对所得溶液的描述不正确的是( )
A.当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如图变化关系
B.当a=b时,所得溶液中存在:c(OH-)+c(CO)=c(H+)+c(H2CO3)
C.当2a=b时,所得溶液中存在:c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+)
D.当<<1时,所得溶液中一定存在:c(Na+)=c(CO)+c(HCO)+c(H2CO3)
解析 当a=2b时,n(CO2)∶n(NaOH)=2b mol∶b mol=2∶1,随着CO2气体的通入,发生的反应依次为2NaOH+CO2===Na2CO3+H2O、Na2CO3+CO2+H2O===2NaHCO3、CO2+H2O===H2CO3,酸或碱抑制水的电离,强碱弱酸盐促进水的电离,CO的水解程度比HCO的水解程度大,刚开始时溶液中的溶质是NaOH,抑制水的电离,当转化为Na2CO3时促进水的电离,再转化为NaHCO3时也促进水的电离,但促进水电离的程度减小,随着CO2的继续通入,生成H2CO3,H2CO3电离出的H+抑制水的电离,A项正确。当a=b时,CO2与NaOH恰好完全反应生成NaHCO3,根据质子守恒可知:c(OH-)+c(CO)=c(H+)+c(H2CO3),B项正确。当2a=b时,CO2与NaOH恰好完全反应生成Na2CO3,Na2CO3溶液中离子浓度大小关系为c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+),C项正确。当<<1时,所得溶液为Na2CO3和NaHCO3的混合溶液,结合物料守恒可知在此溶液中c(Na+)≠c(CO)+c(HCO)+c(H2CO3),D项错误。
答案 D