- 2021-08-24 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江西省鄱阳第一中学2019-2020学年高一上学期检测化学试题
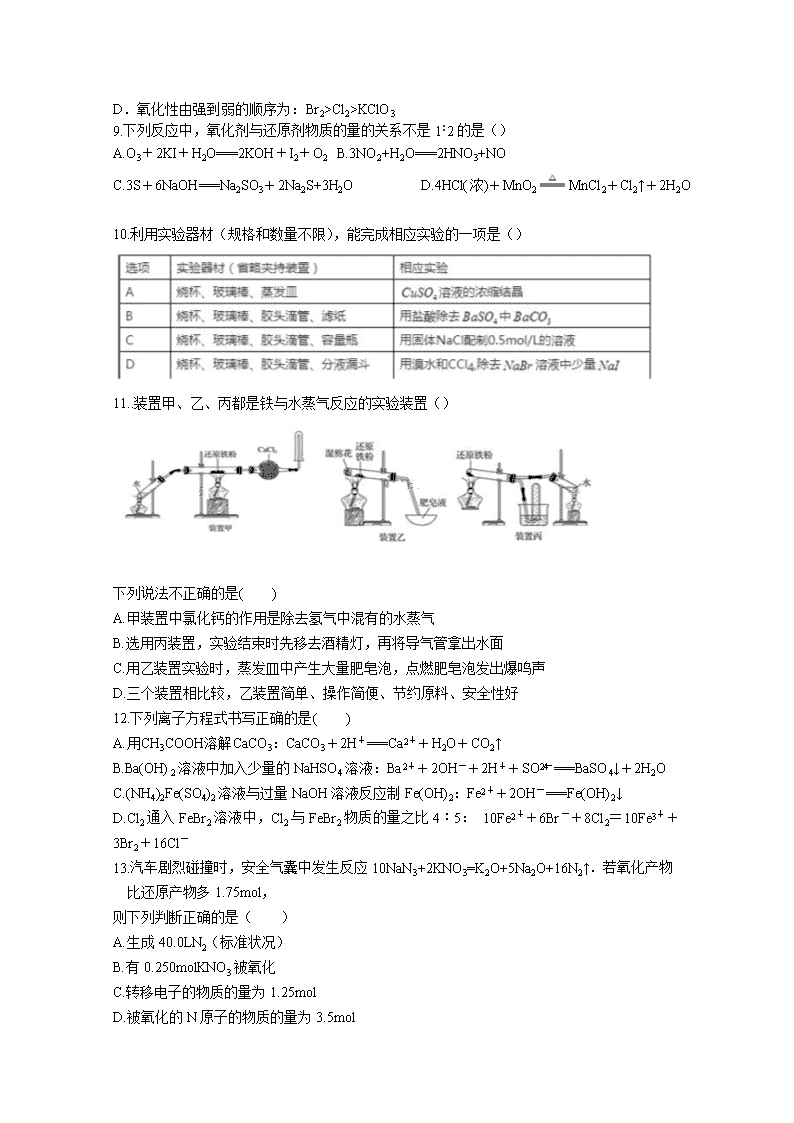
化学试卷 考试时间:90分钟试卷总分:100分 可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 Na 23 Mg 24 Ba137 第I卷(选择题共48分) 一、选择题(本大题共16小题,每小题3分,共48分,每小题只有一个正确答案) 1.下列物质的分类不正确的是() A.烧碱、纯碱、熟石灰都属于碱 B.H2SO4、HC1O、H2CO3都属于酸 C.CuO、Na2O2和干冰都属于氧化物 D. NaHCO3、CuSO4·5H20和KMnO4都属于盐 2.下列说法与胶体有关且正确的是() A、食盐水不会发生丁达尔效应 B、稀豆浆能通过半透膜 C、用氢氧化铁胶体进行电泳实验时,阴极(与电源负极相连)附近顔色加深,说明氢氧化铁胶体带正电 D、将装有淀粉溶液的半透膜袋浸入蒸馏水中,一段时间后往蒸馏水中滴入碘液,不变蓝 3.设NA表示阿伏加德罗常数的值,下列有关说法正确的是() A.在常温常压下,11.2LO2含有的分子数为0.5NA B.71gCl2所含原子数为2NA C.标准状况下,22.4LH2O含有的分子数为1 NA D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1 NA 4.VL Na2SO4溶液中含Na+mg,取出10mL稀释成50mL,则稀释后溶液中SO的物质的量浓度为:() A.mol·L-1 B.mol·L-1 C.mol·L-1 D.mol·L-1 5.将2.3 g由金属X和Mg组成的合金投入足量的稀硫酸中,充分反应后收集到标准状况下气体的体积为2.24 L, 金属X可能为( ) A.Zn B.Al C.Fe D.Cu 6.在某透明的酸性溶液中能大量共存离子组是() A.Ba2+、Na+、SO42-、HCO3-B.K+、Na+、S2-、SO42- C.K+、Cu2+、SO42-、NO3-D.NH4+、Fe2+、NO3-、SO42- 7.等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为 3∶4,则甲、乙两烧杯中的反应情况可能分别是( ) A.甲、乙中都是铝过量B.甲中铝过量,乙中碱过量 C.甲中酸过量,乙中铝过量D.甲、乙中都是铝不足 8.己知反应:①Cl2+2KBr=2KCl+Br2 ②KClO3+6HCl=3Cl2↑+KCl+3H2O据此判断下列说法正确的() A.上述两个反应都是置换反应 B.①中KC1是氧化产物,KBr发生还原反应 C.反应②中还原剂与氧化剂的物质的量之比为5: 1 D.氧化性由强到弱的顺序为:Br2>Cl2>KClO3 9.下列反应中,氧化剂与还原剂物质的量的关系不是1∶2的是() A.O3+2KI+H2O===2KOH+I2+O2 B.3NO2+H2O===2HNO3+NO C.3S+6NaOH===Na2SO3+2Na2S+3H2O D.4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O 10.利用实验器材(规格和数量不限),能完成相应实验的一项是() 实验器材(省略夹持装置) 相应实验 A 烧杯、玻璃棒、蒸发皿 硫酸铜溶液的浓缩结晶 B 烧杯、玻璃棒、胶头滴管、滤纸 用盐酸除去硫酸钡中的少量碳酸钡 C 烧杯、玻璃棒、胶头滴管、容量瓶 用固体氯化钠配制0.5mol/L的溶液 D 烧杯、玻璃棒、胶头滴管、分液漏斗 用溴水和CCl4除去NaBr溶液中的少量NaI 11..装置甲、乙、丙都是铁与水蒸气反应的实验装置() 下列说法不正确的是( ) A.甲装置中氯化钙的作用是除去氢气中混有的水蒸气 B.选用丙装置,实验结束时先移去酒精灯,再将导气管拿出水面 C.用乙装置实验时,蒸发皿中产生大量肥皂泡,点燃肥皂泡发出爆鸣声 D.三个装置相比较,乙装置简单、操作简便、节约原料、安全性好 12.下列离子方程式书写正确的是( ) A.用CH3COOH溶解CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑ B.Ba(OH)2溶液中加入少量的NaHSO4溶液:Ba2++2OH-+2H++SO===BaSO4↓+2H2O C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓ D.Cl2通入FeBr2溶液中,Cl2与FeBr2物质的量之比4︰5: 10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl- 13.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol, 则下列判断正确的是( ) A.生成40.0LN2(标准状况) B.有0.250molKNO3被氧化 C.转移电子的物质的量为1.25mol D.被氧化的N原子的物质的量为3.5mol 14.某溶液中含有下列六种离子:①HCO3- ②SO32- ③Na+ ④CO32- ⑤NH4+ ⑥NO3-,向其中加入一定量Na2O2后,溶液中 离子浓度基本保持不变的是[已知Na2O2具有氧化性]:() A.只有⑥ B.④⑥ C.③④⑥ D.①②⑤ 15.如图所示,两圆圈相交阴影部分表示圆圈内物质相互发生的反应。钠及其氧化物的物质的量均为0.1 mol,溶于水形成1L溶液。下列说法正确的是( ) A. 甲、乙、丙都属于氧化还原反应 B.甲反应的离子方程式为Na+2H2O===Na++2OH-+H2↑ C.丙充分反应,能产生0.05 mol O2,转移电子0.1 mol D.甲、乙、丙充分反应后所得溶液的物质的量浓度为c1、c2、c3,则c1=c2=c3 16.实验室用 H2和钠反应制备氢化钠的装置如右图所示(Zn 粒中含有少量 ZnS 杂质),下列说法不正确的是( ) A.①、 ②中依次盛有浓 NaOH 溶液、浓 H2SO4 B.管式炉加热前,用试管收集③处气体并点燃,通过声音判断气体纯度 C.结束反应时,先停止管式炉加热,再关闭活塞 K D.取出瓷舟内的固体,投入适量水中,若有气体产生,即可证明制得了氢化钠 第II卷(非选择题共52分) 17.(12分). 实验室需要0.1 mol·L-1 NaOH溶液450mL和0.5 mol·L-1硫酸溶液500mL。 根据这两种溶液的配制情况回答下列问题: (1)如图所示的仪器中配制溶液肯定不需要的是_______(填序号),配制上述溶液还需用到的玻璃仪器是_________ (填仪器名称)。 (2)在配制NaOH溶液时: ①根据计算用托盘天平称取NaOH的质量为______g; ②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度_____(填“偏高”、“偏低”或“不变”); ③若NaOH固体溶解后立即移入容量瓶→洗涤烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“偏高”、“偏低”或“不变”)。 (3)在配制硫酸溶液时: ①需量取质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积_______ml; ②在配制硫酸溶液时需先在烧杯中将浓硫酸进行稀释,稀释时的操作方法是_______________________________ 18(12分).(1)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As 为砷元素) ①已知KBrO3在反应中得到电子,则该反应的还原剂是 ②已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为 ③根据上述反应可推知 a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4> KBrO3 c.还原性:AsH3>X d.还原性:X > AsH3 (2)①向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发如下反应: Mn2++S2O82-+H2O→MnO4-+SO42-+H+ 该反应常用于检验Mn2+的存在。其特征现象是_________________ 若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为__________ ②将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+MnSO4+ H2SO4— Na2SO4+Bi2(SO4)3+NaMnO4+H2O I.配平上述反应的化学方程式,并用双线桥标出电子转移的方向和数目; 19(9分).现有三种可溶性物质A、B、C,其中A、B是盐,C是碱,它们溶于水后电离产生的所有离子如下表所示: 阳离子 Na+ H+ Ba2+ 阴离子 OH- CO32- SO42- 请根据下列叙述回答问题: (1)C的化学式为_____________。 (2)A溶液与B溶液反应可生成气体X,则X的化学式为_______ (3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸 ① B的化学式为_____________,鉴别溶液B中的阴离子的方法:________________________________________ ② D溶于稀硝酸的离子方程式为________________________________ ③ D与E的混合物a g,加入足量盐酸,完全反应生成的气体在标准状况下体积为b L,则求 算E在混合物中的质量分数的表达式为________________________________________ 20(13分).碳酸钠与工农业生产、日常生活紧密相关。工业上碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品 往往含有少量的NaCl,现欲测定碳酸钠样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。 方案一:沉淀分析法 (1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀________(填操作名称)、洗涤、烘干、称量。 洗涤沉淀的操作是________________________________________. 方案二:气体分析法 (2)用如图所示装置,将一定质量的样品与足量盐酸反应,并测定产生 CO2气体的体积, 为了使测量结果准确,B中的溶液最好采用________(填字母)。 a.饱和碳酸钠溶液 b.饱和碳酸氢钠溶液 c.饱和氢氧化钠溶液 d.氯化钠溶液 但选用该溶液后实验结果仍然不够准确,原因是________________________________ 方案三:质量差分析法 (3)采用如图所示装置,将一定质量的样品与足量的稀硫酸反应,通过称量反应前后盛有碱石灰的干燥管的质量,利用其质量差计算样品的纯度。 该实验的操作步骤: ①在干燥管内装满碱石灰,质量为m1g ②取ng样品装入广口瓶中 ③检查装置的气密性 ④缓慢鼓入空气数分钟,再称量干燥管质量为m2g ⑤关闭止水夹 ⑥打开止水夹 ⑦缓慢加入稀硫酸至不再产生气体为止 ⑧缓慢鼓入空气数分钟 Ⅰ.正确的操作顺序是(填序号):③→_____→⑥→_____→⑤→________→⑦→________→④。 Ⅱ.在操作④中,要缓慢鼓入空气数分钟,鼓入空气的作用是________________;装置 B的作用是__________________ 21(6分)把一块表面已部分被氧化为氧化钠的钠块1.08g放入20g水中,得到标准状况下氢气224mL。求: ② 被氧化前钠块的质量。 ②所得溶液中溶质的质量分数(计算结果均保留两位有效数字) 化学答案 答案 1,C 2, D 3,C 4,A 5, B 6, B 7, C 8,B 9, C 10, C 11,C 12,C 13, C 14,B 15, C 16,D 17.(共10分,每空2分) (1). SiO2+2NaOH===Na2SiO3+H2O (2). ①② (3). SiCl4+3H2O===4HCl↑+H2SiO3↓或SiCl4+4H2O===4HCl↑+H4SiO4↓ (4). 3SiCl4+4NH3Si3N4+12HCl (5). 3C+SiO2SiC+2CO↑ 18.(共8分) (1). 第三周期ⅥA族(1分) (2). <(1分) (3). (1分) (4). SO+2H+===H2O+SO2↑或HSO+H+===H2O+SO2↑(2分) (5). H2O2 (6). OH-+CN-+H2O2===CO+NH3↑(2分) 19.(共8分) (1). Fe3+(1分) (2). 取一定量的滤液,滴加少量KMnO4溶液,KMnO4溶液褪色(2分) (3). 将Fe2+全部氧化为Fe3+(1分) (4). Fe3++3OH-=Fe(OH)3↓[或Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+] (2分) (5). 0.07a(2分) 20.(共10分) (1). 碱石灰(或其他合理答案)(1分)防止倒吸(1分) (2). 把装置中残留的氨气全部赶入C装置(2分) (3). 未排除C装置出口处空气中水蒸气的干扰(2分) (4). CO2 +AlO2-+2H2O =HCO3-+Al(OH)3↓(2分) (5). (2分) 21. (共8分,每空2分)(1) 29(m3﹣m1)/(m2﹣m1)(2) 2:3 (3) 32:21 (4) 5.4g 22. (共8分,每空2分)(1). 16.25 (2). 700 (3). 2Fe O ·Fe2O3 (4). (7.73g, 11.4 g)查看更多