四川省成都市青白江区南开为明学校2019-2020学年高二下学期期中考试化学试卷
四川省成都市青白江区南开为明学校2019-2020学年高二下学期期中考试化学试卷
姓名:_________班级:_________考号:_________
可能用到的相对原子质量:H-l C-12 O-16 S-32 Fe-56
第Ⅰ卷(选择题,40分)
一、单项选择题(每题2分,共40分)
1.冰激凌中的奶油被称为人造脂肪,由液态植物油氢化制得。下列说法错误的是
A.奶油是可产生较高能量的物质 B.人造脂肪属于酯类物质
C.植物油中含有碳碳双键 D.油脂的水解反应均为皂化反应
2.下列物质分类正确的是
A.豆浆、蛋白质溶液均属于胶体 B.H2O、CO2均为电解质
C.NO、SO3均为酸性氧化物 D.H2S、O2常作还原荆
3.下列化学用语正确的是
A.中子数为2的氢原子: B. Na+的结构示意图:
C.OH-的电子式:[H]一 D.N2分子的结构式:N-N
4.下列比较错误的是
A.与水反应的剧烈程度:K
HCl
C.原子半径:Si>N D.碱性:Ca(OH)2>Mg(OH)2
5.下列做法中观察到的现象可以说明钠的密度比水小的是
A.用小刀切开金属钠 B.将钠放在坩埚中加热
C.把钠保存在煤油中 D.将钠放入盛水的烧杯中
6.甲苯是重要的化工原料。下列有关甲苯的说法错误的是
A.分子中碳原子一定处于同一平面 B.可萃取溴水的溴
C.与H2混合即可生成甲基环己烷 D.光照下与氯气发生取代反应
7.在下列工业处理或应用中不属于化学变化原理的是
A.石油分馏 B.从海水中制取镁 C.煤干馏 D.用SO2漂白纸浆
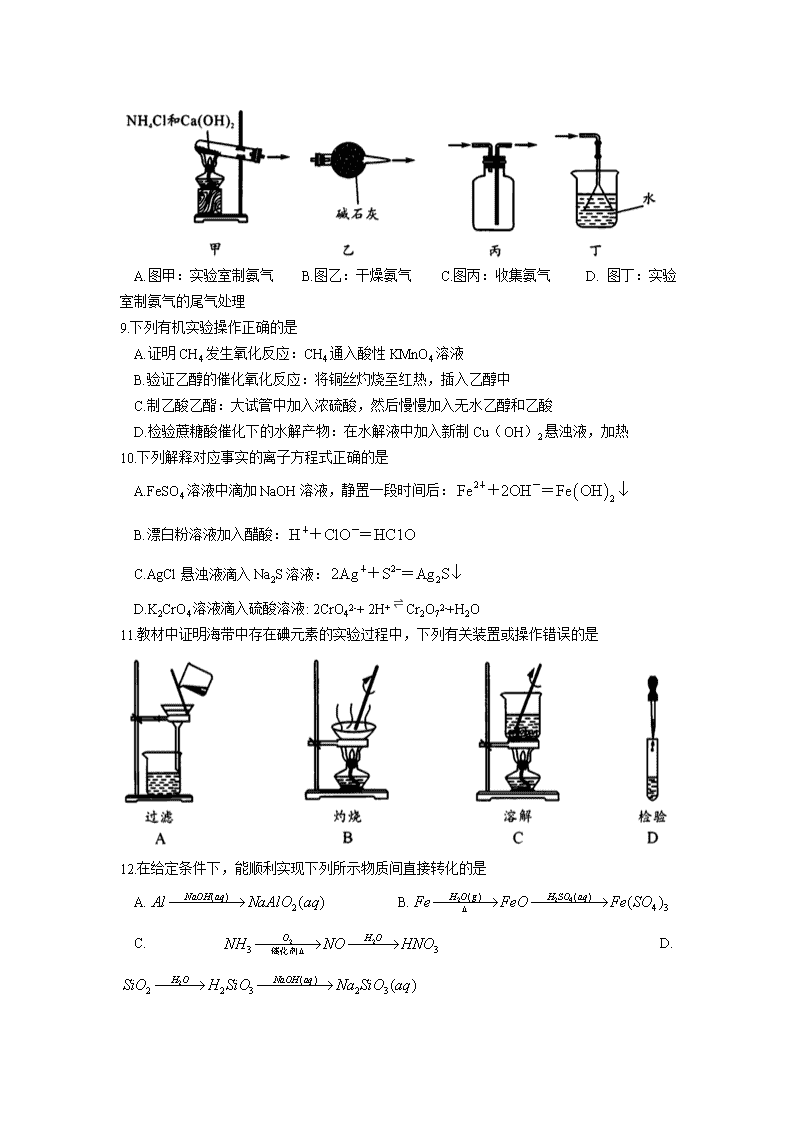
8.下列有关氨气的制备、干燥、收集和尾气处理错误的是
A.图甲:实验室制氨气 B.图乙:干燥氨气 C.图丙:收集氨气 D. 图丁:实验室制氨气的尾气处理
9.下列有机实验操作正确的是
A.证明CH4发生氧化反应:CH4通入酸性KMnO4溶液
B.验证乙醇的催化氧化反应:将铜丝灼烧至红热,插入乙醇中
C.制乙酸乙酯:大试管中加入浓硫酸,然后慢慢加入无水乙醇和乙酸
D.检验蔗糖酸催化下的水解产物:在水解液中加入新制Cu(OH)2悬浊液,加热
10.下列解释对应事实的离子方程式正确的是
A.FeSO4溶液中滴加NaOH溶液,静置一段时间后:
B.漂白粉溶液加入醋酸:
C.AgCl悬浊液滴入Na2S溶液:
D.K2CrO4溶液滴入硫酸溶液: 2CrO42-+ 2H+ ⇌ Cr2O72-+H2O
11.教材中证明海带中存在碘元素的实验过程中,下列有关装置或操作错误的是
12.在给定条件下,能顺利实现下列所示物质间直接转化的是
A. B.
C. D.
13.W、X、Y、Z均为短周期主族元素且原子序数依次增大。W最外层电子数是次外层电子数的3倍,W与Y同主族,X在短周期中原子半径最大。下列说法正确的是
A.常温常压下Y的单质为气态 B.X的氧化物是离子化合物
C.X与Z形成的化合物的水溶液呈碱性 D.W与Y具有相同的最高化合价
14.设NA为阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,1 mol N2和3 mol H2催化反应后分子总数为2NA
B.100g 98%的浓H2SO4与过量的Cu反应后,电子转移数为NA
C.标准状况下,11.2 L氧气和二氧化碳混合物中含氧原子数目为NA
D.1 L 1 mol/L Na2CO3溶液中所含阴离子数目小于NA
15.研究海水中金属桥墩的腐蚀及防护是桥梁建设的重要课题。下列有关说法错误的是
A.桥墩的腐蚀主要是析氢腐蚀 B.钢铁桥墩在海水中比在河水中腐蚀更快
C.图1辅助电极的材料可以为石墨 D.图2钢铁桥墩上发生的反应是O2+2H2O+4e-=4OH-
16.下列操作能达到实验目的的是
目 的
实验操作
A
Al2O3有两性
将少量Al2O3分别加入盐酸和氨水中
B
浓硫酸有脱水性
蔗糖中加入浓硫酸,用玻璃棒充分搅拌
C
检验SO42-
向某溶液中滴加少量酸化的BaCl2溶液
D
检验Fe2+
向某溶液中滴入氯水,再滴入KSCN溶液
17.下列有关电解质溶液的说法正确的是
A.0.1 mol/L氨水中滴入等浓度等体积的醋酸,溶液导电性增强
B.适当升高温度,CH3COOH溶液pH增大
C.稀释0.1 mol/L NaOH溶液,水的电离程度减小
D.CH3COONa溶液中加入少量CH3COOH,减小
18.在酸性条件下,黄铁矿(FeS2)催化氧化的反应方程式为2FeS2+7O2+2H2O=2Fe2+
+4SO42-+4H+,实现该反应的物质间转化如图所示。下列分析错误的是
A.反应I的离子方程式为4Fe(NO)2++O2+4H+=4Fe3++4NO+2H2O
B.反应Ⅱ的氧化剂是Fe3+
C.反应Ш是氧化还原反应
D.黄铁矿催化氧化中NO作催化剂
19.温度T°C时,在初始体积为1L的两个密闭容器甲(恒容)、乙(恒压)中分别加入0.2molA和0.1molB,发生反应2A(g)+B(g) ⇌XC(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
A.x可能为4 B.M为容器甲
C.容器乙达平衡时B的转化率为25% D.M的平衡常数大于N
20.0.1mol/L二元弱酸H2A溶液中滴加0.1mol/LNaOH溶液,溶液中的H2A、HA-、A2-的物质的量分数随pH的变化如图所示。下列说法错误的是
A.pH=1.9时,
B.当时,溶液pH>7
C.pH=6时,
D.lg[Ka2(H2A)]=-7.2
第Ⅱ卷(选择题,共60分)
21.(6分)氢、碳和氯的单质及化合物在生产和生活中有广泛用途。
(1)H2(g)+Cl2(g)=2HCl(g) ΔH反应的能量变化示意图如图1所示,其中436kJ/mol表示的含义是 ,由图计算ΔH= kJ/mol。
(2)金刚石、石墨的燃烧热分别为395.4kJ/mol和393.5kJ/mol。图2是两者相互转化的能量变化示意图,A表示的物质为 。
22.(11分)二氧化硫在生产和生活中有着广泛的用途。
(l)SO2可用来制备定影剂Na2S2O3,反应的化学方程式为:Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2↑。请用单线桥表示该反应中的电子转移情况,还原剂与氧化剂的物质的量之比为 。
(2)用足量NaOH溶液吸收尾气中的SO2,反应的离子方程式为 ;吸收后的浓溶液可用图1的装置再生循环脱硫,并制得硫酸,电极a的电极反应为 ,乙是 。
(3)可设计二氧化硫空气质子交换膜燃料电池处理尾气中的二氧化硫,原理如图2所示。其能量转化的主要形式是 ,c电极是 极,移动的离子及方向是 。
23.(12分)有机物数量众多,分布极广,与人类关系非常密切。
(1)石油裂解得到某烃A,其球棍模型为,它是重要的化工基本原料。
①A的结构简式为 ,A的名称是 。
②A与溴的四氯化碳溶液反应的化学方程式为 。
③,AC的反应类型是 ,C+DE的化学方程式为 ,鉴别C和D的方法是 。
④A的同系物B的相对分子质量比A大14,B的结构有 种。
(2)生苹果肉遇碘酒变蓝,熟苹果汁能与银氨溶液反应,苹果由生到成熟时发生的相关反应方程式为 。
24.(11分)硝酸亚铁可用作媒染剂、分析试剂、催化剂等。
(1)硝酸亚铁可用铁屑在低温下溶于稀硝酸制得,还原产物为NO。反应的化学方程式为
。
(2)某小组为探究硝酸亚铁晶体的热分解产物,按下图所示装置进行实验。
①仪器B的名称是 ,实验中无水CuSO4变蓝,由此可知硝酸亚铁晶体含有 。
②实验中观察到A装置的试管中有红棕色气体生成,检验热分解后固体为氧化铁的实验方案为:
实验步骤
现 象
取少量固体加适量稀硫酸,振荡,将溶液分成两份
固体溶解得黄色溶液
一份滴入
溶液变成红色
另一份滴入1~2滴K3[Fe(CN)6]溶液
A中硝酸亚铁晶体[Fe(NO3)2xH2O]分解的化学方程式为 。
(3)继续探究mg硝酸亚铁晶体中铁元素的质量分数。
①取A中热分解后的固体放入锥形瓶,用稀硫酸溶解,加入过量的KI溶液,滴入2滴 作指示剂。
②用a mol/L Na2S2O3标准溶液滴定锥形瓶中的溶液(已知:I2+2S2O32-=2I-+S4O62-),滴定至终点时用去b mL Na2S2O3溶液,则硝酸亚铁晶体中铁的质量分数为 。
25.(11分)碲是发展高科技产业、国防与尖端技术不可或缺的原料。H2TeO3是一种比草酸酸性弱的二元酸,工业上常用铜阳极泥[主要成分是碲化亚铜(Cu2Te),含少量的Ag、Au]回收碲,其工艺流程如下:
已知:CuC2O4的Ksp为2.2×10-8;离子浓度小于1×10-5mol/L时,即离子完全沉淀。
(l)Cu2Te中Te的化合价是 。
(2)滤渣的成分是 ,滤液①中含有的氧化酸浸时氧化产物为 。氧化酸浸时温度过高会使碲的浸出率降低,原因是 。
(3)若要使Cu2+完全沉淀,应控制C2O42-的浓度不低于 。
(4)还原反应的离子方程式为 。
26.(9分)二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00 molCO2和2.00 mol H2以及催化剂发生反应:CO2(g) + H2(g) ⇌ HCOOH(g) △H,测得n(H2)/mol在不同温度随时间的变化如下表:
实验编号
时间/min
物质的量/mol
60
90
120
150
180
I
Tl/K
1.50
1.32
1.28
1.26
1.26
Ⅱ
T2/K
1.45
1.20
1.10
1.10
1.10
(1)比较实验温度T1 T2(填“>”、“<”),该反应的ΔH 0(填“>”、“=”或“<”)。
(2)实验I中0~60 min内用HCOOH表示的该反应的平均反应速率为 。
(3)实验Ⅱ反应开始时体系压强为P0,第90min时体系压强为Pl,则Pl:P0= 。
(4)比较实验I、Ⅱ在80 min时的逆反应速率大小vl vⅡ(填“>”、“<”或“无法判断”),原因是 。
答案:
26. (1) 小于 大于(2)0.0042mol/(L.min) (3)4:5 (4)小于 Ⅱ的温度比较高 e-huaxue.com)